方镕泽,曾 奇,吴红梅,刘 明,唐秀胜,3
(1.贵州中医药大学 药学院,贵州 贵阳 550025;2.贵州中医药大学 基础医学院,贵州 贵阳 550025;3.贵州中医药大学第一附属医院 药剂科,贵州 贵阳 550001)
胃溃疡(gastric ulcer,GU)是一种常见的消化系统疾病,临床上主要表现为周期性上腹部疼痛,严重时会导致幽门梗阻和呕血,甚至是胃穿孔并发生癌变[1]。由于该病具有发病周期长,复发性高,并发症多等特点,常常给患者的精神和健康造成严重影响[2-3]。GU的发生主要由饮酒过量、吸烟、氧化应激和幽门螺杆菌感染和非甾体抗炎药的滥用等因素有关[4-5]。目前临床上常采用H2受体拮抗剂、质子泵抑制剂、组胺受体抑制剂和抗酸剂等治疗[6-8]。然而,这些药物对GU的治疗效果有限,长期使用可能引起胃黏膜结构和功能的变化,如造成胃底腺息肉的形成、肠嗜铬样细胞增生和高胃泌素血症等副作用[9]。中药在治疗疾病方面具有多靶点、多环节,毒副作用小的独特优势,这使得中药在治疗GU具有较大潜力。
中药黄花白及(BletillaochraceaSchltr,BOS)作为白及的同属植物,具有润肺止咳、收敛止血、消肿生肌的功效[10]。现有研究表明,中药白及与黄花白及化学成分相似[11-13]。药理研究发现,黄花白及水提物能减轻乙醇导致的胃损伤,在炎症水平上黄花白及提取物能减低TNF-α、IL-6、IL-1β和ET-1的释放及COX-2和NF-κB p65蛋白表达,同时具有免疫调节抗肿瘤活性[14]。但从中医药整体观阐明黄花白及治疗GU鲜有文献报道。
网络药理学是基于系统生物学原理,结合现代计算机技术构建出“药物-靶点-疾病”相互作用网络,具有多维度和中医药治疗疾病整体观的特点。本研究将通过网络药理学技术筛选黄花白及治疗GU的作用靶点,并通过分子对接结合乙酸诱导的GU大鼠模型验证其靶点及潜在机制,为黄花白及临床治疗GU奠定坚实的理论基础和科学依据。
1 材料与方法
1.1 数据库资料收集
1.1.1 黄花白及活性成分及靶点的收集 在Pubmed及中国知网等数据库查阅黄花白及已报道的化学成分,利用TCMIP(http://www.tcmip.cn)、TCMSP(https://tcmsp-e.com /tcmsp.php)和相关文献收集黄花白及活性成分和成分对应的靶点,删除共有靶点后整理成数据集。
1.1.2 GU靶点及共有靶点收集 在Gencard数据库(https://genecards.org/)中输入“Gastric ulcer”获取与GU相关的靶点信息。将黄花白及的成分靶点和GU的靶点进行了映射,取两者的交集以找出疾病和药物之间的共同潜在靶点。
1.1.3 PPI 网络与核心靶点 为了寻找黄花白及治疗GU的核心靶点,将疾病和药物的共同潜在靶点导入String数据库构建PPI网络。使用Cytoscape 3.6.1对PPI网络获得的“tsv”文件进行了网络拓扑分析和可视化,由此得到各蛋白之间的相互关系。
1.1.4 GO分析和KEGG分析 将PPI分析获得的核心靶点输入David数据库,物种选择“Homo sapiens”,对核心靶点进行GO分析和KEGG富集分析。
1.1.5 分子对接验证 在PDB数据库(http://www.rcsb.org/)下载IL-6的晶体结构(ID:1ALU)、TNF的晶体结构(ID:1TNF)、IL-1β的晶体结构(ID:1I1B)和NF-κB p65的晶体结构(ID:1NFI),并进行去水加氢、修复侧链、选择自动寻找活性位点等处理。化合物通过TCMSP进行下载,并使用Chem3D进行能量最小化,启动运行SYBYL-X 2.0软件模块中的“Dock Ligand”模块对IL-6、TNF、IL-1β和NF-κB p65的晶体结构进行对接。
1.2 黄花白及治疗GU的实验验证
1.2.1 实验动物与药物
1.2.1.1 实验动物 本研究使用SPF级雄性SD大鼠(180~220 g,贵州中医药大学动物研究所),实验动物生产许可证号SYXK (黔)2021-0005。动物饲养环境(25±2)℃,相对湿度为40%~60%。实验前禁食12 h,不禁水。
1.2.1.2 药物与试剂 黄花白及采自四川省宜宾市翠屏区白花镇,经贵州民族大学王祥培教授鉴定为兰科白芨属植物黄花白及(BletillaochraceaSchltr,Bos)的块茎。白及多糖含量(HPLC)为98.32%,购买于西安泽郎生物科技有限公司,批号:ZLSW2 20410-1;雷尼替丁胶囊,购买于苏州弘森药业股份有限公司,批号:306220503;乙酸,购买于天津市科密欧化学试剂有限公司,批号:20230110;IL-6,货号:E-EL-R0015c;TNF-α,货号:E-EL-R2856c;IL-1β,货号:E-EL-R0012c;EGF,货号:E-EL-R0369c,以上试剂盒均购买于伊莱瑞特生物科技有限公司。
1.2.2 药物制备
1.2.2.1 黄花白及提取液的制备 取黄花白及适量,加8倍量水煎煮,煎煮3次,武火煮开后转文火保持微沸状态30 min,合并滤液,干燥浓缩得流浸膏,放冰箱备用。
1.2.2.2 乙酸溶液的制备 精密量取乙酸30 mL,用蒸馏水配至200 mL(体积分数15%),每次现配现用。
1.2.2.3 阳性对照药物的制备 取雷尼替丁6粒,每粒0.15 g,加入30 mL生理盐水溶解,每天现用现配,配成30 mg/mL。
1.2.3 实验方法
1.2.3.1 动物造模及给药 大鼠适应性喂养7 d,采用随机数字表法将动物分为7个组,每组6只,分别为正常组(Control)、模型组(Model)、西药阳性组(Ranitidine)、白及多糖组(BSP)及黄花白及的低、中、高剂量组。除正常组(Control)不进行干预外,剩下的36只采用乙酸建立GU模型,具体操作为每天给予15%乙酸1 mL /次/只,持续4 d。在造模结束后的1 d开始,西药阳性组(Ranitidine)给予0.3 g/kg的剂量进行灌胃、白及多糖组(BSP)给予0.5 g/kg的剂量进行灌胃,黄花白及(BOS)的低、中、高剂量给予0.675、1.35、2.7 g/kg进行灌胃,灌胃体积10 mL/kg,正常组(Control)和模型组(Model)给予等体积的蒸馏水,持续10 d,每天1次。本实验通过贵州中医药大学实验动物伦理委员会审批(NO:20230004)。
1.2.3.2 样本采集及检测 大鼠禁食不禁水12 h,在末次给药1 h后,用20%乌拉坦(0.6 mL/100 g)腹腔注射麻醉,取出胃组织,清洗后置于-80 ℃冰箱中冷藏。采用酶联免疫吸附法(ELISA 法)测定大鼠胃组织中IL-6、TNF-α、IL-1β、EGF和MPO的水平。
1.2.3.3 胃组织病理学研究 胃组织用10%福尔马林溶液固定48 h以上,然后在梯度醇中脱水并包埋石蜡,将包埋好的胃石蜡块在标本持夹头上夹紧,充分暴露胃切面,切下4 μm切片,中性树胶封片。镜下观察胃的组织形态结构,并进行评分。评分方法为(1)0分:黏膜、黏膜下层、肌层组织结构清晰,无明显异常;(2)1分:小灶浅表黏膜坏死,黏膜下层及肌层无异常;(3)2分:小面积黏膜溃疡形成深达肌层,溃疡灶内充血水肿、较多炎细胞浸润;(4)3分:大面积溃疡形成深达肌层,溃疡灶内充血水肿、大量炎细胞浸润。
1.3 统计学分析 采用 GraphPad Prism 8. 0 软件对数据进行统计分析,单因素方差分析用于多组间统计差异分析,两两组间比较采用SNK-q检验。P< 0.05代表差异有统计学意义。
2 结果
2.1 黄花白及活性化合物及靶点的筛选 从Pubmed和中国知网查阅相关文献,共筛选出黄花白及活性成分8个,包括daucosterol、Militarine、7-methoxy-9,10-dihydrophenanthrene-2,5-diol、β-sitosterol、1-(4-hydroxybenzyl)-4-methoxy-9,10-dihydrophenanthrene-2,7-diol、batatasin Ⅲ、Stigmasterol和Erianthridin。通过查询TCMSP、TCMIP数据库及相关文献,删除重复靶点后得到129个黄花白及的潜在作用靶点。
2.2 GU靶点及共同靶点的收集 在GeneCard数据库中输入“Gastric ulcer”搜索GU相关靶点,并筛选“Relevance score”大于1的靶点,共得到GU靶点4 111个。在Venny 2.1.0中将GU靶点及黄花白及成分对应的靶点进行导入,得到黄花白及治疗GU的靶点70个(图1)。
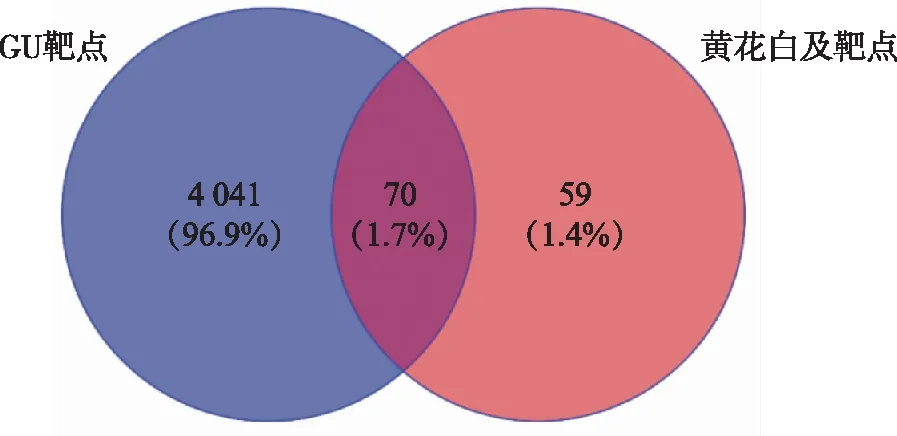
图1 黄花白及与GU靶点韦恩图
2.3 PPI网络构建及分析 将70个共同靶点导入String数据库中构建PPI网络,以此探索各靶点之间的作用关系。之后将String得到的“tsv”文件导入Cytoscape 3.6.1中进行网络可视化,导出“csv”文件,选择大于Degree中位数的靶点,最终得到34个核心靶点并进行可视化(图2)。根据度值将蛋白靶点从大到小排列,度值前5的核心靶点依次为 TNF(度值 41)、IL-6(度值 40)、IL-1β(度值 38)、PTGS2(度值 33)和PPARG(度值 32),见表1。
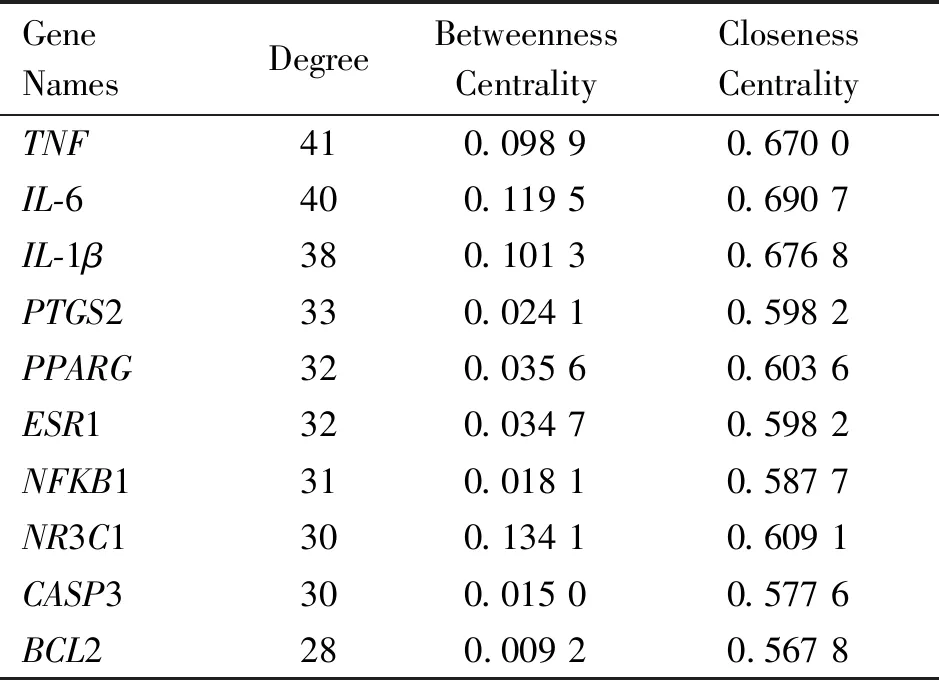
表1 核心靶点及其拓扑学参数
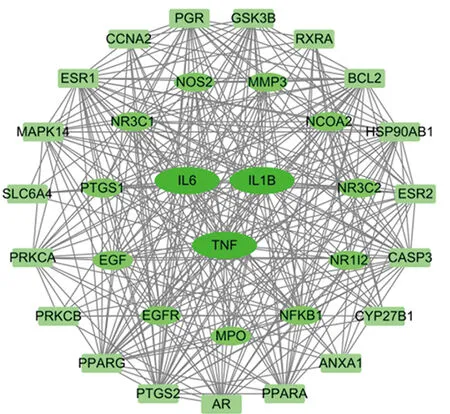
图2 核心靶点的 PPI 网络
2.4 GO分析及KEGG富集分析 GO分析结果表明,黄花白及抗GU涉及生物过程228条、细胞组成24条和分子功能53条。根据富集结果,这些基因与DNA 触发的转录正向调节、细胞内类固醇激素受体信号通路、RNA 聚合酶Ⅱ启动子转录的正向调节、细胞凋亡过程的负向调节。与分子功能相关的项目有:RNA聚合酶Ⅱ转录因子活性,配体激活序列特异性DNA结合、雌激素反应元件结合、酶结合、序列特异性DNA结合、类固醇激素受体活性和类固醇绑定;与细胞组成相关的项目有核质、染色质、细胞核、大分子复合体、细胞质和线粒体,具体见图3A。KEGG富集分析结果显示,黄花白及治疗GU涉及的通路有118条,这些通路包括IL-17 signaling pathway、HIF-1 signaling pathway、TNF signaling pathway和NF-kappa B signaling pathway和PI3K-Akt signaling pathway等,具体见图3B,这些通路大多与 IL-6、TNF和IL-1β等靶点有关。
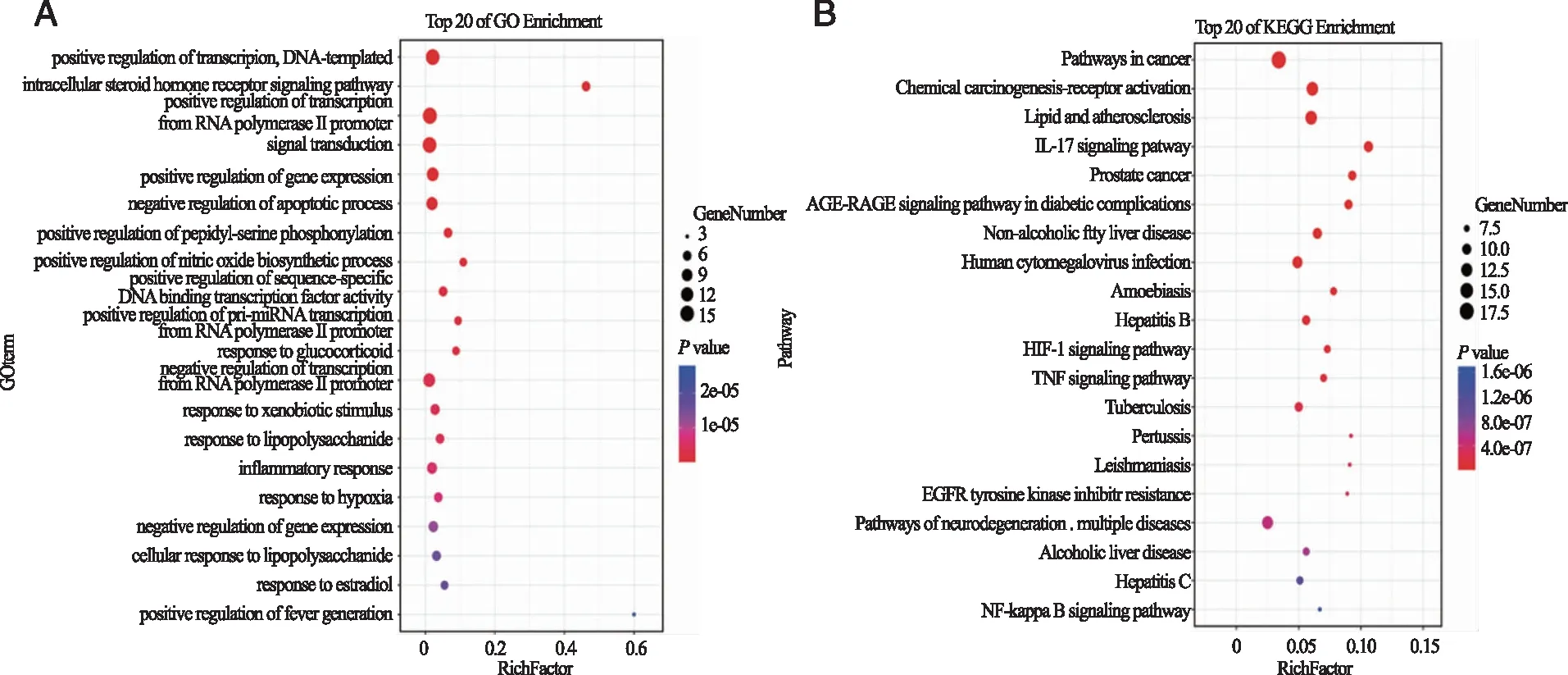
A:GO富集分析生物过程;B:KEGG富集分析。图3 黄花白及治疗GU的GO和KEGG富集分析
2.5 分子对接结果 基于蛋白互作网络分析结果,筛选Degree值排名前3的靶点IL-6、TNF和IL-1β及NF-κB通路的核心靶点NF-κB p65与黄花白及化合物进行分子对接,结果如表2所示。以总打分值(Total Score)≥ 4为筛选条件选取对接结果较好的化学成分及靶点,筛选结果表明,IL-6、TNF、IL-1β、NF-κB p65与Daucosterol、1-(4-hydroxybenzyl)-4-methoxy-9,10-dihydrophenanthrene-2,7-dioll、bata tasin Ⅲ、β-sitosterol等化合物对接结果总打分较高,总打分值越高说明结合较为稳定。最后对分子对接评分排名前3的结果进行可视化处理(图4)。
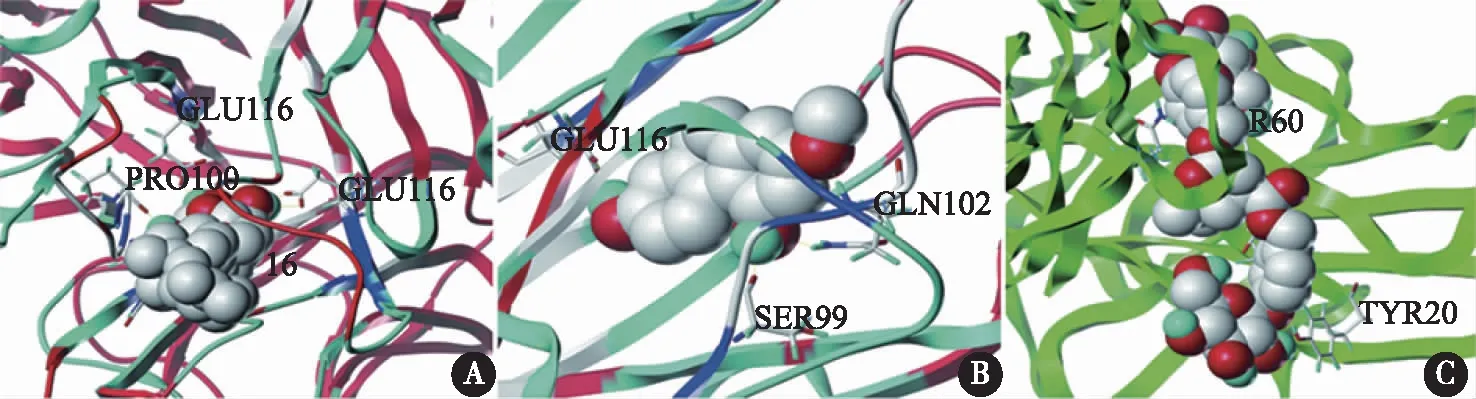
A:daucosterol-TNF;B:batatasin Ⅲ-TNF;C:Militarine-IL1β。图4 分子对接结果
2.6 动物实验结果
2.6.1 黄花白及对GU大鼠的胃组织形态学观察 最后1次给药1 h后,对大鼠胃部进行解剖,观察其胃部溃疡状态。正常大鼠的胃黏膜表面较为光滑,呈粉红色,胃中黏液丰富,黏膜皱襞多,无出血点(图5A);模型组大鼠胃黏膜损伤严重,肉眼可见有严重的黑色溃疡面,并且在胃组织与周围组织部分可见粘连的现象(图5B);雷尼替丁,BSP及BOS低、高剂量组的大鼠胃黏膜无明显的出血点,表观形态与正常组相似。BOS中剂量组的大鼠胃黏膜可见有轻微的出血点,黏膜有轻度充血和肿胀(图5C~G)。
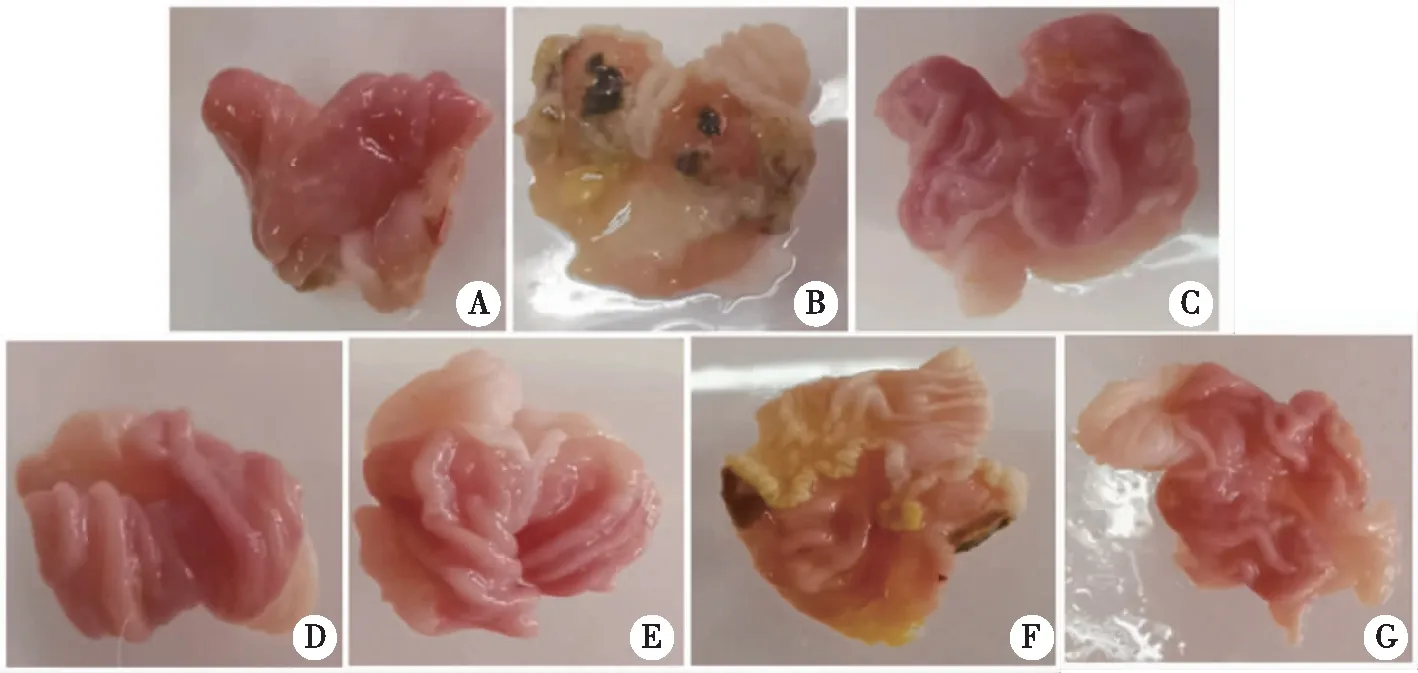
A:空白对照组;B:模型组;C:雷尼替丁组(Ranitidine-0.3 g/kg);D:白及多糖组(BSP-0.5 g/kg);E:黄花白及低剂量组(BOS-0.675 g/kg);F:黄花白及中剂量组(BOS-1.35 g/kg);G:黄花白及高剂量组(BOS-2.7 g/kg)。图5 黄花白及对大鼠胃黏膜损伤的形态学观察
2.6.2 HE病理学特征 镜下见空白组胃黏膜表面光滑、黏膜细胞及腺体排列整齐,黏膜下层、肌层及浆膜层形态结构无异常(图6A)。模型组动物胃黏膜可见不同程度的溃疡形成,形成的溃疡深达肌层,溃疡灶面积较大,溃疡灶及周围组织充血水肿并有大量炎细胞浸润(图6B)。与模型组比较,黄花白及中剂量组有小面积黏膜溃疡形成,并且溃疡灶内充血水肿、可见炎细胞浸润(图6F);雷尼替丁、白及多糖及黄花白及低,高剂量组黏膜损伤均有一定改善,表现为以浅表黏膜损伤为主,溃疡形成不明显(图6C、D、E、G)。之后对大鼠胃黏膜损伤程度进行评分,评分结果表明,相比空白组,模型组的病理评分极显着升高。与模型组相比,雷尼替丁组、白及多糖组(BSP),黄花白及低、高剂量组的病理评分呈显着降低(图7)。由此可见,黄花白及对胃黏膜损伤具有一定的改善作用。
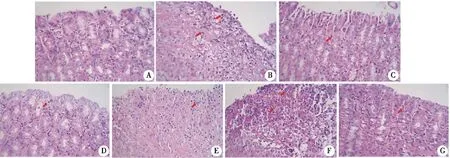
A:空白对照组;B:模型组;C:雷尼替丁组(Ranitidine-0.3 g/kg);D:白及多糖组(BSP-0.5 g/kg);E:黄花白及低剂量组(BOS-0.675 g/kg);F:黄花白及中剂量组(BOS-1.35 g/kg);G:黄花白及高剂量组(BOS-2.7 g/kg);×400。图6 黄花白及对GU大鼠胃组织病理的影响
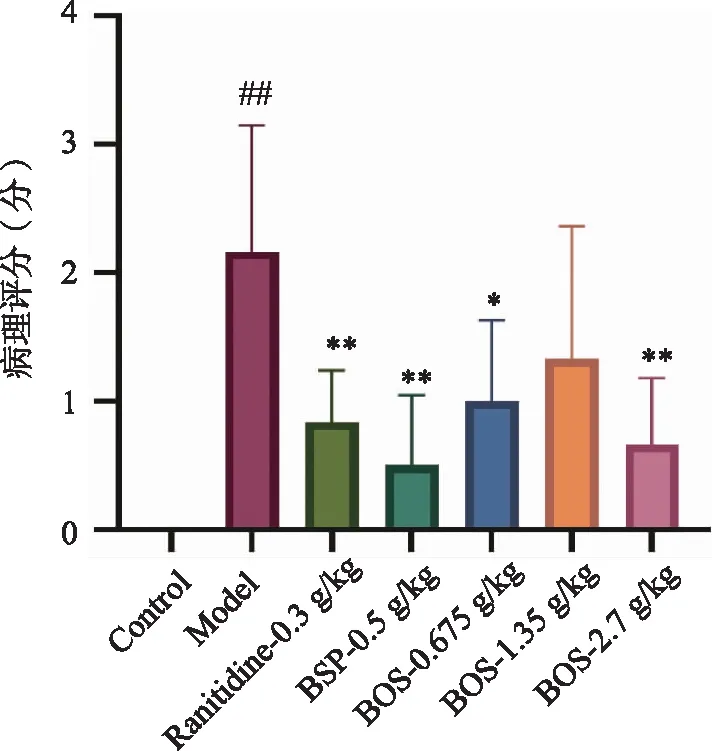
##:与对照组比较,P<0.01;*、**:与模型组比较,P<0.05、P<0.01。图7 黄花白及对GU大鼠病理评分的影响
2.6.3 BOS对GU炎症指标及保护因子的影响 BOS对GU大鼠炎症指标及胃黏膜保护因子的检测结果见图8,TNF-α ELISA检测结果表明,与空白组相比,模型组大鼠胃黏膜中TNF-α含量显着上升(图8A,P< 0.01)。与模型组相比,雷尼替丁组和黄花白及各剂量组大鼠胃黏膜中TNF-α含量显着下降(P< 0.01)。IL-6 ELISA检测结果表明,与空白组相比,模型组大鼠胃黏膜中IL-6含量显着上升(图8B,P< 0.01)。与模型组相比,黄花白及各剂量组大鼠胃组织中IL-6含量显着下降(P< 0.01)。IL-1β ELISA检测结果表明,与空白组相比,模型组大鼠胃组织中 IL-1β含量无显着性差异(图8C,P> 0.05)。与模型组相比,雷尼替丁组,BSP及黄花白及各剂量组大鼠胃组织中 IL-1β含量显着下降(P< 0.01)。EGF ELISA检测结果表明,与空白组相比,模型组大鼠胃组织中EGF含量极显着降低(图8D,P<0.01),与模型组相比,BSP及黄花白及低、中剂量组均能显着升高大鼠胃组织中EGF含量(P< 0.01)。MPO ELISA结果表明,与空白组相比,模型组大鼠胃组织中MPO含量极显着升高(图8E,P< 0.01)。与模型组相比,雷尼替丁组、BSP组和BOS的各剂量组胃组织中MPO含量显着降低(P< 0.05、P< 0.01)。由此可见,黄花白及能减少胃组织中促炎因子TNF-α、IL-6、IL-1β和MPO的释放,抑制炎症的发生和蔓延,此外还可以增加EGF的释放,避免胃黏膜进一步损害。
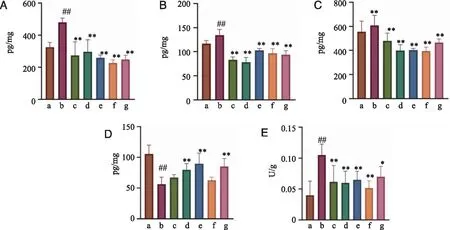
A: TNF-α;B: IL-6;C: IL-1β;D: EGF;E: MPO;a:Control;b:Model;c:Ranitidine-0.3 g/kg;d:BSP-0.5 g/kg;e:BOS-0.675 g/kg;f:BOS-1.35 g/kg;g:BOS-2.7 g/kg;#、##:与对照组比较,P < 0.05、P < 0.01;*、**:与模型组比较,P < 0.05、P < 图8 黄花白及对模型大鼠胃组织TNF-α、IL-6、IL-1β、EGF和MPO水平的影响
3 讨论
白及作为传统中药,具有收敛止血的功效。现有研究表明,白及能降低乙酸诱导的胃溃疡大鼠溃疡指数及病理损伤;此外还能降低胃溃疡大鼠 IL-1β、IL-6和TNF-α基因及含量,并使NF-κB p65 基因及蛋白表达水平均显着降低[15]。黄花白及作为中药白及的近缘种,具有抗急性胃溃疡的药理作用,但对于乙酸诱导的慢性胃溃疡的治疗效果及作用机制尚不明确。已有研究表明,黄花白及中的β-sitosterol和Stigmasterol等具有改善GU的潜力,β-谷甾醇对胃癌、乳腺癌和前列腺癌等具有潜在的抗癌特性[16],并且β-谷甾醇和谷甾醇-3-O-b-葡萄糖苷在大鼠乙醇、阿司匹林、组胺、幽门结扎和8 d葡萄糖饮食模型中具有胃保护活性[17]。Stigmasterol可通过抑制Akt/mTOR通路诱导胃癌细胞凋亡和保护性自噬[18]。这些研究提示,黄花白及治疗GU具有多成分、多层次的特点。
网络药理学的结果表明,黄花白及可能主要通过IL-6、TNF、IL-1β、EGF和MPO等靶点治疗GU,这些靶点与溃疡愈合修复和炎症反应关系密切。TNF-α是巨噬细胞在炎症过程中分泌的主要促炎因子,TNF-α过度释放会刺激促炎因子IL-1β和IL-6的释放,继而引发中性粒细胞的聚集,导致局部发生炎症反应。这些炎症反应会损害胃内的保护屏障,从而导致溃疡的形成和加剧[19]。IL-1β和IL-6的释放在GU中同样起着重要作用,它们能够促进炎症反应和白细胞浸润,促进胃黏膜的炎症反应和组织损伤,继而导致GU的形成和扩大[20-21]。EGF是一种内源性的保护物质,具有促进上皮细胞增殖、分化和迁移的作用。作为胃防御因子的重要成员之一,EGF的释放有助于修复和保护胃黏膜,从而维持其完整性[22]。MPO酶活性是中性粒细胞过度激活和氧化应激的生物标志物,能评估嗜中性粒细胞浸润到胃黏膜组织的积累程度。而黄花白及中β-谷甾醇等成分能对TNF-α和IL-6的表达具有较好的抑制作用。有研究表明,β-谷甾醇可以调节MAPK和NF-κB信号通路,降低TNF-α、COX-2和IL-6的表达[23],减少胃黏膜炎症反应的发生。豆甾醇和β-谷甾醇在急性炎症模型中能降低MPO的活性[24]。这些研究均表明黄花白及可能是通过调控IL-6、TNF、IL-1β、EGF和MPO等靶点发挥治疗GU的作用。
GO 富集分析结果显示,黄花白及可能通过 DNA触发转录的正向调节、细胞内类固醇激素受体信号通路和RNA聚合酶Ⅱ启动子转录的正向调节等发挥抗胃溃疡的作用,细胞内类固醇激素受体信号通路中的皮质醇、雌激素和睾酮等通过与其受体结合,激活特定的信号通路来发挥其生物学作用。例如,皮质醇可以通过与糖皮质激素受体结合来抑制炎症和促进胃黏膜修复,从而对胃溃疡具有一定的保护作用[25]。
KEGG富集结果表明,黄花白及可能是通过调节NF-κB、TNF、IL-17和MAPK等信号通路来发挥其治疗GU的作用。有研究表明,TNF信号通路与炎症的发生发展密切相关,TNF作为一种重要的炎症细胞因子,在协调炎症免疫反应中起着核心作用。当TNF与相应的受体TNFR1结合后引发一系列炎症反应的形成和加剧,如IKK介导的IκB蛋白降解和NF-κB的释放,以及MAPK家族成员的磷酸化激活,将进一步激活下游的NF-κB信号通路和MAPK信号通路[26-27]。IL-17 是由辅助性T细胞及先天性免疫细胞等分泌的重要促炎症细胞因子,其与受体结合后将激活下游的NF-κB信号通路、JAK-STAT信号通路和PI3K-Akt 信号通路等,参与炎症反应的发生发展[28-29]。而参与这些信号通路的传导与核心靶点IL-6、TNF、IL-1β、EGF等关系密切。分子对接结果表明,黄花白及主要活性成分(batatasin Ⅲ、daucosterol、β-sitosterol)与核心靶点(IL-6、TNF、IL-1β、NF-κB)具有良好的对接活性,证实了以上网络药理学预测结果的可靠性。因此,后续的动物实验对IL-6、TNF、IL-1β、EGF和MPO进行检测。
动物实验结果表明,大鼠给予乙酸灌胃给药后,模型组大鼠胃黏膜损伤严重,肉眼可见严重的黑色溃疡面。病理结果表明,模型组大鼠出现黏膜可见不同程度的溃疡形成,且溃疡灶面积较大,并有大量炎细胞浸润,给予黄花白及的大鼠无论是表观观察还是病理检查,溃疡形成均不明显。由此可见,黄花白及能改善乙酸诱导的慢性胃溃疡。ELISA检查结果表明,黄花白及能显着改善IL-6、TNF、IL-1β、EGF、MPO的含量和活性,减低炎症反应的进一步形成,这一研究与网络药理学的预测结果吻合。此次实验存在 U 型曲线的量效特点,提示黄花白及发挥抗胃溃疡的作用可能较为复杂,可能是由于多种成分呈现出抗胃溃疡作用,但在不同的给药剂量,各成分间可能存在增强与拮抗等不同的相互作用,从而表现为在不同剂量的药效不同,U 型量效的详尽机制还需后续实验数据验证。本研究设置的中药阳性药是白及多糖 0.5 g/kg[30],主要用于比较白及多糖与黄花白及治疗GU的药效作用的差异性,黄花白及的给药剂量是参照前期急性胃溃疡实验的剂量而定,通过比较白及多糖与黄花白及的差异性,可为下一步探讨黄花白及的多糖药效研究奠定基础。
综上所述,黄花白及对乙酸诱导GU的具有保护作用,其机制可能是通过抑制IL-17、NF-κB、TNF和MAPK等介导的炎症相关信号通路,并且可能是通过调控这些通路中的IL-6、TNF、IL-1β、EGF和MPO发挥治疗GU的作用。本研究结合了网络药理学、分子对接和动物实验验证的方法,为黄花白及治疗GU的临床应用提供了理论依据。



