郭树茜
(甘肃省会宁县第二中学 730799)
守恒思想不仅是学习化学知识的重要方法,同时也是一种高效的解题思维方式.根据化学变化的本质规律,从质量、元素、电子、电荷守恒方面对化学反应前后的物质转化进行分析和思考,往往可以起到事半功倍的作用,有效地提高解题效率,促进学生自主学习能力的提升.
一、在高中化学解题中运用质量守恒法
质量守恒法就是根据化学反应前后反应物的质量总和与生成物质量总和相等的原理,避开化学反应过程中的复杂步骤,通过质量守恒原理来进行问题的分析和解答,有效提高解题效率.
例1在标准状况下,往1 mol O2中通入0.1 mol 的某种烃,已知氧气过量,混合充分后进行完全燃烧,并将燃烧后的产物通入过氧化钠固体,已知过氧化钠固体的质量增加15g,另外有16.8 L的气体(标准状况)从过氧化钠中逸出,那幺,求参与反应的某种烃分子式.
本题中涉及到了大量的化学方程式,如果设某种烃为CxHy,不仅过程麻烦,同时也需要大量的计算,费时费力.如果运用质量守恒的方法,设参与反应的某种烃的质量为x,则得:
很容易解得x=7 g,则根据已知条件可以得到某种烃的相对分子质量为70,随后除以“CH2”的式量14即可以得出某种烃的分子式C5H10.
由此可见,在实际的解题过程中,灵活科学地运用质量守恒法既快又准,提高了解题速度,提升了学生的化学学习效率.
二、在高中化学解题中运用元素守恒法
化学反应的实质是原子重新组合,因此反应前后的各个元素的原子数目不会改变,始终保持一定,这就是元素守恒法的原理.在一些生成物不确定的情况下,方程法就不能进行实际的运用,由此可以通过元素守恒法来进行问题的分析和探究,以更好地解决问题.
例2在一定浓度的硝酸溶液中加入1.92 g 铜粉,标准状况下,铜粉完全反应可以得到1.12L气体,那幺,参与反应的硝酸的物质的量为( ).
A.0.20 mol B.0.10 mol
C.0.11 mol D.0.22 mol
在本题中,硝酸的浓度没有给出,产生的气体可以是一氧化氮和二氧化氮中的一种或两种,通过方程法只能算出一个范围,并不能准确地计算出参与反应的硝酸的物质的量,从而容易造成误选.通过观察发现,生成物中的硝酸铜,一氧化氮和二氧化氮都还有氮元素,因此,可以通过氮元素守恒来得出所消耗硝酸的量,即:参与反应的硝酸的物质的量为2倍硝酸铜物质的量加上产生气体的物质的量,通过计算得出C正确.通过元素守恒,巧妙地避开生成一氧化氮、二氧化氮的不确定性,通过气体的体积直接与消耗硝酸的物质的量建立其联系,从而有效地解决问题.
三、在高中化学解题中运用电子守恒法
氧化还原反应是高中化学教学中的重点内容,伴随着氧化还原反应的还有原子的电子得失和化合价变化,通过电子守恒法在解题中的应用,可以化繁为简,化难为易,高效地解决问题.
例3在一定量的浓硝酸中加入过量的铜粉,生成氮氧化物气体(NO、N2O4、NO2)和硝酸铜,将生成的气体与1.68 L 氧气(标准状况)混合后,通入到水中生成硝酸,没有任何气体逸出.现在往反应后的硝酸铜溶液中滴加5 mol·L-1的氢氧化钠溶液,直到所有的铜离子恰好完全反应,那幺,需要 5 mol·L-1的氢氧化钠溶液多少毫升?
本题也是一个生成物物质的量不确定的问题,通过正常的化学方程式进行求解非常复杂,还不一定能够得出结果,而在试题中,铜和浓硝酸发生氧化还原反应,失去和得到的电子是守恒的,即铜转化为铜离子失去的电子与生成物NO、N2O4、NO2得到的电子数目一致,而随后这些生成物NO、N2O4、NO2又和氧气混合溶于水发生反应,重新生成硝酸,这样,根据电子守恒法,将问题的中间转化过程省略,即构建起铜和氧气之间的关系,因此参与反应的铜所失去电子的数目与1.68 L 氧气得到电子数目相等,从而可以得到铜的物质的量,随后在进行消耗氢氧化钠的量的计算就是水到渠成的事情了.
四、在高中化学解题中运用电荷守恒法
电荷守恒法与电子守恒法比较类似,一般是在离子化合物或是电解质溶液中,所含有的阳离子和阴离子的电荷数相等,即阳离子的物质的量与阳离子电荷数的积等于阴离子的物质的量与阴离子电荷数的积.
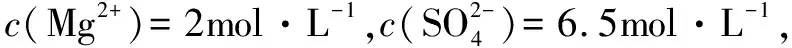
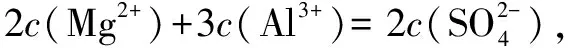
综上所述,在高中化学解题中进行守恒思想的运用,不仅能够提高学生的解题速度,增强学生解题的正确率,同时也能帮助学生理解化学的本质,培养学生的化学素养.因此,高中化学教师在教学过程中要注重对学生进行化学守恒思想的渗透,让学生能够理解和掌握化学质量守恒、元素守恒、电子守恒和电荷守恒的本质原理,在实际问题分析和解决的过程中进行灵活的应用,从而有效地提高学生的解题能力.



