李宗来 李小娟
(江苏省响水中学 224600)
纵观近几年的江苏高考化学试题,都出现了用文字正确表述实验设计的相关试题,设问围绕物质的制备、检验、分离与提纯、含量测定、实验的评价与改进等,实验设计表述题要求高、难度大、对知识的运用提出了更高的要求,具有很好的区分度,它主要考查学生对所学知识理解的准确性、思维的完整性、推理的严密性和表述的条理性等综合能力.但由于中学阶段实验操作、探究能力的缺失,及答题上表述不规范而丢分,是学生感觉最为棘手的题型之一,本文例析这类试题的考向和解题要领,以期能抛砖引玉.
一、表述物质制备的实验设计
1.提供补充信息与备选试剂的物质制备
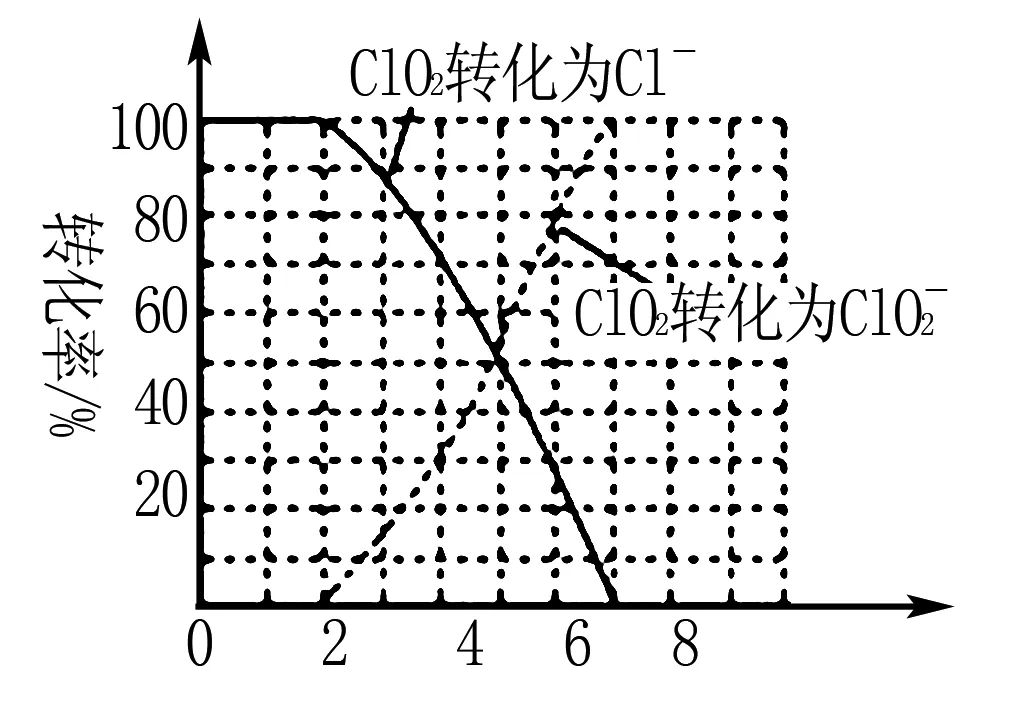
例1(2017江苏卷)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略).
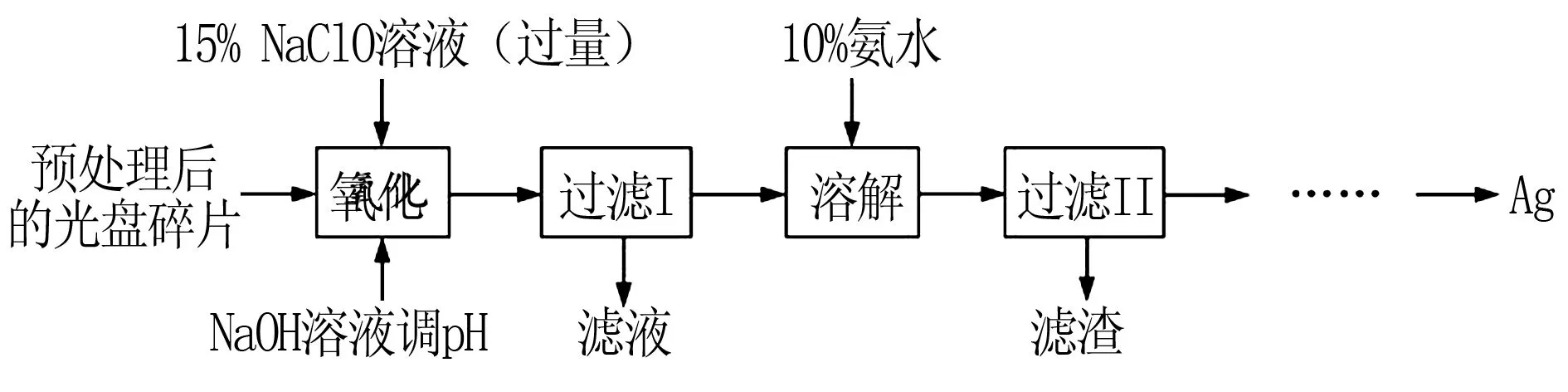
已知:①NaClO溶液在受热或酸性条件下易分解,如:
②AgCl可溶于氨水:
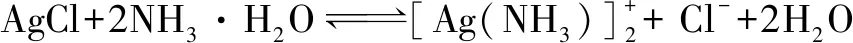

请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:____(实验中需使用的试剂有:2 mol·L-1水合肼溶液,1 mol·L-1H2SO4).
解析根据题干信息和实验中需使用的试剂可得获取Ag的实验方案为:向滤液中滴加2mol·L-1水合肼溶液,搅拌使其充分反应,同时用1 mol·L-1H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥.
2.信息隐藏于图像图表的物质制备

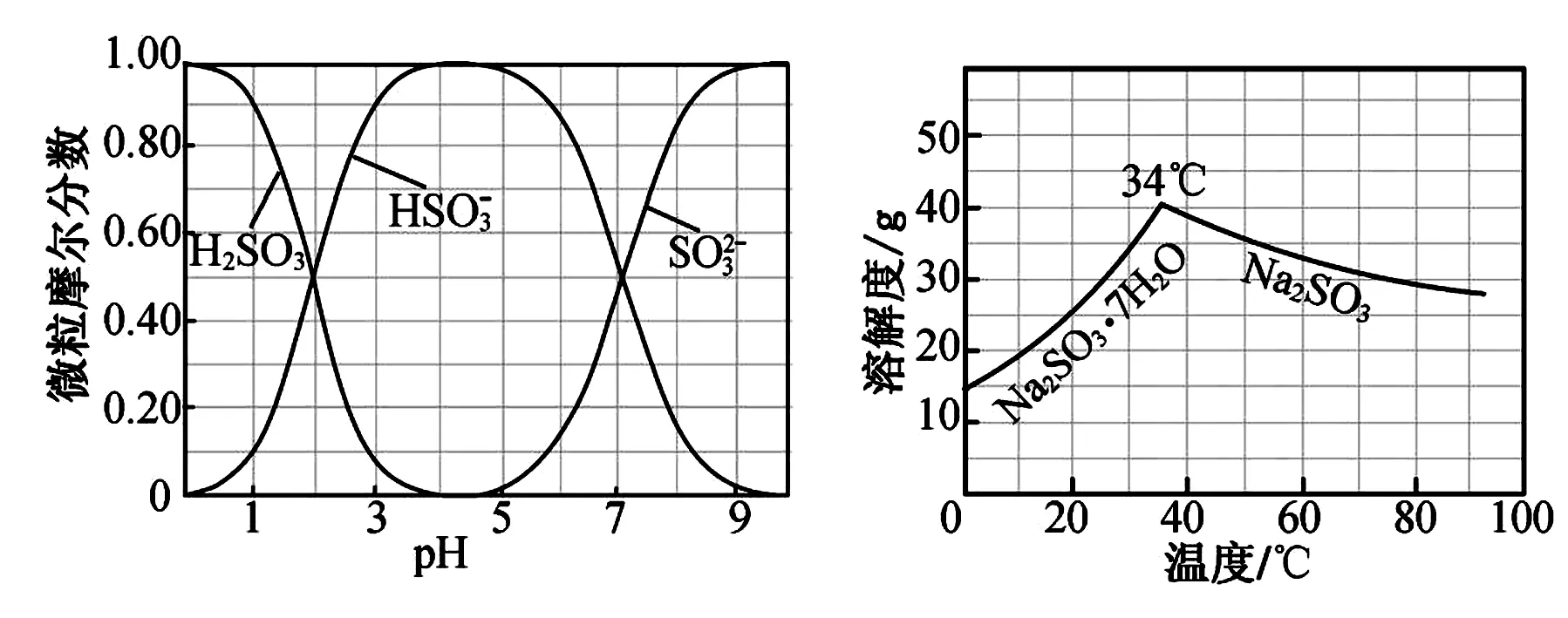
图1 图2
(1)边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液.实验中确定何时停止通SO2的实验操作为____.
(2)请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:____,用少量无水乙醇洗涤,干燥,密封包装.
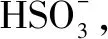
(2)结合图1、图2信息可得:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时(NaHSO3完全转化为Na2SO3),停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤(防止以Na2SO3·7H2O晶体形式析出).
解题指导侧重于物质制备的实验表述是江苏卷近三年都考查的知识点,同时兼顾杂质的分离产物的净化提纯,信息的呈现也在不断地变化,有补充的提示信息、图像图表等,解题时要分清起点物质、目标产物是什幺,建立起点与目标的关系,充分解读隐藏于图像图表的信息,并加以利用,特别是集温度、物质变化及溶解度的曲线图,选择最佳的制备条件,并在表述时要具体明确的表述出来;对于实验中提供的试剂(注意备选与必须使用的区别),大胆推测各自的作用,结合前后的实验步骤,运用实验知识与技能,一般流程是:控制特定的条件下的物质制备、除杂净化、过滤、洗涤、干燥等,将提供的试剂穿插到需要补充表述的制备步骤中去,平时要总结趁热过滤的几种情况如:防止低温时会生成结晶水合物或者低温时杂质会析出等.
二、表述指定物质检验的实验设计
例3 (2014江苏卷)已知:
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种.请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;____.实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液.
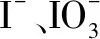
解题指导提供备选试剂的物质检验,首先结合物质的性质特点、根据可供选择的试剂设计特征现象明显的实验,特别要研读并运用题干中提供的信息结合已有的知识和实验技能,在头脑中构建一个大致的框架,大胆推测,如上题中供选的淀粉溶液可推测是用来检验I2的,FeCl3可推测是用来氧化I-使之变为I2的,这样I-检验的大致思路就呈现出来了.另外实验操作过程要“精雕细琢”,完善实验的细节,本着节约、简洁原则,试剂的用量尽量少,一般为1~2 mL;如果做一组实验时可以一次取液分成若干等份,对比实验要注意控制条件变量,分别进行判断.
三、表述物质净化除杂的实验设计
1.利用溶解性差异净化除杂
例4(2015江苏卷)已知K2FeO4具有下列性质:①可溶于水、微溶于浓KOH溶液,②在0~5℃、强碱性溶液中比较稳定,提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,____(实验中须使用的试剂有:饱和KOH溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱).
解析准确解读题干中K2FeO4性质,推测实验中需用的试剂、仪器目的,如饱和KOH溶液:降低K2FeO4溶解,便于析出晶体;乙醇:洗涤晶体,因K2FeO4可溶于水;砂芯漏斗过滤难溶杂质Fe(OH)3及K2FeO4晶体的.因此实验方案为:用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥.
解题指导提供试剂、仪器,物质净化除杂的实验设计,首先要解读题干信息,把握产品及杂质的性质差异,特别要关注其溶解性在不同物质中的变化以及随温度的变化曲线,原则是最大限度除去杂质和制得需要的目标物质,制得晶体的途径一般有两种:蒸发结晶,当有大量晶体析出时,并停止加热,让余热将剩下的溶液蒸干,冷却(降温)结晶、或者在特定溶液中溶解度小而结晶析出,产生晶种和晶膜利于晶体的析出,溶液中晶体的提取,要过滤、洗涤、干燥才能得到纯洁的晶体,同时要注意影响稳定性的外界条件,用乙醇等有机溶剂来洗涤晶体一般出于降低晶体溶解度,防止溶解消耗或有机溶剂易挥发,容易低温干燥,防止产品高温分解.真空干燥箱是为干燥遇热不稳定热敏性物质、易分解和易氧化物质及较复杂成分物品而设计的.
2.利用调节pH净化除杂
例5 (2012江苏卷)已知pH>11时,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 mol·L-1计算).
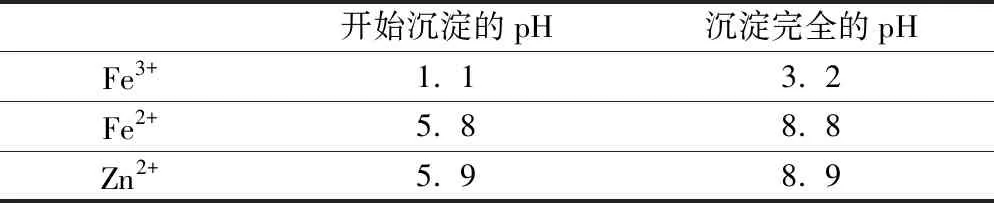
开始沉淀的pH沉淀完全的pHFe3+1. 13. 2Fe2+5. 88. 8Zn2+5. 98. 9
实验中可选用的试剂:30% H2O2、1. 0 mol·L-1HNO3、1. 0 mol·L-1NaOH.由除去铜的滤液(含Fe2+、Fe3+、Zn2+)制备ZnO 的实验步骤依次为:①____;②____;③过滤;④____;⑤过滤、洗涤、干燥;⑥900℃煅烧.
解析实验的目的是从含Fe2+、Fe3+、Zn2+的滤液中制备ZnO,通过表格可得Fe2+、Zn2+开始沉淀和沉淀完全的pH很相近,因此首先将Fe2+氧化成Fe3+再调节pH,除去Fe3+,但不能将Zn2+去除,根据已知信息pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,调节pH时要注意数值的范围,因此①向滤液中加入适量30% H2O2,将Fe2+氧化成Fe3+;②滴加1.0 mol·L-1NaOH,调节溶液pH 约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;④向滤液中滴加1. 0 mol·L-1NaOH,调节溶液pH 约为10(或8. 9≤pH≤11),使Zn2+沉淀完全.
变式练习(2016江苏卷)实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O.实验过程如下:
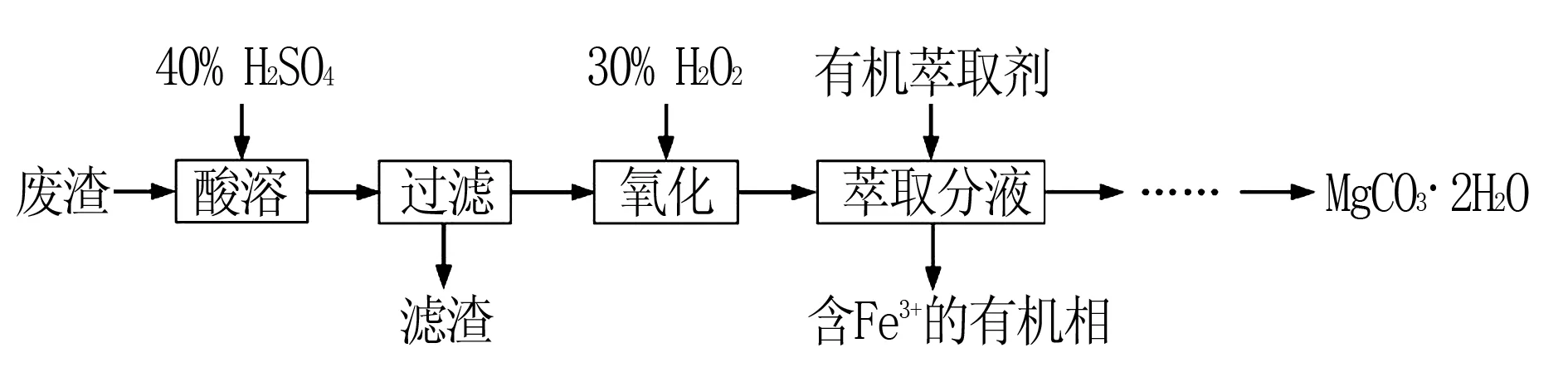
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,____,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O.[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全].
答案:(4)至5.0 解题指导调节pH净化除杂的依据是加入不会引入新杂质(或便于除去)的物质调节溶液的酸碱性,使杂质离子产生沉淀而除去,一般是含目标物质的金属氧化物或者是碳酸盐,根据提供试剂、仪器,物质净化除杂的实验设计,首先要解读题干中图像图表的信息,要注意各金属离子开始沉淀、沉淀完全的pH,在表述时要准确标出控制pH的范围(大于等于杂质离子完全沉淀的pH,要小于目标金属离开始沉淀的值),目的是使杂质离子沉淀而除去,目标金属离子不沉淀,对于与目标金属离子沉淀的pH相接近的杂质离子,要先通过氧化还原反应进行转化,拉大产生沉淀pH间的差距,如例题中Fe2+氧化成Fe3+,这样便于除杂操作,同时调节pH可达到控制产生沉淀的先后顺序,实现逐一分步除杂或提取. 3.利用提供的试剂净化除杂 例6 (2013江苏卷)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.请结合右图的绿 (注:Al3+开始沉淀的pH=3.0,沉淀完全的pH=5.0) 解析过滤(除去不反应的SiO2),向反应液中加入足量的铁粉(将Fe3+还原为Fe2+),充分搅拌后,滴加NaOH溶液调节反应液的pH约为5(除去Al3+),过滤.或过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤.滴加稀硫酸酸化(防止Fe2+受热水解)加热浓缩得到60℃(溶解度最高).冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥 解题指导利用不同物质间化学性质的差异,充分利用提供的试剂,结合溶解性、稳定性等随温度等外在条件的变化,逐步将杂质去除并最终制备纯净的目标物质,首先要思路清晰,实验操作表述条理清楚、注意化学用语的规范使用和条件等“核心关键词”准确表达,对于多种杂质,先除什幺后除什幺,注意过量、足量、适量的不同表述,目的是将杂质完全去除,同时要注意过量试剂的影响;其次要利用题干中有关制备目标产品的性质,同时要考虑降低其溶解度、防止水解等外界条件的影响,将其从溶液中提取出来,从溶液中得到晶体一般的顺序是:加热浓缩→蒸发结晶(或冷却结晶)→过滤、洗涤、干燥等.注意减压过滤可加快过滤速度外,还可得到较为干燥的沉淀. 例7(2015江苏卷)当清液pH接近6.5时,过滤并洗涤CaCO3固体(附着(NH4)2SO4.检验洗涤是否完全的方法是____. 例8 (2009江苏卷)以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙,先用盐酸溶解,除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的实验操作是____. 解析如果Fe(OH)3沉淀完全则溶液中应该Fe3+含有极少(<1×10-5mol/L),故检验时应从是否含有Fe3+着手,因此检验Fe(OH)3是否沉淀完全的实验操作是:取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全. 变式练习1.(2013江苏卷)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备: 生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____. 答案取最后一次的洗涤滤液1~2 mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净. 检验沉淀是否完全时,首先应弄清产生沉淀的离子有哪些,如果沉淀完全则这些离子含量极少(不再产生沉淀等特征现象),表述时依然围绕着:取样→滴加试剂→描述现象→得出结论,同时要强调取少量上层清液,做性质验证实验时试剂一般取用1~2 mL,滴加几滴检验试剂,结论从是否产生沉淀两方面予以阐述. 例9 (2009年江苏卷,节选)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子的含量应不超过0.2 mg·L-1. ①请完成相应的实验步骤: 步骤1:准确量取VmL水样加入到锥形瓶中. 步骤2:调节水样的pH为7.0~8.0. 步骤3:加入足量的KI晶体. 步骤4:加少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL. 步骤5:____. 步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL. 解题指导对于物质含量测定的实验设计,设问角度有:补全实验步骤、误差分析、实验设计的优劣评价、改进等,解题时首先联系上下提供的实验步骤,要读懂每个步骤的目的,掌握其中的原理,理顺之间的关系,要测定待测物的含量,补全的步骤应该结合题干信息从已知了哪些量还要测定哪些量等着手考虑,为达到测量数值的准确性,往往要对实验数据进行纠正,如对标准溶液浓度的重新标定、做空白对比实验、相同条件下的重复实验2~3次,取平均值,但对于可能的实验错误操作,测定数值相差较大的数据要舍弃.四、表述洗涤沉淀及沉淀是否完全的实验设计


五、 表述物质含量测定的实验设计