穆玉鹏
(山东省博兴第一中学 256500)
一、电子守恒法的一般计算

例1Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为____.
解析

答案:5
二、电子守恒法在多步氧化还原反应中的应用
多步连续进行的氧化还原反应,只要中间各反应过程中电子没有损耗,可直接找出起始物和最终产物,删去中间产物,建立二者之间的电子守恒关系,快速求解.如:

A.N2B.N2O C.NO D.NO2
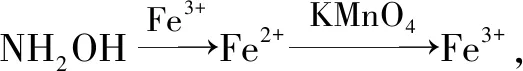
对点训练

B.反应过程中溶液的pH减小
C.生成2 mol NaNO3需消耗0.8 mol KMnO4
D.氧化产物与还原产物物质的量之比为2∶5

2.(1)联氨(N2H4)是一种常用的还原剂.其氧化产物一般为N2.联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1 kg的联氨可除去水中溶解的O2____kg.
(2)(2015·全国卷Ⅱ)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为____.
(3)(2014·全国卷Ⅰ)H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中Ag+还原为银,从而可用于化学镀银.
①H3PO2中,P元素的化合价为____.
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为____(填化学式).
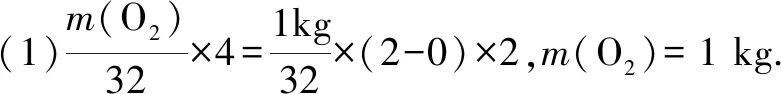
(3)②4×(1-0)=1×(n-1),n=5,故氧化产物为H3PO4.
答案:(1)1 (2)2∶1 (3)①+1价 ②H3PO4



