张 晨,霍 倩,李翠珍,周志俊,吴 庆
甲状腺癌是一种最常见的内分泌系统肿瘤,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最普遍的甲状腺肿瘤组织类型,占甲状腺癌的59.9%~89.0%,其病因机制复杂,发病率高[1]。促甲状腺激素受体(thyroid stimulating hormone receptor,TSHR)基因的表达在甲状腺癌中起着重要的作用[2]。促甲状腺激素(thyroid stimulating hormone,TSH)通过与TSHR结合发挥作用,激活2条主要的信号转导途径:腺苷酸环化酶-蛋白激酶途径和磷脂酶c-蛋白激酶c通路。甲状腺细胞表面表达的TSHR与TSH结合,可以上调钠/碘协同转运体(Na+/I-symporter,NIS)的表达[3],发挥对碘代谢功能的调节作用。如果甲状腺中TSHR表达缺失或功能异常,就会造成甲状腺摄取、浓缩和利用碘的功能异常[4-5]。而TSHR基因的高甲基化会影响其基因的表达,并在甲状腺乳头状肿瘤的形成与预后中起重要作用[6]。目前对于表观遗传在甲状腺肿瘤中的作用研究较少,本研究利用Meta分析方法研究TSHR基因的甲基化与甲状腺乳头状癌之间的关系,为预防和诊治甲状腺乳头状癌提供参考。
1 资料与方法
1.1 文献检索策略 本研究以检索词(DNA OR TSHR OR thyroid stimulating hormone receptor)AND (thyroid OR papillary thyroid) AND (carcinoma OR cancer OR neoplasm OR tumor) AND (methylation OR epigenetic)计算机检索Medline、Web of science、Cochrane Central、Ovid英文数据库,检索范围为2000年1月—2013年4月。同时以“甲状腺乳头状癌”或“甲状腺乳头状肿瘤”和“TSHR”为检索词计算机检索中国学术期刊全文数据库、万方、维普数据库,检索范围为2000年1月—2013年4月。同时辅以文献追溯和手工检索等,收集各种杂志公开发表的学术论文、学位论文和会议摘要等。
1.2 文献纳入与排除标准 两名独立检索人员根据以下标准筛选和纳入文献:(1)文献研究方法均为流行病学研究,并分析TSHR基因甲基化与甲状腺乳头状癌的关系。(2)TSHR基因甲基化的检测方法为甲基化特异性聚合酶链反应(methylation specific PCR,MSP)、实时荧光定量甲基化特异性聚合酶链反应(real-time fluorescent quantitative methylation specific PCR,QMSP)或联合亚硫酸氢钠限制性内切酶分析法(combined bisulfite restriction analysis,COBRA)。(3)所有纳入文献均有全文可供数据提取。(4)在每个研究中均有病例与对照。(5)如果是相同的病例人群在不同杂志发表,只纳入其中最新或最完整的报道,避免提取重复数据。(6)每个研究的病例与对照人数均不少于3人。以下类型的研究被排除在外:动物实验,案例报告,回顾荟萃分析,重复论文,综述以及数据不足。相应的文献被进一步检索来确认是否符合纳入标准,检索不一致的地方通过两位检索人员讨论并解决。
1.3 数据收集与质量评价方法 检索收集信息包括第一作者的名称,出版的时间,研究的样本来源、大小,甲状腺乳头状癌和正常或对照组织中的TSHR基因甲基化水平,年龄分布,肿瘤分级,以及是否存在淋巴结转移。对于对照选择有三种定义:(1)正常的健康人群;(2)患有甲状腺疾病但未患有甲状腺恶性肿瘤的患者;(3)甲状腺乳头状癌患者的癌旁组织。根据纽卡斯卡-渥太华质量评价量表(Newcastle-Ottawa scale,NOS)评价纳入研究的偏倚风险,选择其中病例-对照研究量表,评价内容包括研究对象选择、可比性和暴露3个方面,共9分。同时基于Meta分析的结果,应用推荐分级的评价、制定与评估(grades of recommendations assessment,development and evaluation,GRADE)系统推荐分级方法[7]和GRADE profiler (version 3.6)软件评价纳入文献的总体质量及推荐等级,分级为:(1)高质量:我们非常确信真实的效应值接近效应估计值;(2)中等质量:我们对效应估计值有中等程度的信心:真实值有可能接近估计值,但仍存在二者大不相同的可能性;(3)低质量:我们对效应估计值的确信程度有限:真实值可能与估计值大不相符;(4)极低质量:我们对效应估计值几乎没有信心:真实值很可能与估计值大不相同。
1.4 统计学方法 采用STATA软件(Stata/SE 11.0 for Windows,StataCorp LP)用于统计分析。使用异质性检验,如果其研究间I2>50%,以及χ2检验(P≤0.05)都认为纳入的研究存在异质性,运用 DerSimonian-Laird 随机效应模型[8]进行数据合并;反之则认为不存在异质性,运用Mantel-Haenszel固定效应模型[8]进行数据合并,关联强度用合并OR值和95%CI表示,并计算不同研究间变异。τ2值表示有多大的异质性是可以被亚组之间的差异所解释[9]。Meta回归分析用于解释异质性的来源。病例组和对照组中TSHR基因甲基化水平的OR通过分成不同亚组进行分析,包括人群来源(中国和国外)、对照类型(自体组织和其他人群组织)、年龄分层(<45岁和≥45岁)、肿瘤TNM分期(早期和中晚期)以及是否有淋巴结转移。敏感度分析用于评价每个研究在最终结果中的贡献度,漏斗图以及Egger检验分析其发表偏倚。
2 结果
2.1 文献检索结果 使用文献检索词,共检索到214篇相关文献,进一步通过纳入标准进行筛选,总共13篇文献被挑选出来,通过阅读分析全文,5篇文献予以排除(见图1)。剩余8篇文章[2,4,5,10-14]被合并分析TSHR基因甲基化与甲状腺乳头状癌的风险关系(见表1),得到的总样本量为583份,其中甲状腺癌组织样本为342份,对照组样本为241份;来自中国的研究为4篇,美国2篇,伊朗1篇,德国1篇;甲基化检测方法主要有MSP、QMSP和COBRA。在随机效应模型中,甲状腺乳头状癌样本中TSHR基因发生甲基化数与对照组相比的合并OR值为4.57〔95%CI(1.68,12.43),z=2.98,P<0.01,见图2〕。本研究GRADE系统评价推荐分级为中等质量,推荐强度为中级。
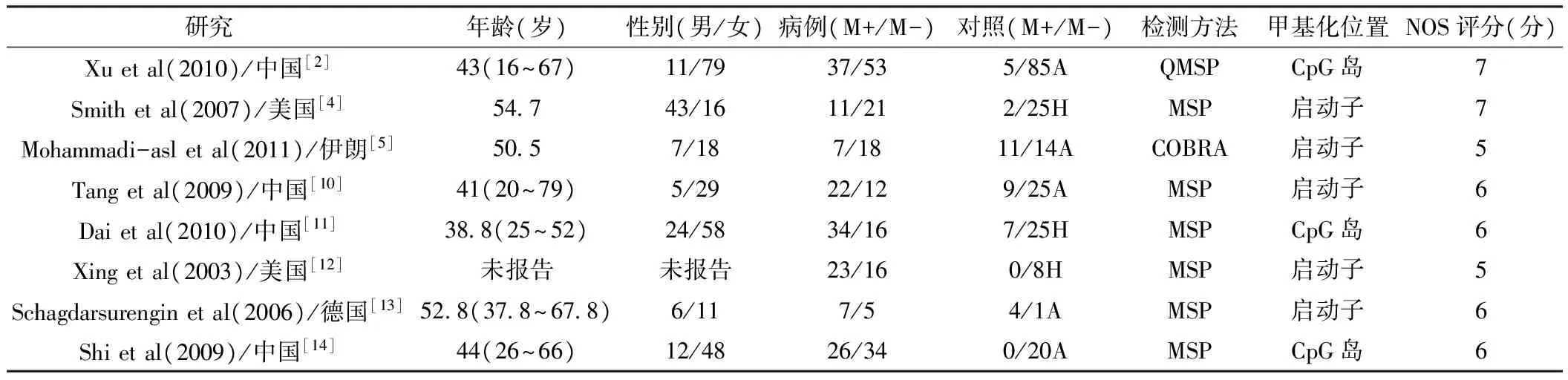
表1 研究的基本情况
注:M+:样本中甲基化数量,M-:样本中未甲基化数量;A:同源对照(autologous control),对照样本来源患者自体癌旁组织;H:异质对照(heterogeneous control),对照样本来源其他人群正常组织;MSP:甲基化特异性聚合酶链反应;QMSP:实时荧光定量甲基化特异性聚合酶链反应;COBRA:联合亚硫酸氢钠限制性内切酶分析法;NOS:纽卡斯卡-渥太华质量评价量表(Newcastle-Ottawa scale)
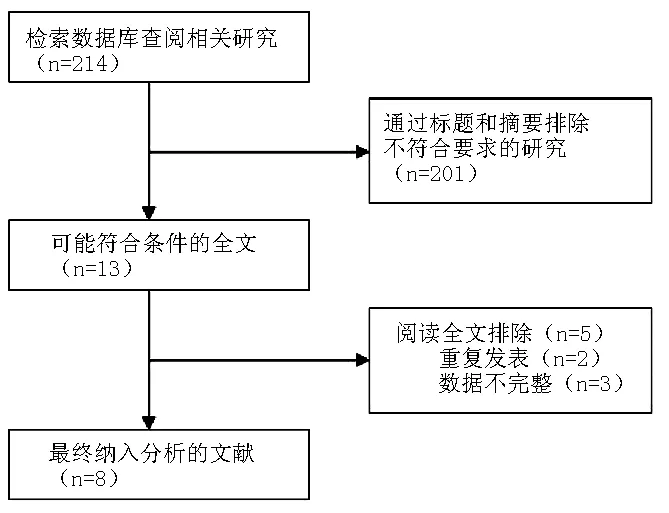
图1 文献纳入流程图
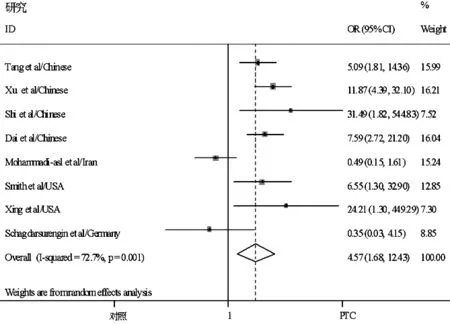
图2 纳入研究的森林图
2.2 分层分析和Meta回归 表2展示了用不同分层进行Meta分析的结果。在不同对照类型的分层分析中,对照为其他人群组织〔OR=8.51,95%CI(3.72,19.46)〕的甲状腺乳头状癌样本中TSHR基因甲基化发生的风险明显高于自体对照样本〔OR=3.09,95%CI(0.67,14.27)〕。通过人群来源分层时,中国人群〔OR=9.18,95%CI(5.19,16.23)〕甲状腺乳头状癌中甲基化发生的风险明显高于国外〔OR=1.99,95%CI(0.30,13.16)〕。在年龄分层分析中发现,年龄<45岁的人群〔OR=9.18,95%CI(5.19,16.23)〕相比年龄≥45岁的人群〔OR=1.11,95%CI(0.17,7.20)〕,其TSHR基因甲基化发生风险较高。在TNM不同分期时对甲基化发生风险进行评价,TNM Ⅰ~Ⅱ期为甲状腺乳头状癌早期阶段,Ⅲ~Ⅳ期为中晚期阶段,TSHR基因甲基化发生风险在中晚期阶段〔OR=14.12,95%CI(2.93,68.18)〕明显高于早期〔OR=6.01,95%CI(3.21,11.28)〕。对是否有淋巴结转移进行分析,有淋巴结转移的甲状腺乳头状癌样本〔OR=14.29,95%CI(2.47,82.75)〕甲基化发生风险也明显高于未观察到淋巴结转移的样本〔OR=5.85,95%CI(3.15,10.85)〕。
由于本研究存在异质性(I2=72.7%,χ2=25.65,P<0.01),因此进行Meta回归分析(Knapp-Hartung修正),研究间的残差用τ2来表示,使用限制性最大似然比法来估计研究间的变异程度。Meta回归分析的结果表明,样本量的差异与异质性呈负相关(Coefficient=0.04,P<0.05,AdjustedR2=66.78%,见表3),而其他因素诸如:男性比例、年龄、出版年份、对照类型、人群来源均与研究的异质性无关。
2.3 敏感性分析与发表偏倚 敏感性分析表明有一项研究[5]可能是异质性的主要来源(见表4),当把这项研究移除后,在甲状腺乳头状癌人群中TSHR基因甲基化的发生风险与对照相比异质性明显降低(χ2=8.91,P=0.179,I2=32.7%)。除此之外,并没有其他单项研究能够影响合并后的OR值。通过绘制漏斗图,研究大致呈对称漏斗分布(见图3),同时Egger检验(t=-0.01,P>0.05)也表明此次纳入对象不存在发表偏倚,纳入的文章质量良好。
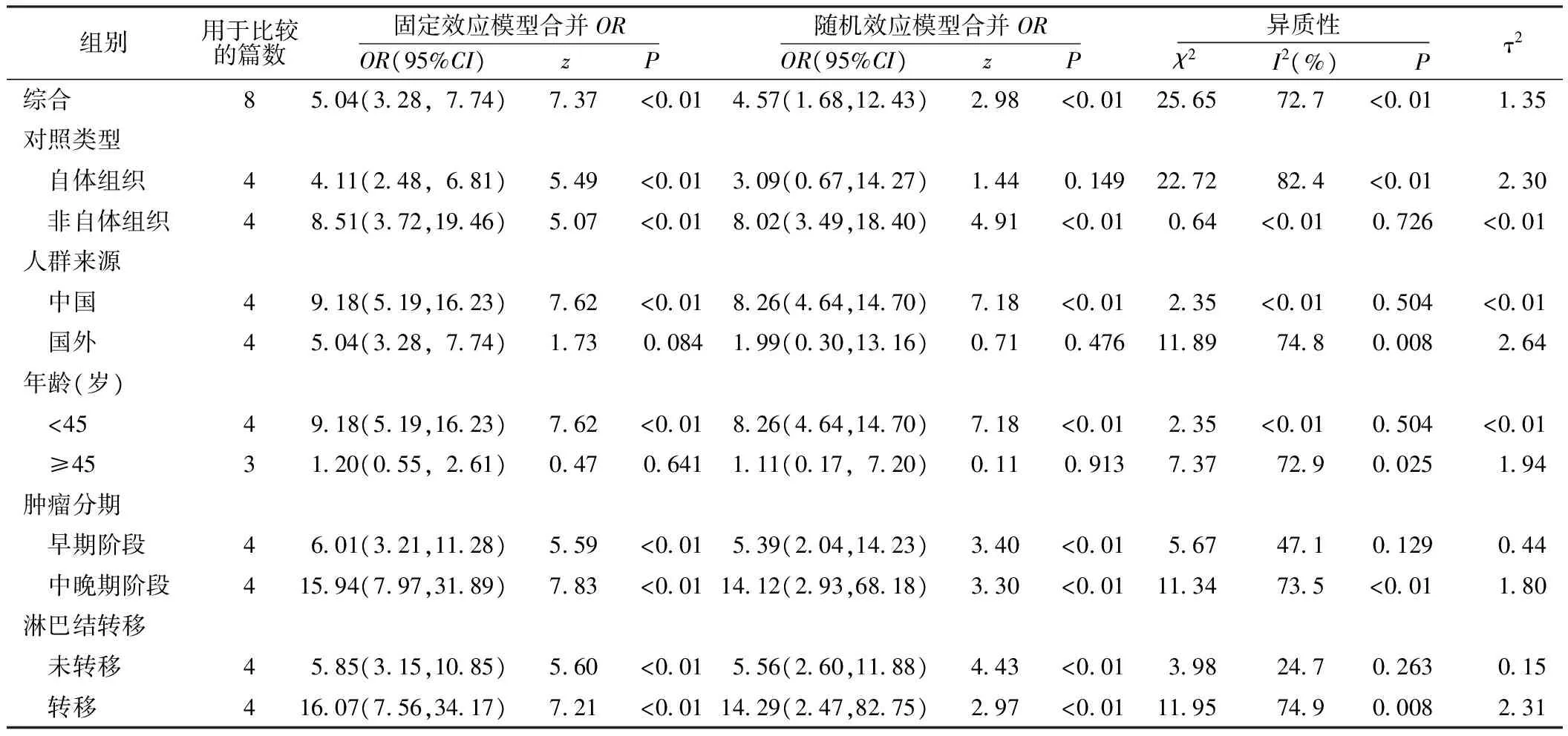
表2 促甲状腺激素受体基因甲基化与甲状腺乳头状癌发生风险的分层分析
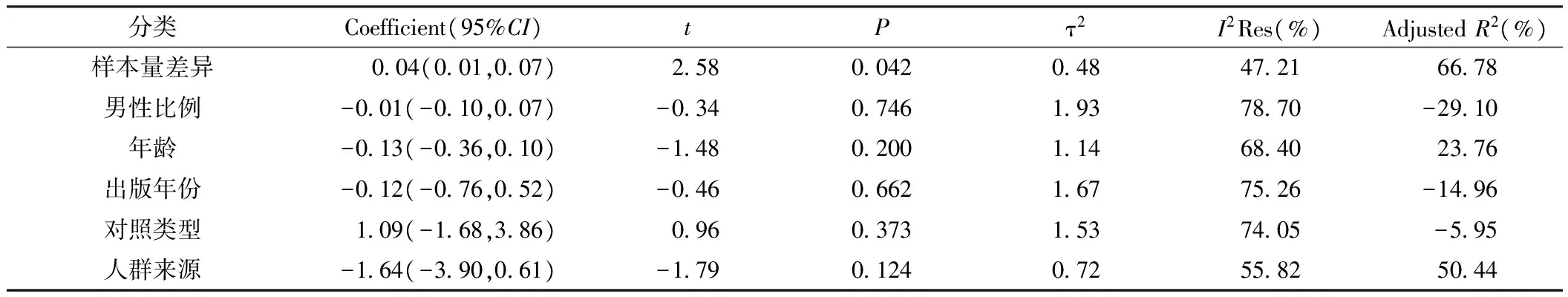
表3 Meta回归分析
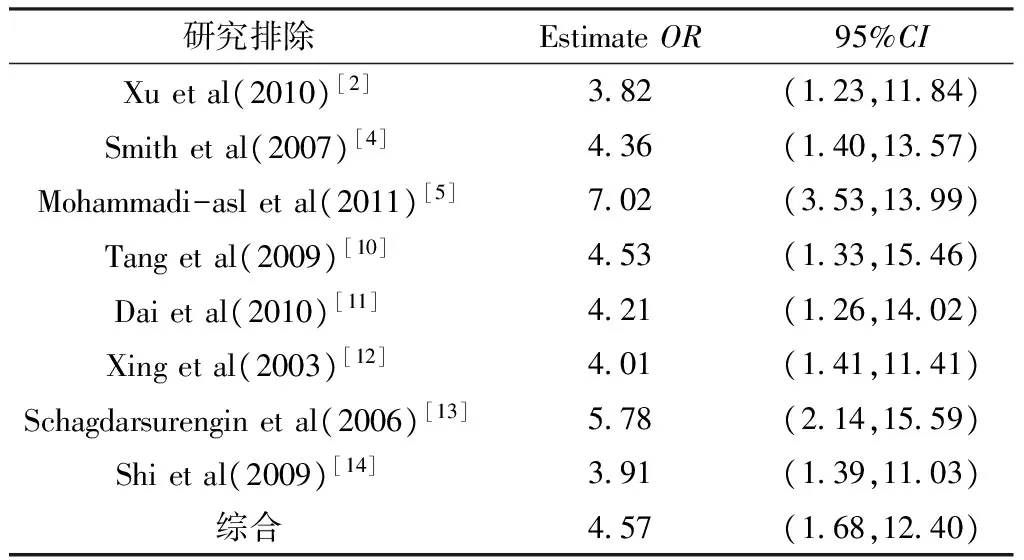
表4 异质性分析
3 讨论
甲状腺癌是内分泌系统最常见的恶性肿瘤,甲状腺乳头状癌最为常见,其发病率较高,其发生、发展是包括癌基因的激活和抑癌基因失活等多因素、多步骤的复杂过程,目前普遍认为DNA的甲基化是导致抑癌基因失活的重要机制[15-16]。TSHR是甲状腺细胞的一种特异性蛋白质,主要分布于甲状腺滤泡上皮细胞膜上,其主要功能是与TSH结合,通过刺激甲状腺聚集碘全面调节甲状腺功能。然而,对于TSHR基因的甲基化在人甲状腺乳头状癌中的作用目前尚未统一[6,17],TSHR表达异常以及其甲基化发生率的提高与许多甲状腺癌发病风险之间的联系仍在探索中[3,18]。因此本研究通过Meta分析对TSHR基因的甲基化与人甲状腺乳头状癌的发生风险进行系统综合的评价。
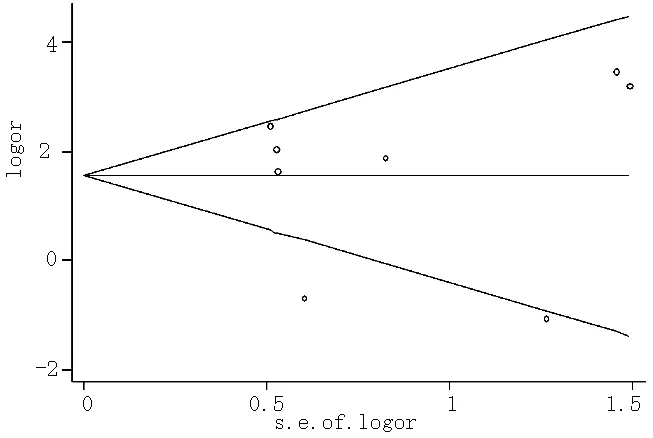
图3 发表偏倚的漏斗图
为了进一步验证TSHR基因甲基化状态与人甲状腺乳头状癌发生之间的风险,本研究综合了342份病例以及241份对照进行Meta分析,结果表明甲状腺乳头状癌样本中TSHR基因的甲基化明显高于对照组,是可能的危险因素。分层分析中,TSHR基因的甲基化在中国人群中以及年龄<45岁的人群中也是潜在的甲状腺乳头状癌危险信号,其甲基化发生频率是对照组的9.18倍,并且在Meta回归中,年龄的回归系数为-0.13,呈现负相关。以往研究也表明,甲状腺癌发病高危人群为青壮年,平均年龄为40岁,之后发病率有所下降[19-20],但在中老年人群中甲状腺癌的预后很差[21-22]。这与本研究结果较符,因此TSHR基因甲基化也许能够作为一个独立的分子标志物对中国特定年龄人群的甲状腺乳头状癌进行筛查。
TSHR基因的甲基化发生率与人甲状腺乳头状癌的TNM临床分期,以及是否存在淋巴结转移都有密切联系[2,10],但其研究结果却存在争议[14,23]。通过Meta分析表明,TSHR基因甲基化的发生在甲状腺乳头状癌早期已经存在,并贯穿于整个甲状腺乳头状癌的进展过程中。在甲状腺乳头状癌的中晚期以及淋巴结转移的人群中,其TSHR基因甲基化风险明显增加,与其早期阶段比较差异有统计学意义。本研究表明TSHR基因甲基化不仅在甲状腺乳头状癌早期诊断中具有重要意义,而且对甲状腺乳头状癌中晚期不良预后以及淋巴结转移有指示作用。
还需要指出的是,本次研究仍然存在着一些局限性,首先研究所纳入的8篇中英文文献均为病例对照研究,并且样本量较小,这与甲基化水平检测的技术要求以及研究费用较高有关。其次一些影响因素,如生活方式、性别、遗传因素并未纳入研究中予以分析,这为以后研究提供了方向。
1 Sherman SI.Thyroid carcinoma[J].Lancet,2003,361(9356):501-511.
2 许敬,葛明华,凌志强,等.甲状腺乳头状癌中TSHR基因启动子区5′-CpG岛甲基化研究[J].肿瘤,2010,30(8):696-699.
3 Garcia-Jimenez C,Santisteban P.TSH signalling and cancer[J].Arq Bras Endocrinol Metabol,2007,51(5):654-671.
4 Smith JA,Fan CY,Zou C,et al.Methylation status of genes in papillary thyroid carcinoma[J].Arch Otolaryngol Head Neck Surg,2007,133(10):1006-1011.
5 Mohammadi-asl J,Larijani B,Khorgami Z,et al.Qualitative and quantitative promoter hypermethylation patterns of the P16,TSHR,RASSF1A and RARbeta2 genes in papillary thyroid carcinoma[J].Med Oncol,2011,28(4):1123-1128.
6 Eze OP,Starker LF,Carling T.The role of epigenetic alterations in papillary thyroid carcinogenesis[J].J Thyroid Res,2011,2011:895470.
7 Guyatt GH,Oxman AD,Vist GE,et al.GRADE:An emerging consensus on rating quality of evidence and strength of recommendations[J].BMJ,2008,336(7650):924-926.
8 DerSimonian R,Laird N.Meta-analysis in clinical trials[J].Control Clin Trials,1986,7(3):177-188.
9 The Cochrane Collaboration.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0[EB/OL].http://www.cochrane-handbook.org.
10 唐建东,栗夏莲.甲状腺乳头状癌组织中TSHR基因启动子甲基化研究[J].中华现代内科学杂志,2009,6(5):321-325.
11 Dai YL,Cai DH,Chen H,et al.Transcription and promoter hypermethylation of thyroid stimulating hormone receptor gene in human papillary thyroid carcinoma[J].Nan Fang Yi Ke Da Xue Xue Bao,2010,30(1):114-117.
12 Xing M,Usadel H,Cohen Y,et al.Methylation of the thyroid-stimulating hormone receptor gene in epithelial thyroid tumors:A marker of malignancy and a cause of gene silencing[J].Cancer Res,2003,63(9):2316-2321.
13 Schagdarsurengin U,Gimm O,Dralle H,et al.CpG island methylation of tumor-related promoters occurs preferentially in undifferentiated carcinoma[J].Thyroid,2006,16(7):633-642.
14 史晓光,滕卫平,成建新,等.甲状腺乳头状癌中TSHR NIS基因甲基化和蛋白表达及其与BRAF突变的关系[J].中国医科大学学报,2009,38(6):401-404.
15 樊嘉,邱双健.肿瘤微环境的研究动态与展望[J].中华医学杂志,2008,88(8):505-507.
16 黄韬.ATA、NCCN及欧洲分化型甲状腺癌临床指南异同点和国内应用探讨[J].中国实用外科杂志,2011,31(5):407-410.
17 Stephen JK,Chitale D,Narra V,et al.DNA methylation in thyroid tumorigenesis[J].Cancers (Basel),2011,3(2):1732-1743.
18 Xing M.Gene methylation in thyroid tumorigenesis[J].Endocrinology,2007,148(3):948-953.
19 Albores-Saavedra J,Henson DE,Glazer E,et al.Changing patterns in the incidence and survival of thyroid cancer with follicular phenotype——papillary,follicular,and anaplastic:A morphological and epidemiological study[J].Endocr Pathol,2007,18(1):1-7.
20 朱卫东,王鑫.甲状腺乳头状癌21例治疗分析[J].河北医药,2010,32(8):978.
21 Wada N,Masudo K,Nakayama H,et al.Clinical outcomes in older or younger patients with papillary thyroid carcinoma:Impact of lymphadenopathy and patient age[J].Eur J Surg Oncol,2008,34(2):202-207.
22 王勇,郭淑琴,程晓东.TGF-β1和CD31在甲状腺乳头状癌中的表达及临床意义[J].河北医药,2011,33(10):1477.
23 戴亚丽,蔡德鸿,宏陈,等.促进甲状腺激素受体和pl6抑癌基因甲基化与乳头状甲状腺癌临床病理的关系[J].首都医科大学学报,2012,33(3):361-365.



