文 静,付 研
尾加压素Ⅱ(urotensinⅡ,U-Ⅱ)最早是从鱼尾部下垂体中分离出的调节肽[1],近来已从人体中克隆出来,并发现人体内一种孤立的G蛋白偶联受体GPR14是其特异性受体。人尾加压素Ⅱ(hU-Ⅱ)是迄今人体内最强的缩血管活性肽[2-4]。hU-Ⅱ水平与心血管疾病如高血压、充血性心力衰竭等有关,而最近研究表明,2型糖尿病(T2DM)患者血浆中hU-Ⅱ水平升高。早期诊断糖尿病血管并发症并予以积极治疗可延缓病情进展,提高生活质量。本研究旨在通过检测糖尿病肾病患者血浆中hU-Ⅱ水平,研究T2DM肾病患者血浆hU-Ⅱ水平随病情进展而发生的变化,以探讨hU-Ⅱ在糖尿病肾病病理生理机制中的作用及其临床意义,并为糖尿病肾病的早期诊断提供参考。
1 资料与方法
1.1 一般资料 选取北京同仁医院南区综合内科2008年10月—2009年5月住院的T2DM患者66例。其中男34例、女32例,年龄(63.4±9.0)岁。均符合1999年世界卫生组织T2DM分型诊断标准。
1.2 排除标准 (1)患有自身免疫系统疾病、血液系统疾病、急性或慢性感染性疾病,各种病因导致的心力衰竭。(2)陈旧性心肌梗死病史,心电图示心肌缺血或冠状动脉造影示动脉狭窄或闭塞。(3)既往有脑梗死或脑出血病史,经CT或MRI证实存在脑梗死或脑出血改变。(4)留取标本时有糖尿病急性并发症,行血液透析,服用激素或肾毒性药物。
1.3 方法
1.3.1 临床参数测定 (1)一般资料采集:包括性别、年龄、体质量、病程、血压,冠心病(coronary heart disease,CHD)、脑血管疾病(cerebrovascular disease,CVD)病史。(2)生化指标测定:隔夜禁食10~12 h后清晨空腹抽取肘静脉血,分别测定空腹血糖(FPG)、血肌酐(Scr)、糖化血红蛋白(HbA1c)。(3)肾小球滤过率〔eGFR(ml/min)〕=〔(140-年龄)×体质量×(0.85女性)〕/〔72×Scr〕,Scr单位为mg/dl,年龄单位为岁,体质量单位为kg。(4)留取24 h尿液,二甲苯防腐,测定24 h尿清蛋白总量,计算尿清蛋白排泄率(urinary albumin excretion rates,UAER)。
1.3.2 hU-Ⅱ的测定 抽取晨起空腹肘静脉血 2 ml,注入含有 10% EDTA Na230 μl 和抑肽酶40 μl的试管中,混匀,4 ℃,3 000 r/min,离心10 min分离血浆,离心半径为10 cm。经酸化、洗脱、干燥、重溶等处理步骤后提取并采用放射免疫法分析测定血浆hU-Ⅱ。所用标准品为hU-Ⅱ,其放射活性的特异性与hU-Ⅱ有100%的交叉反应,与多种心血管活性肽均无交叉反应。
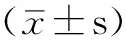
2 结果
2.1 不同尿蛋白水平组血浆hU-Ⅱ水平的变化 按照UAER将入选患者分为3组,A组:UAER<20 μg/min,为尿蛋白正常;B组:UAER 20~200 μg/min,为初期糖尿病肾病;C组:UAER>200 μg/min,为临床糖尿病肾病。C组患者血浆hU-Ⅱ水平高于A、B组,差异均有统计学意义(P<0.05);B组hU-Ⅱ水平高于A组,差异有统计学意义(P<0.05,见表1)。
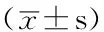
Table1 Comparison of plasma hU-Ⅱ levels in different levels of urinary protein groups

组别例数年龄(岁)病程(年)血浆hU-Ⅱ(ng/L)A组2357.9±5.75.8±5.427.26±4.58 B组2059.7±8.99.6±4.634.83±4.82* C组2361.7±7.212.2±5.148.26±4.86*△F值3.1092.4735.498P值0.1340.1620.034
注:与A组比较,*P<0.05;与B组比较,△P<0.05;hU-Ⅱ=人尾加压素-Ⅱ
2.2 不同肾功能组血浆hU-Ⅱ水平的变化 按照eGFR将入选患者分为3组,a组:eGFR>80 ml/min,为肾功能正常;b组:eGFR 51~80 ml/min,为肾功能不全代偿期;c组:eGFR 20~50 ml/min,为肾功能不全失代偿期。c组患者血浆hU-Ⅱ水平分别高于a、b组,差异均有统计学意义(P<0.05);b组hU-Ⅱ水平高于a组,差异有统计学意义(P<0.05,见表2)。
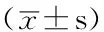
Table2 Comparison of plasma hU-Ⅱ levels in different renal function groups
组别例数年龄(岁)病程(年)血浆hU-Ⅱ(ng/L)a组1957.3±6.15.0±3.626.78±4.86 b组2460.3±6.98.5±4.233.36±3.92* c组2362.4±7.712.8±6.248.95±7.43*△F值3.4212.8706.032P值0.1050.1730.036
注:与a组比较,*P<0.05;与b组比较,△P<0.05
2.3 相关性分析 对血浆hU-Ⅱ水平与年龄、病程、收缩压(SBP)、舒张压(DBP)、FPG、HbA1c、Scr、UAER、eGFR进行Pearson相关分析,结果显示hU-Ⅱ与eGFR呈负相关(P<0.05),与FPG、HbA1c、Scr、UAER无直线相关性(P>0.05,见表3)。

表3 血浆hU-Ⅱ与其他临床指标的相关分析
注:eGFR=肾小球滤过率,FPG=空腹血糖,HbA1c=糖化血红蛋白,Scr=血肌酐,UAER=尿清蛋白排泄率
3 讨论
近年来,糖尿病已成为一种严重威胁人类健康常见的、多发的慢性代谢性疾病,糖尿病血管并发症是T2DM的主要临床特征之一,目前普遍认为是多因素共同作用的结果。本研究就T2DM肾病患者血浆hU-Ⅱ水平的变化进行了初步探讨。
多基因和环境因素参与了糖尿病的发病,胰岛素抵抗是T2DM的特征之一,而血管因子的紊乱参与了胰岛素的抵抗。有研究发现,T2DM患者血浆中hU-Ⅱ水平升高,hU-Ⅱ可能不仅与糖尿病内皮细胞损伤有关[5-6],而且还与糖代谢有关,是一个有效的胰岛素抑制肽,其作用可能通过GPR14受体作用在胰腺的β细胞来实现。
Totsune等[7]发现T2DM患者血浆及尿中hU-Ⅱ水平均明显升高,且随着肾功能的减退,血浆及尿中hU-Ⅱ水平明显增加。由此推断T2DM本身是导致血浆hU-Ⅱ水平升高的一个因素,在T2DM患者中肾衰竭也是血浆hU-Ⅱ水平升高的另一个因素。Langham等[8]和Shenouda等[9]研究显示,在糖尿病患者的组织染色中hU-Ⅱ及其受体基因表达明显增强,主要定位于肾小管上皮细胞;Matsushita等[10]认为肾脏富含hU-Ⅱ的mRNA,并有分泌、排泄hU-Ⅱ的作用。近来还发现hU-Ⅱ具有强烈的促有丝分裂作用[11]。由此可以推断,hU-Ⅱ及其受体基因在糖尿病肾病患者肾脏的大量表达上调可能直接参与其细胞外基质增加的病理过程。hU-Ⅱ及其受体共同定位于肾小管上皮细胞,与肾小管在糖尿病肾病患者肾功能障碍中的主要病理作用相符[12]。
本研究显示,血浆hU-Ⅱ与eGFR相关,前者随后者水平的降低而升高;以UAER和eGFR进行分组,结果显示随着糖尿病肾病的进展,血浆hU-Ⅱ水平逐渐升高。同时该研究中患者血浆hU-Ⅱ水平与FPG、HbA1c、Scr、UAER无直线相关性。Totsune等[7]认为,肾功能不全患者血浆hU-Ⅱ水平的升高可能由于肾脏排泄hU-Ⅱ减少而造成,但由于许多外周器官可能是血浆循环中hU-Ⅱ的来源,故不能排除在慢性肾衰竭时hU-Ⅱ产生增加的可能性[13-14]。
Langham等[8]发现血浆hU-Ⅱ水平在尚未出现清蛋白尿阶段即已升高,而UAER依据尿清蛋白情况对糖尿病肾病程度进行评估较hU-Ⅱ而言灵敏度低,本研究分别以UAER和eGFR分组,发现hU-Ⅱ水平变化一致。因此,把血浆hU-Ⅱ检测与UAER、eGFR等指标在临床中联合应用,有助于早期确诊糖尿病肾病。
本研究因临床工作限制,研究例数较少、试验条件有限,如何在实际工作中更为准确有效的测定和应用hU-Ⅱ评价糖尿病肾病进展,以及其对糖尿病视网膜病变及大血管病变的相关影响仍有待进一步探讨。
综上所述,血浆hU-Ⅱ水平可能参与糖尿病肾病的发生和发展过程,把血浆hU-Ⅱ检测与UAER、eGFR等指标在临床中联合应用,有助于早期确诊糖尿病肾病,并可监测其发展和评估预后,有利于糖尿病肾病的早期防治。
1 Bern HA,Pearson D,Larson BA,et al.Neurohormones from fish tails:the caudal neurosecretory system.I."Urophysiology" and the caudal neurosecretory system of fishes[J].Rec Prog Horm Res,1985,41:533-552.
2 Coulouarn Y,Jegou S,Tostivint H,et al.Cloning,sequence analysis and tissue distribution of the mouse and rat urotensin Ⅱ precursors[J].FEBS Lett,1999,457(1):28-32.
3 Elshourbagy NA,Douglas SA,Shabon U,et al.Molecular and pharmacological characterization of genes encoding urotensin-Ⅱ peptides and their cognate G-protein-coupled receptors from the mouse and monkey[J].Br J Pharmacol,2002,136(1):9-22.
4 Coulouam Y,Lihrmann I,Jegou S,et al.Cloning of the cDNA encoding urotensin Ⅱ precursor in frog and human reveals intense expression of the urotensin Ⅱ gene inmotoneurons of the spinal cord[J].Proc Natl Acad Sci USA,1998,95(26):15803-15808.
5 Silvestre RA,Rodríguez-Gallardo J,Egido EM,et al.Inhibition of insulin release by urotensin Ⅱ——a study on the perfused rat pancreas[J].Horm Metab Res,2001,33(6):379-381.
6 Silvestre RA,Egido EM,Hernández R,et al.Urotensin Ⅱ is present in pancreatic extracts and inhibits insulin release in the perfused rat pancreas[J].Eur J Endocrinol,2004,151(6):803-809.
7 Totsune K,Takahashi K,Arihara Z,et al.Increased p lasma urotensin Ⅱ levels in patients with diabetes mellitus[J].Clin Sci(Lond),2003,104(1):1-5.
8 Langham RG,Kelly DJ,Gow RM,et al.Increased expression of urotensin Ⅱ and urotensin Ⅱ receptor in human diabetic nephropathy[J].Am J Kidney Dis,2004,44(5):826-831.
9 Shenouda A,Douglas SA,Ohlstein EH,et al.Localization of urotensin Ⅱ immunoreactivity in normal human kidney and renal carcinoma[J].Histochem Cytochem,2002,50(7):885-889.
10 Matsushita M,Shichiri M,Imai T,et al.Co-expression of urotensin Ⅱ and its receptor (GPR14)in human cardiovascular and renal tissues[J].Hypertens,2001,19(12):2185-2190.
11 张勇刚,陈亚红,马春艳,等.尾加压素的促丝裂原作用[J].中国动脉硬化杂志,2001,9(1):14-16.
12 Gilbert RE,Cooper ME.The tubulointerstitium in progressive diabetic kidney disease:more than an aftermath of glomerular injury[J].Kidney Int,1999,56(5):1627-1637.
13 Totsune K,Takahashi K,Arihara Z,et al.Role of urotensin Ⅱ in patients on dialysis[J].Lancet,2001,358(9284):810-811.
14 Clozel M,Hess P,Qiu C,et al.The urotensin Ⅱ receptor antagonist palosuran improves pancreatic and renal function in diabetes rats[J].Pharmacol Exp Ther,2006,316(3):1115-1121.



