单 峤,王新军,王世勋,李培栋,吴建珩,李晓辉
胶质瘤是颅内最常见的恶性肿瘤,占中枢神经系统肿瘤的40%~50%,尽管近年来采用手术、放疗、化疗等方法治疗有了很大的进展,但恶性胶质瘤患者的预后仍然很差。Bmi-1(B-cell specific Moloney murine leukemia virus integration site-1)基因是在鼠淋巴瘤细胞中发现的,是多梳基因(ploycomb group genes,PcG)家族的重要成员之一,目前认为Bmi-1是一种原癌基因[1]。Bmi-1在调节干细胞自我更新、细胞增殖、周期调控和抗凋亡等方面具有十分重要的作用。近年来研究发现,Bmi-1在人类淋巴瘤、喉癌、肺癌、大肠癌、胰腺癌、宫颈癌等肿瘤中呈高表达,与这些肿瘤的发生、进展、转移和预后息息相关[2]。目前,国内外对Bmi-1基因在胶质瘤中的表达及作用的研究报道较少。本研究通过反转录-聚合酶链反应(RT-PCR)和蛋白印迹法(Western blotting)检测Bmi-1在不同级别胶质瘤组织中的表达情况,探讨其在胶质瘤发生、进展中的作用机制以及与胶质瘤病理分级和预后的关系。
1 资料与方法
1.1 一般资料 收集2011年1月—2013年3月在郑州大学第五附属医院住院的胶质瘤患者术后标本82例,术前均未行放、化疗。根据《2007年WHO中枢神经系统肿瘤组织学分类》[3]标准进行分级:低级别胶质瘤组(Ⅰ~Ⅱ级)37例,其中少突胶质细胞瘤13例、星形细胞瘤8例、室管膜瘤6例、室管膜下巨细胞型星形细胞瘤5例、弥漫性星形细胞瘤3例、毛细胞黏液样星形细胞瘤2例,男20例、女17例,年龄31~82岁,平均(58.6±6.7)岁;高级别胶质瘤组(Ⅲ~Ⅳ级)45例,其中胶质母细胞瘤14例、髓母细胞瘤9例、间变性星形细胞瘤8例、间变性少突胶质细胞瘤5例、室管膜母细胞瘤5例、间变性神经节胶质细胞瘤4例,男24例、女21例,年龄34~88岁,平均(61.3±7.8)岁。另收集脑创伤行内减压去除的脑组织32例作为对照组,男17例,女15例,年龄(60.5±7.1)岁。各组的性别、年龄间有均衡性。所有标本取下后立刻放入液氮中,-196 ℃保存。
1.2 RT-PCR 采用Primer premier 6.0软件设计引物,由生工生物工程(上海)股份有限公司合成,Bmi-1上游引物:5′-AATCTAAGGAGGAGGTGA-3′,下游引物:5′-CAAACAAGAGGTGGAAAG-3′,引物长度472 bp;β-actin上游引物:5′-AGAAAGGAAGGCTGGAGTGC-3′,下游引物:5′-AGACTGGGACATGGAAACGA-3′,引物长度186 bp。应用RT-PCR试剂盒〔生工生物工程(上海)股份有限公司〕,按照说明书完成实验。反应产物经1.5%琼脂糖凝胶电泳30 min,应用美国Eagle EyeⅡ型凝胶图像软件测定目的基因的吸光度值。
1.3 Western blotting 裂解组织提取蛋白,应用二辛可酸(bicinchoninic acid,BCA)法对蛋白进行定量。分别于10%、7% SDS-PAGE电泳分离蛋白后,转移至聚偏二氯乙烯膜(PVDF)膜上,50 mg/L脱脂奶粉室温封闭1 h,加入一抗兔抗人Bmi-1单克隆抗体(1∶400,Santa公司)进行孵育,4 ℃,过夜。加入辣根过氧化物酶标记的羊抗兔二抗(1∶1 000,北京中杉金桥生物技术有限公司)进行孵育,室温,1 h。ECL发光试剂盒暗室发光、显影、定影。应用图像分析系统进行分析。
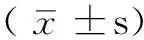
2 结果
2.1 RT-PCR检测Bmi-1 mRNA的表达水平 低级别和高级别胶质瘤组Bmi-1 mRNA表达水平较对照组升高,差异有统计学意义 (P<0.05);高级别胶质瘤组Bmi-1 mRNA表达水平较低级别胶质瘤组升高,差异有统计学意义(P<0.05,见表1、图1)。
2.2 Western blotting 检测Bmi-1 蛋白的表达水平 低级别和高级别胶质瘤组Bmi-1蛋白表达水平较对照组上调,差异有统计学意义(P<0.05);高级别胶质瘤组Bmi-1蛋白表达水平较低级别胶质瘤组上调,差异有统计学意义(P<0.05,见表2、图2)。
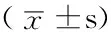
Table1 Expression levels of Bmi-1 mRNA in glioma group and in control group

组别例数Bmi-1/β-actinmRNA对照组320.143±0.066低级别胶质瘤组370.376±0.082*高级别胶质瘤组450.708±0.119*△F值53.365P值0.000
注:与对照组比较,*P<0.05;与低级别胶质瘤组比较,△P<0.05
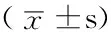
Table2 Expression levels of Bmi-1 protein in glioma group and in control group

组别例数Bmi-1/β-actin蛋白对照组320.192±0.072低级别胶质瘤组370.395±0.096*高级别胶质瘤组450.769±0.124*△F值48.692P值0.000
注:与对照组比较,*P<0.05;与低级别胶质瘤组比较,△P<0.05
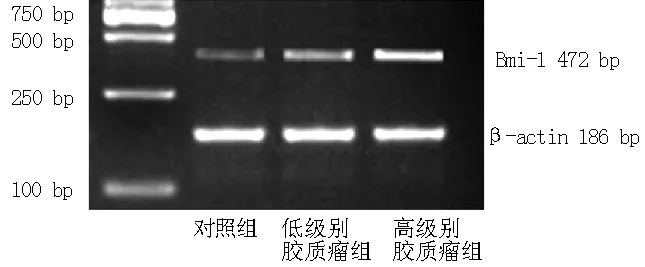
图1 RT-PCR检测Bmi-1 mRNA表达水平
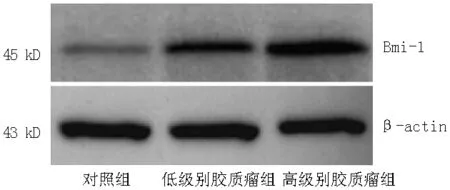
图2 Western blotting检测Bmi-1蛋白表达水平
3 讨论
胶质瘤是颅内最常见的恶性肿瘤,其发生是一个多基因、多步骤、多阶段的复杂过程。近年来,人们已认识到细胞周期调控紊乱与肿瘤的发生、进展和预后密切相关,进而开始研究肿瘤细胞周期调控机制。PcG家族是在进化中高度保守的防止细胞表型发生改变而记忆转录状态的细胞记忆系统的重要组成部分。其参与对同源异型基因(Hox)表达的抑制,且与细胞周期的调节、细胞的增殖及肿瘤的发生密切相关[4]。Bmi-1是PcG家族的核心成员之一,定位于10p13,含有10个外显子,能够编码326个氨基酸,相对分子量为45 kD。Bmi-1是一种广泛表达的核蛋白,在DNA损伤修复、染色质的稳定、细胞周期的调控、基因转录激活及抗凋亡等方面起着重要作用。近年来研究表明,Bmi-1在人体多种恶性肿瘤中高表达,与肿瘤的发生和进展密切相关,提示Bmi-1在研究肿瘤的发病机制及治疗等方面可能具有较高的潜在价值[5]。
本研究发现,无论在mRNA水平还是蛋白水平,胶质瘤中Bmi-1的表达水平均高于对照组,提示Bmi-1可能在胶质瘤的发生过程中起着重要作用,这与Häyry等[6]的研究结果一致。本实验结果还显示,Bmi-1基因和蛋白在高级别胶质瘤组中的表达高于低级别胶质瘤组。可见,胶质瘤的恶性程度越高,Bmi-1表达就越高,提示Bmi-1可能在胶质瘤的进展过程中起重要的促进作用,抑制胶质瘤细胞凋亡。Gopinath等[7]应用显色原位杂交技术对100例Ⅱ~Ⅳ级人胶质瘤进行了Bmi-1基因位点复制数目的研究,发现均有Bmi-1基因位点复制数目的增加,其在高级别胶质瘤组增加尤为明显,说明Bmi-1可能促进了胶质瘤的发生。Bmi-1作为转录抑制因子可负性调控下游位点INK4a-ARF。INK4a-ARF位点能够编码细胞增殖抑制蛋白:p16INK4a和p14ARF,这两种蛋白可以分别通过肿瘤抑制蛋白pRb和转录因子p53相关的细胞周期调节途径而发挥作用,从而影响细胞的增殖和凋亡。胶质瘤中Bmi-1过表达时,p16INK4a表达下调,高磷酸化的pRb与转录因子E2F结合使细胞进入S期,延缓胶质瘤细胞的衰老和凋亡[8]。同样,Bmi-1可负性调控p14ARF的表达,从而影响锌指蛋白MDM2与p53的结合,控制胶质瘤细胞的增殖过程。可见,Bmi-1极有可能在胶质瘤细胞中处于活化状态,通过参与对p16、p15和p53等抑癌基因的异常沉默,使细胞周期蛋白依赖性激酶(CKD)持续性活化和细胞周期失控,从而使胶质瘤细胞处于增殖状态。另外,Gargiulo等[9]发现Bmi-1与上皮细胞端粒酶的活性有关,其表达增高能够上调人端粒酶逆转录酶(hTERT)的转录,使端粒酶的活性增高,阻止胶质瘤细胞衰老并导致永生化。此外,Bmi-1是神经嵴干细胞自我更新的关键因素,神经嵴干细胞自我更新的过程中Bmi-1的过表达可能使细胞的分化异常、凋亡被抑制,这可能是导致胶质瘤发生的另外一种机制。
胶质瘤的病理分级是患者预后的关键因素之一。本研究结果显示,胶质瘤的病理分级越高,Bmi-1表达越高。Acquati等[10]研究也发现Bmi-1阳性的胶质瘤患者的2年生存率显著低于Bmi-1阴性的胶质瘤患者。Bmi-1能够使肿瘤细胞对一些化疗药物产生耐药性,肿瘤细胞内Bmi-1的表达越高,其对化疗药物的耐药程度也越高,这对胶质瘤患者的预后不利。有研究表明,抑制Bmi-1的表达能够明显增加胶质瘤细胞对化疗药物的敏感性[11]。这些研究提示抑制Bmi-1能够增强化疗药物的作用,为最大程、限度地根除肿瘤细胞提供了一个可能的治疗途径。最近一项研究报道,以Bmi-1 siRNA转染U251胶质瘤细胞株后,通过RT-PCR法证实Bmi-1在U251细胞中表达降低,接下来应用CCK8观察到被干扰的胶质瘤细胞增殖速度比未干扰的细胞减慢[12]。这些研究提示通过抑制Bmi-1可能达到治疗胶质瘤的目的。因此,进一步探索Bmi-1在胶质瘤发生发展中的分子学机制将有助于更好地阐述胶质瘤的生物学行为,而下调Bmi-1的表达则可能成为治疗胶质瘤的新方法。
总之,本研究发现Bmi-1与胶质瘤的形成及恶性程度存在一定的联系,很可能参与胶质瘤恶变的某些环节。Bmi-1过表达引起的INK4a-ARF下调可能是胶质瘤发生的重要基础,但其在胶质瘤中的具体分子机制还需进一步研究。Bmi-1表达水平与胶质瘤的病理分级相关,提示Bmi-1有望成为预测胶质瘤进展和预后的新指标。本研究丰富了人们对胶质瘤治疗的探索,下调Bmi-1的表达可能会抑制胶质瘤细胞的增殖、增加胶质瘤细胞的凋亡和提高化疗药物的敏感性,为胶质瘤的治疗提供了新的靶点和理论基础。
1 Yadav AK,Sahasrabuddhe AA,Dimri M,et al.Deletion analysis of BMI1 oncoprotein identifies its negative regulatory domain[J].Molecular Cancer,2010,9:158.
2 Qu D,Sureban SM,May R,et al.208 DCAMKL-1 regulates BMI1 expression in colorectal and pancreatic cancer cells[J].Gastroenterology,2012,142(5):S-51.
3 Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumours of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.
4 Brecqueville M,Adélaïde J,Bertucci F,et al.Alterations of polycomb gene BMI1 in human myeloproliferative neoplasms[J].Cell Cycle,2012,11(16):3141-3142.
5 Bondgaard AL,Poulsen TT,Poulsen HS,et al.Different expression of EZH2,BMI1 and Ki67 in low and high grade neuroendocrine tumors of the lung[J].Cancer Biomark,2011,11(2/3):123-128.
6 Häyry V,Tanner M,Blom T,et al.Copy number alterations of the polycomb gene BMI1 in gliomas[J].Acta Neuropathol,2008,116(1):97-102.
7 Gopinath S,Malla R,Alapati K,et al.Cathepsin B and uPAR regulate self-renewal of glioma-initiating cells through GLI-regulated Sox2 and Bmi1 expression[J].Carcinogenesis,2013,34(3):550-559.
8 Cenci T,Martini M,Montano N,et al.Prognostic relevance of c-Myc and BMI1 expression in patients with glioblastoma[J].Am J Clin Pathol,2012,138(3):390-396.
9 Gargiulo G,Cesaroni M,Serresi M,et al.In vivo RNAi screen for BMI1 targets identifies TGF-β/BMP-ER stress pathways as key regulators of neural- and malignant glioma-stem cell homeostasis[J].Cancer Cell,2013,23(5):660-676.
10 Acquati S,Greco A,Licastro D,et al.Epigenetic regulation of survivin by Bmi1 is cell type specific during corticogenesis and in gliomas[J].Stem Cells,2013,31(1):190-202.
11 Larsen CJ.Bmi1,an active gene in the life of stem cells,increases radioresistance of CD133(+) tumoral cells of glioblastoma[J].Bulletin Du Cancer,2010,97(10):1129.
12 Wang X,Venugopal C,Manoranjan B,et al.Sonic hedgehog regulates Bmi1 in human medulloblastoma brain tumor-initiating cells[J].Oncogene,2012,31(2):187-199.



