王玉珏,李云超,庄雅娟,邱 虹,陈 广,于向东
胶质瘤是神经系统最常见的发病率最高的恶性肿瘤,且疗效不佳。本研究采用原位杂交组织化学技术(ISHH)检测正常脑组织及不同级别胶质瘤细胞中半乳糖凝集素3(galectin-3)、整合素αvβ3及基质金属蛋白酶2(MMP-2)mRNA的表达,了解三者在脑胶质瘤中的表达规律,并初步探讨三者在分子水平方面对胶质瘤发生、进展、浸润以及血管生成中的作用,从分子水平角度为临床提供评价预后及靶向治疗的新思路。
1 资料与方法
1.1 一般资料 选取2012—2013年河北联合大学附属开滦总医院病理科存档的经甲醛固定、石蜡包埋的胶质瘤标本40例,其中男26例,女14例;年龄13~68岁,平均(46±16)岁,中位年龄49岁。根据世界卫生组织中枢神经系统肿瘤分级标准(2000年),将40例标本进行分级:Ⅰ级12例,Ⅱ级11例,Ⅲ级13例,Ⅳ级4例,Ⅰ、Ⅱ级为低度恶性胶质瘤组,Ⅲ、Ⅳ级为高度恶性胶质瘤组。另取同期同一医院神经外科收治的脑创伤患者内减压术中得到的5例正常脑组织标本,其中男3例,女2例;年龄35~53岁,中位年龄44岁。
1.2 方法 标本制备:所有标本经4%甲醛固定,常规石蜡包埋,蜡块连续切片,片厚4 μm,连续做3张切片,在55 ℃高压过的焦碳酸二乙酯(DEPC)水中展片,用原位杂交专用载玻片捞片。3张切片分别用于galectin-3、整合素αvβ3、MMP-2 mRNA的原位杂交。galectin-3原位杂交试剂盒、整合素αvβ3原位杂交试剂盒、MMP-2原位杂交试剂盒均来自武汉博士得生物工程有限公司。3个指标的多相寡核苷酸探针序列见表1。
检测方法如下:(1)60~65 ℃烤片2~4 h至蜡融化为止。(2)切片经二甲苯脱蜡20 min 2次,脱蜡后的切片在100%、90%、80%乙醇中分别放置20 min后,经DEPC水、磷酸盐缓冲液(PBS)漂洗3次,5 min/次。(3)3%过氧化氢(H2O2)室温浸泡5~10 min,DEPC水漂洗3次,5 min/次。(4)暴露mRNA核酸片段:每张切片上滴加3%柠檬酸新鲜稀释的胃蛋白酶,37 ℃消化20 min,0.02 mol/L PBS漂洗3次,5 min/次,DEPC水漂洗1次,约5 min。(5)后固定:0.1 mol/L PBS(pH 7.2~7.6)室温固定10 min,DEPC水漂洗3次,5 min/次。(6)预杂交:每张切片加20 μl预杂交液恒温箱42 ℃ 3 h,吸取多余液体,不洗。(7)杂交:每张切片加入20 μl杂交液,将原位杂交专用盖玻片的保护膜揭开后,盖在切片上,胶带封闭湿盒,恒温箱42 ℃杂交过夜。(8)杂交后洗涤:揭掉盖玻片,37 ℃水温的核酸杂交漂洗液(高张力,2×SSC)漂洗2次,5 min/次,37 ℃水温的核酸杂交漂洗液(低张力,0.5×SSC)漂洗1次,约15 min,37 ℃水温的0.2×SSC漂洗1次,约15 min,注意湿盒湿度,防止干片。(9)滴加封闭液:37 ℃孵育30 min后,甩去多余液体,不洗。(10)滴加生物素化鼠抗地高辛37 ℃孵育60 min后,0.02 mol/L PBS漂洗4次,5 min/次。(11)滴加链霉亲和素-生物素-过氧化物酶复合物(SABC):37 ℃孵育20 min后,0.02 mol/L PBS漂洗3次,5 min/次。(12)滴加生物素化过氧化物酶:37 ℃孵育20 min后,0.02 mol/L PBS漂洗4次,5 min/次。(13)二氨基联苯胺(DAB)显色:使用新鲜配置的DAB显色剂,加至标本上。显色3~10 min。(14)苏木素复染,乙醇脱水,二甲苯透明,中性树胶封片。(15)光学显微镜下观察。阴性对照:采用探针阴性对照,除杂交液不含探针外,其余成分相同。显微镜下根据瘤细胞中galectin-3、整合素αvβ3、MMP-2 mRNA阳性细胞数判断其表达阳性细胞计数,以阳性指数(LI)表示,LI=阳性细胞数/瘤细胞总数×100%。
表1 Galectin-3、整合素αvβ3和MMP-2多相寡核苷酸探针序列
Table1 Galectin-3,integrin αvβ3and MMP-2 polyphase oligonucleotide probe sequence
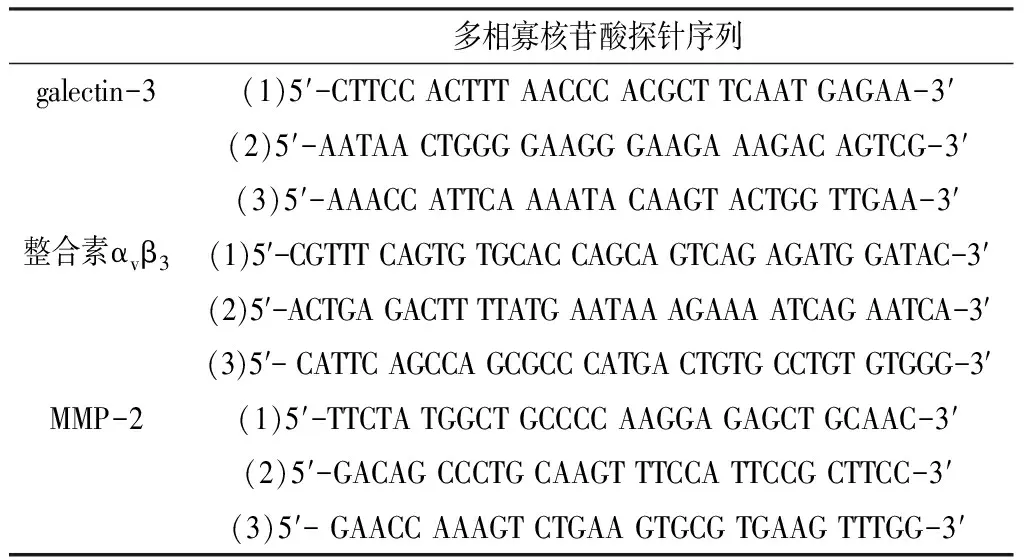
多相寡核苷酸探针序列galectin-3(1)5′-CTTCCACTTTAACCCACGCTTCAATGAGAA-3′(2)5′-AATAACTGGGGAAGGGAAGAAAGACAGTCG-3′(3)5′-AAACCATTCAAAATACAAGTACTGGTTGAA-3′整合素αvβ3(1)5′-CGTTTCAGTGTGCACCAGCAGTCAGAGATGGATAC-3′(2)5′-ACTGAGACTTTTATGAATAAAGAAAATCAGAATCA-3′(3)5′-CATTCAGCCAGCGCCCATGACTGTGCCTGTGTGGG-3′MMP-2(1)5′-TTCTATGGCTGCCCCAAGGAGAGCTGCAAC-3′(2)5′-GACAGCCCTGCAAGTTTCCATTCCGCTTCC-3′(3)5′-GAACCAAAGTCTGAAGTGCGTGAAGTTTGG-3′
注:galectin-3=半乳糖凝集素3,MMP-2=基质金属蛋白酶2
1.3 结果判定 Galectin-3、整合素αvβ3mRNA以肿瘤细胞的胞质中出现棕色或棕黄色染色为阳性杂交信号。MMP-2 mRNA以肿瘤细胞及血管基底膜内皮细胞的胞质出现棕色或棕黄色染色为阳性杂交信号。根据阳性细胞数进行阳性程度分级:阳性细胞数≤4%为阴性(-);阳性细胞数5%~10%为弱阳性(+);阳性细胞数11%~49%为阳性(++);阳性细胞数≥50%为强阳性(+ + +)。
2 结果
2.1 Galectin-3 mRNA的表达 正常脑组织中galectin-3 mRNA无表达(见图1)。在人脑胶质瘤中galectin-3 mRNA主要表达于肿瘤细胞的胞质,其表达是在胞质中出现棕色或棕黄色染色(见图2、3)。在Ⅰ~Ⅱ级胶质瘤标本中,galectin-3 mRNA表达阳性2例、弱阳性4例、阴性17例,LI为(4.8±3.2)%;在Ⅲ~Ⅳ级胶质瘤标本中,galectin-3 mRNA表达强阳性4例、阳性6例、弱阳性1例、阴性6例,LI为(27.3±22.7)%。Ⅰ~Ⅱ级胶质瘤标本中galectin-3 mRNA的LI与Ⅲ~Ⅳ级胶质瘤标本比较,差异有统计学意义(t=4.055,P<0.05)。
2.2 整合素αvβ3mRNA的表达 正常脑组织中整合素αvβ3mRNA无表达(见图4)。在人脑胶质瘤中整合素αvβ3mRNA主要表达于肿瘤细胞的胞质,其表达是在胞质中出现棕色或棕黄色染色(见图5、6)。在Ⅰ~Ⅱ级胶质瘤标本中,整合素αvβ3mRNA表达阳性3例、弱阳性4例、阴性16例,LI为(5.4±3.8)%;在Ⅲ~Ⅳ级胶质瘤标本中,整合素αvβ3mRNA表达强阳性4例、阳性6例、弱阳性3例、阴性4例,LI为(29.2±21.1)%。Ⅰ~Ⅱ级胶质瘤标本中整合素αvβ3mRNA的LI与Ⅲ~Ⅳ级胶质瘤标本比较,差异有统计学意义(t=4.613,P<0.05)。
2.3 MMP-2 mRNA的表达 正常脑组织中MMP-2 mRNA无表达(见图7)。在人脑胶质瘤中MMP-2 mRNA主要表达于肿瘤细胞及血管基底膜内皮细胞的胞质,其表达是在胞质中出现棕色或棕黄色染色(见图8~10)。在Ⅰ~Ⅱ级胶质瘤标本中,MMP-2 mRNA表达阳性5例、弱阳性3例、阴性15例,LI为(6.4±5.3)%;在Ⅲ~Ⅳ级胶质瘤标本中,MMP-2 mRNA表达强阳性4例、阳性7例、弱阳性1例、阴性5例,LI为(29.9±24.0)%。Ⅰ~Ⅱ级胶质瘤标本中MMP-2 mRNA的LI与Ⅲ~Ⅳ级胶质瘤标本比较,差异有统计学意义(t=3.966,P<0.05)。
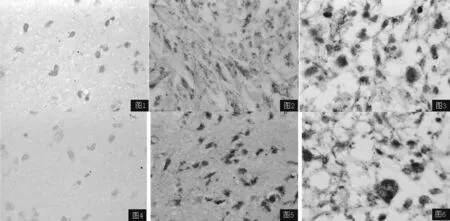
图1 Galection-3 mRNA在正常脑组织中无表达(ISHH,×400)
Figure1 No positive stain of galectin-3 mRNA in normal brain tissue
图2 Galection-3 mRNA在低度恶性胶质瘤细胞胞质内阳性表达(ISHH,×400)
Figure2 Positive stain of galectin-3 mRNA in tumor cell plasma of low grade glioma
图3 Galection-3 mRNA在高度恶性胶质瘤细胞胞质内阳性表达(ISHH,×400)
Figure3 Positive stain of galectin-3 mRNA in tumor cell plasma of high grade glioma
图4 整合素αvβ3mRNA在正常脑组织中无表达(ISHH,×400)
Figure4 No positive stain of integrinαvβ3mRNA in normal brain tissue
图5 整合素αvβ3mRNA在低度恶性胶质瘤细胞胞质内阳性表达(ISHH,×400)
Figure5 Positive stain of integrinαvβ3mRNA in tumor cell plasma of low grade glioma
图6 整合素αvβ3mRNA在高度恶性胶质瘤细胞胞质内阳性表达(ISHH,×400)
Figure6 Positive stain of integrinαvβ3mRNA in tumor cell plasma of high grade glioma
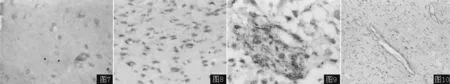
图7 MMP-2 mRNA在正常脑组织中无表达(ISHH,×400)
Figure7 No positive stain of MMP-2 mRNA in normal brain tissue
图8 MMP-2 mRNA在低度恶性胶质瘤细胞胞质内阳性表达(ISHH,×400)
Figure8 Positive stain of MMP-2 mRNA in tumor cell plasma of low grade glioma
图9 MMP-2 mRNA在高度恶性胶质瘤细胞胞质内阳性表达(ISHH,×400)
Figure9 Positive stain of MMP-2 mRNA in tumor cell plasma of high grade glioma
图10 MMP-2 mRNA在高度恶性胶质瘤血管内皮细胞阳性表达(ISHH,×400)
Figure10 Positive stain of MMP-2 mRNA in vascular endothelial cell of high grade glioma
2.4 Galectin-3、整合素αvβ3、MMP-2 mRNA表达的相关性分析 绘制3个指标的三维散点图,以揭示它们之间的相关性(见图11)。结果显示,galectin-3 mRNA的表达与整合素αvβ3、MMP-2 mRNA的表达均呈正相关(r值分别为0.718和0.790,P<0.05);整合素αvβ3mRNA的表达与MMP-2 mRNA的表达呈正相关(r=0.812,P<0.05)。
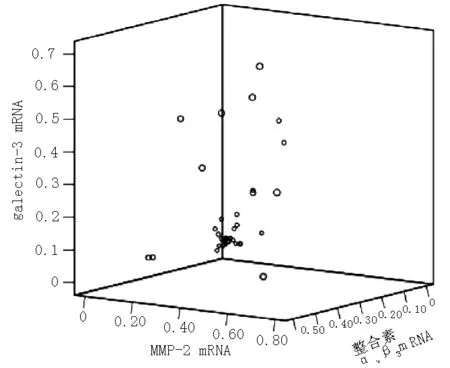
图11 Galectin-3、整合素αvβ3、MMP-2 mRNA表达的两两相关性散点图
Figure11 Scatter diagram of correlation between galectin-3,integrin αvβ3and MMP-2 mRNA expression
3 讨论
Galectin-3是一个31 kD的β半乳糖蛋白,存在于细胞内和细胞外,主要与细胞内的糖蛋白、细胞表面分子和细胞外基质(ECM)作用,降低肿瘤细胞与ECM的黏附,从而促进肿瘤细胞侵袭,参与肿瘤的发生及发展的全过程[1]。Bresalier等[2]于1997年首先用免疫组化方法研究42例胶质瘤galectin-3表达,发现低级别的胶质瘤呈低表达,高级别的间变性星形细胞瘤和胶母细胞瘤呈高表达,提示galectin-3的表达水平与病理分级呈正相关,即随着恶性程度增加而增加[3];胶质瘤浸润带内5%以上的细胞表达galectin-3,而正常脑组织内不表达,这表明galectin-3在肿瘤对周围组织的侵袭中起重要作用。Kuklinski等[4]应用RT-PCR及Western blotting法检测galectin-3 mRNA在胶质瘤细胞的表达,结果表明:galectin-3 mRNA选择性地在高级别星形细胞瘤和少突胶质细胞瘤表达。Camby等[5]的体外实验研究结果表明:galectin-3 mRNA与胶质瘤的浸润、迁移有关。本研究检测不同级别人脑胶质瘤细胞galectin-3 mRNA表达的阳性率及LI,结果发现Ⅲ~Ⅳ级胶质瘤细胞galectin-3 mRNA的LI显著高于Ⅰ~Ⅱ级胶质瘤,而正常脑组织内无galectin-3 mRNA表达。本研究结果与上述报道一致,因此本研究认为galectin-3 mRNA表达失调可能是胶质瘤间变的一个重要标志,是胶质瘤细胞从分子水平获得侵袭能力的标志,这也与胶质瘤的生物学特性相符合。Ⅰ~Ⅱ级胶质瘤属于恶性程度较低的肿瘤,生长较为局限,患者术后生存期较长。Ⅲ~Ⅳ级胶质瘤多呈浸润性生长,易发生侵袭和转移,患者临床预后差。从分子角度来说,胶质瘤恶性程度越高,galectin-3 mRNA表达量越多,越有利于胶质瘤细胞在分子水平侵袭性生长,从而促进肿瘤的浸润和转移。
细胞黏附分子(CAM)是一类调节细胞与细胞、细胞与ECM间相互结合、相互作用的一类细胞膜表面糖蛋白,其参与许多生理和病理过程中细胞间信号的传导,包括肿瘤细胞的转移和生长[6]。整合素αvβ3是重要的CAM,在细胞与ECM间的黏附及信息传递中发挥很重要的作用,参与肿瘤的发生及发展的全过程。整合素αvβ3又称玻璃体结合蛋白受体(VN)[7],是一种具有多种功能的整合素分子。能识别玻璃体结合蛋白上的RGD。细胞表面的整合素αvβ3与配体结合后,可介导细胞黏附和信号转导,从而在肿瘤的浸润和转移中发挥作用。有研究发现,肿瘤细胞表面的整合素αvβ3细胞黏附受体与ECM成分黏附所致的肿瘤细胞游离或通过基底膜过程,是恶性肿瘤浸润性生长和远处转移的始动步骤[8]。Bello等[9]采用Western blotting法及免疫组化方法研究了40例脑胶质瘤及10例正常脑组织的整合素αvβ3的表达,发现整合素αvβ3在正常脑组织不表达,在胶质瘤的星形细胞表达,且其表达水平与胶质瘤的恶性程度及组织学类型密切相关,表明整合素αvβ3与胶质瘤的浸润及转移密切相关。有文献报道,整合素αvβ3在胶质瘤组织中表达,同ECM相互作用,参与胶质瘤的浸润及转移过程[10]。郭衍等[11]研究发现,整合素αvβ3与胶质瘤的恶性程度呈正相关,促进胶质瘤的浸润及转移。本研究检测不同级别胶质瘤标本中整合素αvβ3mRNA表达的阳性率及LI,结果显示Ⅲ~Ⅳ级胶质瘤细胞整合素αvβ3mRNA的LI显著高于Ⅰ~Ⅱ级胶质瘤,而正常脑组织内无整合素αvβ3mRNA表达。本研究结果与上述报道一致,因此本研究认为整合素αvβ3mRNA表达失调也可能是胶质瘤间变的一个重要标志,是胶质瘤细胞从分子水平获得侵袭能力的标志,符合胶质瘤的生物学特性。可见,胶质瘤恶性程度越高,整合素αvβ3mRNA表达量越多,越有利于胶质瘤细胞侵袭性生长,促进肿瘤的浸润和转移。本研究提示,整合素αvβ3mRNA可以作为胶质瘤恶性及侵袭程度的参考指标;对胶质瘤从分子水平方面进行的检测,在判断肿瘤恶性程度及预后方面可能具有更重要的意义。
胶质瘤的生物学行为和预后同肿瘤细胞的侵袭程度密切相关。肿瘤细胞在侵袭过程中必须破坏由细胞间基质及基膜构成的ECM屏障。在ECM的酶类中,基质金属蛋白酶(MMPs)与肿瘤侵袭的关系最为密切[12-13]。Yamamoto等[14]研究表明,具有侵袭能力的胶质瘤细胞可分泌大量的MMP-2,同时其侵袭力与MMP-2表达水平存在密切关系——恶性程度越高,MMP-2表达水平亦明显增高。Sawaya等[15]体内试验发现,MMP-2蛋白表达水平与人脑星形胶质细胞瘤级别呈正相关。另有研究也表明,MMP-2与胶质瘤的侵袭性有很大的相关性,具有侵袭能力的胶质瘤细胞分泌大量的MMP-2,其侵袭能力同MMP-2表达水平呈正相关,随着胶质瘤恶性程度的增高,MMP-2 mRNA转录和表达水平亦明显上调[16]。本研究结果显示,Ⅲ~Ⅳ级胶质瘤细胞MMP-2 mRNA的LI显著高于Ⅰ~Ⅱ级胶质瘤,而正常脑组织内无表达。本研究结果与上述报道一致。另外本研究发现,MMP-2 mRNA在胶质瘤基质中表达主要位于血管内皮细胞。提示MMPs与胶质瘤的血管生成有关,而胶质瘤血管生成是其侵袭的必要条件。胶质瘤侵袭生长时必须有肿瘤血管形成来为其提供营养,肿瘤血管又可促进其侵袭,肿瘤细胞可沿新生血管开启的裂隙向外侵入周围组织,这也是胶质瘤侵袭的主要方式之一。Vince等[17]运用原位杂交方法研究胶质瘤血管形成,发现MMP-2 mRNA表达主要位于血管内皮细胞,参与胶质瘤血管形成过程,本研究结果与之一致。因此本研究认为,MMP-2 mRNA表达失调是胶质瘤细胞获得侵袭能力的标志,符合胶质瘤的生物学特性。可见,胶质瘤恶性程度越高,MMP-2 mRNA表达量越多,在分子水平方面越有利于胶质瘤细胞侵袭性生长,促进肿瘤的浸润和转移。本研究提示,检测胶质瘤组织中MMP-2 mRNA表达,对于临床上从分子水平预测胶质瘤的恶性程度、侵袭性及判断预后具有一定的指导意义。
此外,本研究还发现,galectin-3、整合素αvβ3、MMP-2 mRNA的表达均互相呈正相关,共同为肿瘤的浸润生长创造有利的生存内环境。其机制可能为:(1)galectin-3的功能性糖识别域可与整合素α1β1上的半乳糖残基结合,调节肿瘤细胞与ECM的结合,高浓度的galectin-3可导致整合素与ECM配体的结合障碍,从而调节细胞黏附,促进肿瘤细胞的浸润[18];(2)整合素αvβ3是通过调控MMP-2的生成和激活对基质蛋白进行降解,从而促进肿瘤细胞的浸润与转移[19];(3)galectin-3又是MMP-2的底物,MMP-2将galectin-3分解后产生1个分子质量为22 kU的糖识别域和1个分子质量为9 kU的氨基酸残基组成galectin-3末端片段,该片段可以与MMP-2结合促进肿瘤的浸润与转移[20]。
综上所述,galectin-3、整合素αvβ3、MMP-2 mRNA从分子水平共同促进胶质瘤的发展、浸润及血管生成,三者之间起协同作用。因此,联合检测脑胶质瘤中galectin-3、整合素αvβ3、MMP-2 mRNA的表达,可从分子水平预测胶质瘤的恶性程度、侵袭性,为预后判断提供参考依据。
1 邢变枝,毛善平.galectin-3在人脑星形胶质瘤细胞中的表达[J].卒中与神经疾病,2010,11(6):381-384.
2 Bresalier RS,Yan PS,Byrd JC,et al.Expression of the endogenous galactose-binding protein galectin-3 correlates with the malignant potential of tumors in the centralnervous system[J].Cancer,1997,80(4):776-787.
3 Akimoto Y,Hirabayashi J,Kasai K,et al.Expression of the endogenous 14-kDa beta-galactoside-binding lectin galectin in normal human skin[J].Cell Tissue Res,1995,280(1):1-10.
4 Kuklinski S,Pesheva P,Heimann C,et al.Expression pattern of galectin-3 in neural tumor cell lines[J].J Neurosci Res,2000,60(1):45-57.
5 Camby I,Belot N,Rorive S,et al.Galectins are differentially expressed in supratentorial pilocytic astrocytomas,astrocytomas,anaplastic astrocyto-mas and glioblastomas,and sigsignificantly modulate tumor astrocyte migration[J].Brain Pathol,2001,11(1):12-26.
6 Yasuda M,Tanaka Y,Tamura M,et al.Stimulation of beta1 integrin down-regulates ICAM-1 expression and ICAM-1-dependent adhesion of lung cancer cells through focal adhesion kinase[J].Cancer Res,2001,61(5):2022-2030.
7 Seftor RE.Role of the beta3 integrin subunit in human primary melanoma progression:multifunctional activities associated with alpha(v)beta3 integrin expression[J].Am J Path,1998,153(5):1347-1351.
8 Trikha M,Timar J,Zacharek A,et al.Role for beta 3 integrins in human melanoma growth and survival[J].Int J Cancer,2008,101(3):156-167.
9 Bello L,Francolini M,Marthyn P,et al.αvβ3 and αvβ5 integrin expression in glioma periphery [J].Neurosurgery,2001,49(2):380-390.
10 Rooprai HK,Vanmeter T,Ranou C,et al.The role of integrin receptors in aspects of glioma invasion in vitro[J].Int J Dev Neurosci,1999,17(5/6):613-623.
11 郭衍,章翔,费舟,等.整合素αvβ3在脑胶质瘤的表达与肿瘤恶性程度的关系[J].肿瘤防治研究,2002,29(1):48-49.
12 谭劲赟,孟蔚韦华.胰腺癌患者血清中糖类抗原199和基质金属蛋白酶2的表达及意义[J].海南医学院学报,2011,17(9):1164-1166.
13 陶蓉,邱世超,侯成浩,等.ARK5和基质金属蛋白酶2在小细胞肺癌中的表达及其临床意义[J].中国全科医学,2013,16(2):633.
14 Yamamoto M,Mohanam S,Sawaya RE,et al.Differetial expression of membrane-type matrix metalloproteinase and its correlation with gelatinase a activation in human[J].Cancer Res,2009,56(2):389-392.
15 Sawaya RE,Yamamoto M,Gokaslan ZL,et al.Expression and localization of 72-kDa types IV collagenase(MMP-2) in human malignant gliomas in vitro[J].Clin Exp Metast,1996,14(1):35-42.
16 Lu KV,Jong KA,Rajasekaran AK,et al.Upregulation of tissue inh-ibittor of metalloproteinases(TIMP)-2 promotes matrix metalloproteinase(MMP)-2 activation and cell invasion in a human glioblastoma cell line[J].Lab Invest,2004,84(1):8-20.
17 Vince GH,Wagner S,Pietsch T,et al.Heterogeneous regional expression patterns of matrix metalloproteinases in malignant gliomas[J].Int J Dev Neurosci,1999,17(5/6):437-455.
18 蒲建章,赵洪洋.galectin-3在脑肿瘤的研究进展[J].中国微侵袭神经外科杂志,2006,11(3):142-144.
19 Brooks PC,Stromblad S,Sanders LC.Localization of matrix metalloproteinase MMP-2 to the surface of invasive cells by interaction with integrin alpha v beta 3[J].Cell,1996,85(5):683-693.
20 Ochieng J,Fridman R,Nangia-Makker P,et al.galectin-3 is a novel substrate for human matrix metalloproteinases-2 and -9[J].Biochemistry,2009,33(47):14109-14114.



