徐 慧,戴元荣,付玉茹,夏梦玲
·论著·
磷脂酰肌醇3激酶和细胞外调节蛋白激酶信号通路对支气管哮喘大鼠气管平滑肌细胞增殖的协同调控作用
徐 慧,戴元荣,付玉茹,夏梦玲
目的 探讨磷脂酰肌醇3激酶(PI3K)和细胞外调节蛋白激酶(ERK)信号通路对支气管哮喘(简称哮喘)大鼠气管平滑肌细胞(ASMC)增殖的协同调控作用。方法 6~8周龄SPF级雄性SD 大鼠,复制大鼠慢性哮喘模型,离体培养大鼠气管ASMC,将细胞分为正常组、哮喘组、转化生长因子β1(TGF-β1)组、TGF-β1+PD98059组、TGF-β1+渥曼青霉素(wortmannin)组、TGF-β1+PD98059+wortmannin组。采用CCK-8法检测各组细胞增殖情况及Western blotting法检测磷酸化蛋白激酶B(p-Akt)和磷酸化细胞外调节蛋白激酶1/2(p-ERK1/2)表达情况。结果 CCK-8法检测各组大鼠ASMC OD 值,TGF-β1组高于正常组和哮喘组,TGF-β1+ PD98059组、TGF-β1+wortmannin组和TGF-β1+PD98059+wortmannin组低于TGF-β1组,TGF-β1+ PD98059+wortmannin组低于TGF-β1+ PD98059组和TGF-β1+wortmannin组(P<0.01)。Western blotting法检测ASMC中p-Akt的表达,哮喘组高于正常组,TGF-β1组高于哮喘组,TGF-β1+wortmannin组低于TGF-β1组(P<0.01)。Western blotting法检测ASMC中p-ERK1/2的表达,哮喘组高于正常组,TGF-β1组高于哮喘组,TGF-β1+ PD98059组低于TGF-β1组(P<0.01)。结论 PI3K和ERK信号通路协同调控了TGF-β1刺激哮喘大鼠ASMC增殖过程。
哮喘;信号通路;肌细胞,平滑肌;细胞增殖;磷脂酰肌醇3-激酶类;细胞外调节蛋白激酶
徐慧,戴元荣,付玉茹,等.磷脂酰肌醇3激酶和细胞外调节蛋白激酶信号通路对支气管哮喘大鼠气管平滑肌细胞增殖的协同调控作用[J].中国全科医学,2015,18(9):1032-1036.[www.chinagp.net]
Xu H,Dai YR,Fu YR,et al.Coordinated regulation of the proliferation of airway smooth muscle cells by ERK and PI3K signal pathways in asthmatic rats [J].Chinese General Practice,2015,18(9):1032-1036.
气管重塑是支气管哮喘(简称哮喘)发病的重要环节,其中气管平滑肌细胞(airway smooth muscle cell,ASMC)的增生和肥大在气管重塑中发挥了重要作用[1]。转化生长因子β1(transforming growth factor-β1,TGF-β1)能刺激ASMC的分裂与增殖[2]。近年的研究表明,磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase,PI3K)及细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)介导的信号通路在ASMC增殖中发挥着十分重要的作用[3-4]。细胞信号通路并不都是线性化的,即不都是单纯由某一条信号通路级联传递完成的。据此,本研究以PI3K和ERK信号通路对哮喘大鼠ASMC的调控为切入点,探讨PI3K和ERK信号通路对哮喘大鼠ASMC增殖的协同调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄SPF级雄性SD大鼠30只,体质量100~120 g,购自上海实验动物中心〔合格证号:SYXK(浙)2010-0150〕。饲养于温州医科大学实验动物中心SPF级实验室,饲养温度25 ℃,相对湿度70%,昼夜照明12 h/12 h。
1.1.2 主要试剂及仪器 兔多克隆抗磷酸化蛋白激酶B(p-Akt)抗体购自美国CST公司,磷酸化细胞外调节蛋白激酶1/2(p-ERK1/2)抗体(美国abcam公司),TGF-β1购自美国PeproTech公司,25 cm2无菌培养瓶购自美国Corning公司,RPMI 1640培养基购自美国HyClone公司,Ⅰ型胶原酶购自美国Sigma公司,优级胎牛血清(FBS)购自杭州四季青生物工程材料有限公司,青链霉素和胰酶细胞消化液购自江苏碧云天生物工程有限公司,5%CO2培养箱购自美国Thermo公司,倒置显微镜购自日本尼康公司,ECL试剂盒购自Gene 公司,甘油醛-3-磷酸脱氢酶(GAPDH)抗体、异硫氰酸荧光素(FITC)标记的山羊抗小鼠的二抗购自江苏碧云天生物工程有限公司。
1.2 方法
1.2.1 哮喘大鼠模型的建立 将大鼠按照随机数字表法分为哮喘组(15只)和对照组(15只)。适应性饲养于温州医科大学实验动物中心1周后,哮喘组分别于第1天和第8天大鼠腹腔注射含1 mg卵清蛋白(OVA)和100 mg氢氧化铝〔Al(OH)3〕的混合溶液1 ml致敏,第15天开始激发,将大鼠置于自制的雾化箱内,使用超声雾化器喷入含1%OVA的0.9%氯化钠溶液8 ml,30 min/次,隔天1次,共8周;对照组致敏和激发阶段均使用0.9%氯化钠溶液。各组大鼠末次激发24 h后处死,模型制备成功后行组织切片观察气管形态。
本研究创新点:
气管重塑是支气管哮喘(简称哮喘)重要的特征,找到逆转气管重塑的靶点将为治疗哮喘开辟新的方向。然而气管重塑的机制尚未明确,气管平滑肌作为气管壁的主要结构,是哮喘气管重塑及气流受限的主要效应细胞。转化生长因子β1(TGF-β1)是导致气管重塑的重要因子,许多实验已证实其可促进细胞外基质沉积、气管平滑肌细胞增生、黏液分泌。既往研究也有探讨哮喘发病机制中相关信号传导通路,但较少同时研究两条信号通路和探讨两者之间是否存在相互作用。本实验以支气管平滑肌细胞为研究靶点,探讨TGF-β1导致气管平滑肌细胞重塑可能的机制为重点,发现其导致气管平滑肌细胞增殖与两条重要的信号通路有关,且这两条信号通路不是孤立的,而是存在交叉作用,共同调节了TGF-β1刺激引起的气管平滑肌细胞的增殖,从而导致了支气管哮喘的气管重塑。
1.2.2 肺组织苏木素-伊红(HE)染色 大鼠末次激发24 h后,经腹腔注射10%水合氯醛(500 mg/kg)麻醉大鼠,腹主动脉放血处死,迅速游离完整的心肺组织,结扎左主支气管及右中叶支气管,4%多聚甲醛溶液注入右肺下叶,结扎并游离右肺下叶,将其浸入4%多聚甲醛溶液中,24 h后石蜡包埋,做病理切片。将制备好的肺组织切片进行HE染色。
1.2.3 ASMC的培养和鉴定 利用组织块贴壁法进行ASMC培养,待细胞长满后用胰酶细胞消化液传代,取3~6代细胞进行实验。采用细胞免疫组化和透射电镜对培养的ASMC进行鉴定。
1.2.4 CCK-8(cell counting kit-8)法检测ASMC的增殖 取3~6代细胞,用含10%FBS的RPMI 1640培养基培养,将细胞调至浓度为4×103/ml的混悬液,接种于96孔板,待细胞融合后,换无血清RPMI 1640继续培养,使细胞同步于G0期,换用含10%FBS的RPMI 1640培养基培养。采用随机数字表法将细胞分为6组:正常组、哮喘组、TGF-β1组、TGF-β1+PD98059组、TGF-β1+渥曼青霉素(wortmannin)组、TGF-β1+PD98059+wortmannin组。TGF-β1+PD98059组、TGF-β1+wortmannin组和TGF-β1+PD98059+wortmannin组分别于TGF-β1干预前加入PD98059、wortmannin及PD98059+wortmannin预处理1 h。培养结束时,再于每孔中加入10 μl的CCK-8,混匀后置于5%CO2孵箱,37 ℃,培养2 h,采用酶联免疫检测仪于450 nm波长测定各孔吸光度值(OD值)。
1.2.5 Western blotting法检测ASMC中p-Akt、p-ERK1/2的表达 培养结束后,提取各组细胞总蛋白质,以BCA法进行蛋白定量。按每孔30 μg蛋白量加样进行SDS聚丙烯酰胺凝胶电泳,将分离的蛋白转膜至PVDF膜后,以5%脱脂奶粉室温封闭2 h,分别加p-Akt(1∶800)、p-ERK1/2(1∶2 000)及GAPDH抗体(1∶5 000)孵育,4 ℃过夜。TBST缓冲液洗膜后加辣根过氧化物酶标记山羊抗兔二抗(1∶1 000)及山羊抗小鼠二抗(1∶2 000),室温孵育1 h,洗膜,ECL显影。用AlphaEaseFC 4.0软件分析目的蛋白p-Akt、p-ERK1/2和内参GAPDH的OD值,以目的蛋白和内参GAPDH OD值的比值代表目的蛋白的相对含量。
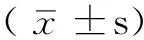
2 结果
2.1 大鼠肺组织病理学改变 大鼠肺组织HE染色观察显示,气管壁及血管周围有大量炎性细胞浸润,平滑肌层增厚,黏膜皱褶增多,支气管上皮水肿、脱落、结构紊乱,黏液腺及杯状细胞增加;对照组未见明显炎性细胞浸润、平滑肌层增厚等情况(见图1)。
2.2 ASMC的鉴定 倒置显微镜下观察可见,ASMC呈梭形,有较长的突起,细胞核位于细胞中央,细胞疏密相间,呈典型的“谷和峰”生长状态。α-actin细胞免疫化学染色可见免疫反应产物呈棕黄色,95%细胞α-actin染色阳性,透射电镜下观察可见细胞内的纵行肌丝结构(见图2)。
2.3 CCK-8法检测各组细胞增殖情况 不同组大鼠ASMC OD 值比较,差异有统计学意义(P<0.05);其中TGF-β1组高于正常组和哮喘组,TGF-β1+ PD98059组、TGF-β1+wortmannin组和TGF-β1+PD98059+wortmannin组低于TGF-β1组,TGF-β1+ PD98059+wortmannin组低于TGF-β1+ PD98059组和TGF-β1+wortmannin组,差异均有统计学意义(P<0.01,见表1)。
2.4 Western blotting法检测ASMC中p-Akt和p-ERK1/2的表达 不同组大鼠ASMC中p-Akt比较,差异有统计学意义(P<0.05);其中哮喘组高于正常组,TGF-β1组高于哮喘组,TGF-β1+wortmannin组低于TGF-β1组,差异均有统计学意义(P<0.01,见表2、图3)。
不同组大鼠ASMC中p-ERK1/2比较,差异有统计学意义(P<0.05);其中哮喘组高于正常组,TGF-β1组高于哮喘组,TGF-β1+ PD98059组低于TGF-β1组,差异均有统计学意义(P<0.01,见表3、图4)。
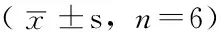
表1 各组大鼠ASMC OD 值比较
注:TGF-β1=转化生长因子β1,wortmannin=渥曼青霉素,OD值=吸光度值;与正常组比较,*P<0.01;与哮喘组比较,△P<0.01;与TGF-β1组比较,▲P<0.01;与TGF-β1+PD98059组比较,☆P<0.01;与TGF-β1+wortmannin组比较,★P<0.01
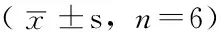
表2 各组大鼠ASMC中p-Akt比较
注:p-Akt=磷酸化蛋白激酶B;与正常组比较,*P<0.01;与哮喘组比较,△P<0.01;与TGF-β1组比较,▲P<0.01
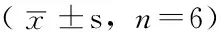
Table 3 Comparison of p-ERK1/2 in ASMC in different groups of rats

组别p-ERK1/2正常组0.43±0.09哮喘组1.34±0.13*TGF-β1组2.18±0.15△TGF-β1+PD98059组0.28±0.06▲F值175.48P值<0.01
注:p-ERK1/2=磷酸化细胞外调节蛋白激酶1/2;与正常组比较,*P<0.01;与哮喘组比较,△P<0.01;与TGF-β1组比较,▲P<0.01
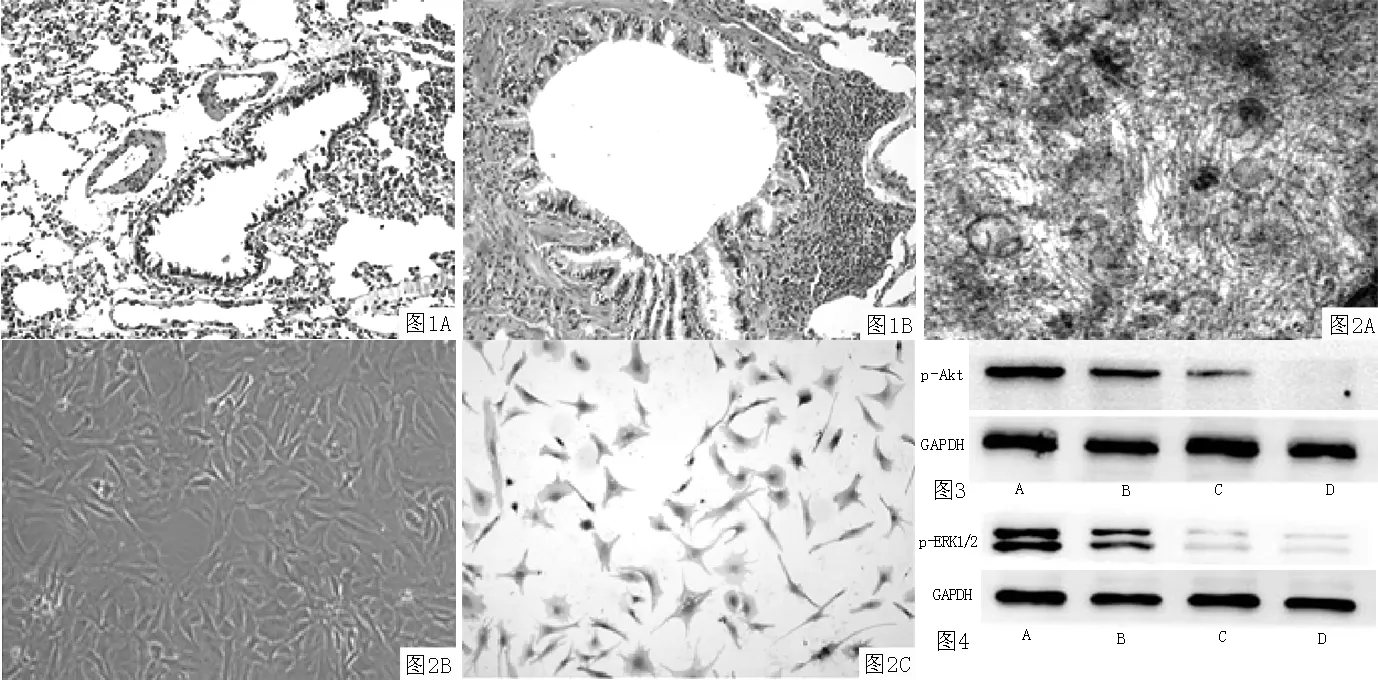
注:A为对照组,B为哮喘组
图1 大鼠肺组织病理学改变(HE染色,×400)
Figure 1 Pathological changes of lung tissues of rats
注:A透射电镜下观察(× 6 000),B倒置显微镜下观察(×100),C特异性免疫化学染色(×200);ASMC=气管平滑肌细胞
图2 ASMC的鉴定
Figure 2 Identification of ASMC
注:A为TGF-β1组,B为哮喘组,C为正常组,D为TGF-β1+wortmannin组
图3 Western blotting法检测ASMC中p-Akt的表达
Figure 3 Expression of p-Akt in ASMC by Western blotting
注:A为TGF-β1组,B为哮喘组,C为正常组,D为TGF-β1+ PD98059组
图4 Western blotting法检测ASMC中p-ERK1/2的表达
Figure 4 Expression of p-ERK1/2 in ASMC by Western blotting
3 讨论
哮喘是由多种细胞及细胞组分参与的慢性气管炎症性疾病,该疾病具有反复性、长期性和周期性的显著特点。气管重塑是其重要病理特征之一,ASMC在哮喘气管重塑的发生发展过程中发挥着重要作用[5]。TGF-β是结构相关的生长因子大家族的一员,也是人体内的主要形式,与肺部疾病的慢性进展关系最为密切。Cohell等[6]发现,哮喘患者发作期支气管肺泡灌洗液中TGF-β1水平较控制期明显增高;在中重度哮喘患者气管黏膜活检标本中,TGF-β1mRNA和TGF-β1过度表达[7],故其与气管重塑有着重要的关系[8],并且通过与受体的特异性结合来发挥作用。Ward等[9]研究指出,TGF-β1的表达水平与气管狭窄有关,是引起哮喘气管重塑的关键递质。本研究也发现,哮喘大鼠ASMC的增殖较正常大鼠明显;同时通过TGF-β1对哮喘大鼠ASMC进行刺激发现,TGF-β1组ASMC的增殖较哮喘组明显,证实了TGF-β1可以增加ASMC的增殖,进而引起气管重塑。
有研究表明,TGF-β1可能是通过ERK信号途径促进大鼠ASMC的增殖作用[10]。本研究发现,在TGF-β1刺激ASMC增殖的过程中,TGF-β1组p-ERK1/2表达高于哮喘组,提示ERK信号途径在TGF-β1刺激ASMC增殖的过程中发挥了重要作用。在加入抑制剂PD98059干预后,TGFβ1+ PD98059组ASMC增殖较TGF-β1组减少,但较哮喘组表达量仍有所增加,提示TGF-β1促进大鼠ASMC的增殖与ERK信号通路有关,PD98059能抑制上述效应,但不能使其恢复至哮喘组水平,说明TGF-β1引起的细胞增殖过程中,ERK信号通路可能不是TGF-β1引起的ASMC增殖的唯一通路。
PI3K是介导生长因子、细胞因子和炎性递质诱导ASMC增殖的另一条重要通路,Akt在P信号通路中起着关键作用[11]。Akt的底物较多,包括BAD、环磷腺苷效应元件结合蛋白(CREB)、叉头转录因子家族、IK-B激酶等,其底物的多样性说明了Akt在细胞增殖、细胞分化和细胞存活中的广泛作用。本研究发现,在TGF-β1刺激ASMC增殖的过程中,TGF-β1组p-Akt表达明显高于哮喘组,提示PI3K信号通路在TGF-β1刺激ASMC增殖的过程中发挥了重要作用。
本研究结果显示,TGF-β1刺激哮喘ASMC增殖的过程中,分别加用这两条通路的抑制剂PD98059、wortmannin,实验发现p-ERK1/2和 p-Akt的表达量明显减少,ASMC增殖减少。提示这两条通路在TGF-β1刺激哮喘ASMC增殖过程中均发挥重要作用。本研究进一步运用ERK通路抑制剂和PI3K/Akt通路抑制剂进行联合干预发现,与单独使用ERK通路抑制剂、PI3K/Akt抑制剂比较,ASMC增殖抑制更为明显,以上结果提示,PI3K信号通路和ERK信号通路对哮喘大鼠ASMC增殖可能具有协同效应,其机制可能是共同调控了ASMC增殖过程。
综上所述,TGF-β1刺激在引起的哮喘大鼠ASMC增殖过程中,PI3K和ERK信号通路均参加了对其的调控,两者之间存在交叉对话,起到了协同调控的作用。
[1]Hassan M,Jo T,Risse PA,et al.Airway smooth muscle remodeling is a dynamic process in severe long-standing asthma[J].J Allergy Clin Immunol,2010,125(5):1037-1045.
[2]Reddel CJ,Cultrone D,Rnjak-Kovacina J,et al.Tropoelastin modulates TGF-β1-induced expression of VEGF and CTGF in airway smooth muscle cells[J].Matrix Biol,2013,32(7/8):407-413.
[3]Wang J,Li F,Yang M,et al.FIZZ1 promotes airway remodeling through the PI3K/Akt signaling pathway in asthma[J].Exp Ther Med,2014,7(5):1265-1270.
[4]Tang H,Sun Y,Shi Z,et al.YKL-40 induces IL-8 expression from bronchial epithelium via MAPK(JNK and ERK) and NF-κB pathways,causing bronchial smooth muscle proliferation and migration[J].J Immunol,2013,190(1):438-446.
[5]Najafi A,Masoudi-Nejad A,Ghanei M,et al.Pathway reconstruction of airway remodeling in chronic lung diseases:a systems biology approach[J].PLoS One,2014,9(6):e100094.
[6]Cohell P,Rajah R,Rosenbloom J,et al.IGFBP23 mediates TGF-beta-1-induced cellgrowth in human airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2000,278(3):545-551.
[7]Puddicombe SM,Richter A,Richter H,et al.Increased expression of P21(waf) cyclin2 dependen kinase inhibitor in asthmatic bronchial epithelium[J].Am J Re Spir Cell Mol,2003,28(1):61-68.
[8]Yang Y,Zhang N,Lan F,et al.Transforming growth factor-beta 1 pathways in inflammatory airway diseases [J].Allergy,2014,69(6):699-707.
[9]Ward KR,Crew GM,Kenyon NJ,et al.TGF-β1causes airway fibrosis and increased collagen Ⅰ and Ⅱ mRNA in mice[J].Thorax,2003,58(9):772-777.
[10]Schuliga M,Javeed A,Harris T,et al.Transforming growth factor-β-induced differentiation of airway smooth muscle cells is inhibited by fibroblast growth factor-2[J].Am J Respir Cell Mol Biol,2013,48(3):346-353.
[11]Fang X,Li K,Tao X,et al.Effects of phosphoinositide 3-kinase on protease-induced acute and chronic lung inflammation,remodeling,and emphysema in rats[J].Chest,2013,143(4):1025-1035.
(本文编辑:陈素芳)
Coordinated Regulation of the Proliferation of Airway Smooth Muscle Cells by ERK and PI3K Signal Pathways in Asthmatic Rats
XUHui,DAIYuan-rong,FUYu-ru,etal.
DepartmentofRespiratory,theSecondAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325027,China
Objective To investigate the coordinated regulation of the proliferation of airway smooth muscle cells(ASMC) by phosphoinositide-3-kinase(PI3K)and extracellular regulated protein kinases(ERK) signal pathways in asthmatic rats.Methods SPF Sprague Dawley rats of 6 to 9 weeks old were used to establish chronic asthma model.ASMC was cultured in vitro and the cells were divided into normal group,asthma group,TGF-β1group,TGF-β1+ PD98059 group,TGF-β1+wortmannin group and TGF-β1+PD98059+wortmannin group.CCK-8 method was used to detect cell proliferation and Western blotting method was used to detect the expression of p-Akt and p-ERK1/2.Results The OD value of ASMC was determined by CCK-8 method,with the TGF-β1group and TGF-β1+PD98059+wortmannin group significantly higher than the normal and asthma group,the TGF-β1+ PD98059 group and TGF-β1+wortmannin group significantly lower than the TGF-β1group,and the TGF-β1+ PD98059+wortmannin group significantly lower than the TGF-β1+ PD98059 group and TGF-β1+wortmannin group(P<0.01).The expression level of p-Akt in ASMC was determined by Western blotting method,with the asthma group significantly higher than the normal group,the TGF-β1group significantly higher than the asthma group,and the TGF-β1+wortmannin group significantly lower than the TGF-β1group(P<0.01).The expression level of p-ERK1/2 was also determined by Western blotting method,with the asthma group significantly higher than the normal group,the TGF-β1group significantly higher than the asthma group,and the TGF-β1+ PD98059 group significantly lower than the TGF-β1group(P<0.01).Conclusion The signal pathways of PI3K and ERK may coordinately regulate the proliferation of ASMC stimulated by TGF-β1.
Asthma;Signaling pathway;Myocytes,smooth muscle;Cell proliferation;Phosphatidylinositol 3-kinase;Extracellular regulated protein kinases
浙江省自然科学基金资助项目(Y2080466);温州市科技局项目(Y20130351)
325027 浙江省温州市,温州医科大学附属第二医院呼吸科
戴元荣,325027 浙江省温州市,温州医科大学附属第二医院呼吸科;E-mail:daiyr@126.com
R 256.12
A
10.3969/j.issn.1007-9572.2015.09.012
2014-10-27;
2015-01-16)



