蔡耿喜,卢绮思,刘 情,姚广裕,陈路嘉,叶长生
作者单位:510515 广东省广州市,南方医科大学 南方医院乳腺科(蔡耿喜,姚广裕,陈路嘉,叶长生),血液科(卢绮思);佛山市第一人民医院病理科(刘情)
乳腺癌治疗相关性急性白血病九例临床分析并文献复习
蔡耿喜,卢绮思,刘 情,姚广裕,陈路嘉,叶长生
作者单位:510515 广东省广州市,南方医科大学 南方医院乳腺科(蔡耿喜,姚广裕,陈路嘉,叶长生),血液科(卢绮思);佛山市第一人民医院病理科(刘情)
【摘要】目的探讨乳腺癌治疗相关性急性白血病(t-AL)的发病特点、治疗及预后。方法报道并分析2009—2014年南方医院收治的9例乳腺癌t-AL患者的临床资料,并进行相关文献复习。结果9例患者使用了蒽环类药物,8例使用了环磷酰胺,5例接受过放疗,9例患者均使用过重组人粒细胞集落刺激因子;中位潜伏期为23个月;7例治疗后继发急性髓系白血病(t-AML)和2例治疗后继发急性淋巴细胞白血病(t-ALL);发现11q23、21q22、t(8;21)、t(15;17)等染色体平衡异位,发现AML1/ETO(+)、PML/RARα(+)、MLL(+)分子遗传学异常。8例患者接受化疗,3例患者行造血干细胞移植(HSCT)。9例患者的中位总生存时间为32个月,3年生存率为44.4%;7例患者获得完全缓解,中位无疾病生存时间为31个月;2例HSCT成功患者中位总生存时间为44个月,3年生存率为100.0%。结论乳腺癌患者接受烷化剂、蒽环类药物化疗以及放疗可发生t-AL,且以t-AML为主,常合并多种细胞遗传学及分子遗传学异常;t-AL治疗以化疗为主,HSCT治疗可改善患者预后;t-AL患者预后较差。
乳腺癌是全球女性发病率最高的恶性肿瘤,随着乳腺癌辅助治疗的进步,患者的长期生存率逐渐提高,放、化疗的远期毒副作用也随之突显出来[1]。乳腺癌治疗后继发的急性白血病被称为治疗相关性急性白血病(therapy-related acute leukemia,t-AL),t-AL在国外已有深入的研究[2],但国内多见于个案报告[3]。为了提高对t-AL的认识,现报道南方医院收治的9例t-AL患者并复习相关文献。
1病例简介
1.1基本情况2009—2014年南方医院共收治乳腺癌t-AL患者9例,所有患者从确诊乳腺癌t-AL开始电话随访,随访周期为6个月,随访至2015年4月,中位随访时间为32个月。患者均为女性,从事一般职业(职员4例、教师1例、自由职业4例),无放射性物质及有毒物质接触史,接受手术时中位年龄为38(19)岁。
1.2乳腺癌治疗情况所有患者接受手术治疗,术后病理检查明确诊断为乳腺癌。术后化疗方案有环磷酰胺(CTX)+表柔比星(EPI)+5-氟尿嘧啶(5-FU)(CEF) 、吡柔比星(THP)+多西他赛(TXT)+CTX(TAC)、紫杉醇(PTX)+THP(PT)、TXT+EPI+CTX(TEC)、TXT+CTX(TC)及曲妥珠单抗。9例患者患者使用了蒽环类药物(EPI、THP),8例患者使用了CTX,5例患者接受过放疗。所有患者在辅助治疗过程中因粒细胞缺乏使用过重组人粒细胞集落刺激因子(G-CSF)(见表1)。
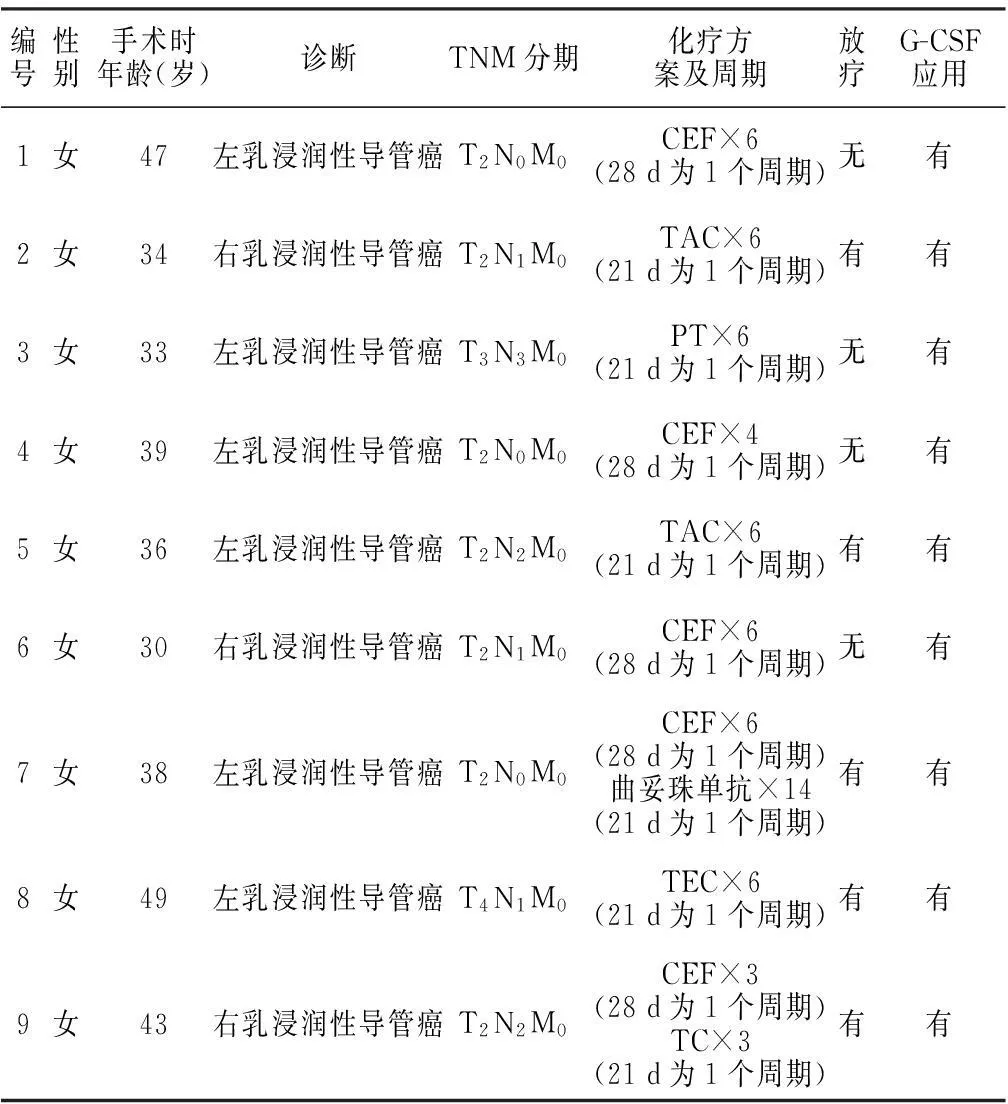
表1 乳腺癌t-AL患者的乳腺癌治疗情况
注:G-CSF=重组人粒细胞集落刺激因子,CEF=环磷酰胺(CTX)+表柔比星(EPI)+5-氟尿嘧啶(5-FU),TAC=吡柔比星(THP)+多西他赛(TXT)+CTX,PT=紫杉醇(PTX)+THP,TEC=TXT+EPI+CTX,TC=TXT+CTX
1.3乳腺癌t-AL的临床情况
1.3.1起病9例患者从开始辅助治疗至发生乳腺癌t-AL的中位时间(中位潜伏期)为23(11~71)个月。起病时表现为贫血(9例)、乏力(7例)、粒细胞计数减少(7例)、血小板计数减少(7例)、发热(6例)、白细胞计数增高(5例)等,1例白血病中枢神经系统(CNS)侵犯者出现头痛、眼斜视、视物模糊等症状。
1.3.2诊断乳腺癌t-AL诊断依据FAB分型标准[4],并完善细胞遗传学及分子遗传学检查。7例患者为乳腺癌治疗相关性急性髓系白血病(t-AML),中位潜伏期为23(20~71)个月,M2 4例,M3 1例,M5 2例。7例乳腺癌t-AML患者均合并细胞遗传学或分子遗传学异常,其中11q23异常1例、21q22异常2例、t(8;21) 2例、t(15;17) 1例,1例M5伴CNS侵犯的患者为复杂核型,AML1/ETO(+) 3例、PML/RARα(+) 2例、MLL(+) 2例。2例患者为乳腺癌治疗相关性急性淋巴细胞白血病(t-ALL),潜伏期分别为26个月和11个月,1例存在t(1;11)(P32;q23)及MLL(+),另1例仅有染色体数目异常。所有患者未发现5号、7号染色体异常。
1.3.3治疗除1例患者入院后死亡未行化疗,其余患者均给予常规诱导缓解以及挽救治疗方案,有条件者行造血干细胞移植(HSCT)治疗。
1.3.4结局7例乳腺癌t-AML患者5例达到完全缓解(CR),1例CR后行HSCT治疗,目前无疾病生存(disease free survival,DFS)时间为51个月;1例CR后未行HSCT治疗,目前DFS时间为47个月;其余3例CR后未行HSCT治疗,均因急性髓系白血病(AML)复发死亡;2例未达到CR的患者,1例入院后全身出血死亡,另1例行HSCT治疗过程中发生脑疝而死亡。1例乳腺癌t-ALL患者CR后行HSCT治疗,目前DFS时间为29个月;另1例乳腺癌t-ALL患者巩固治疗后因乳腺癌复发死亡(见表2)。
2讨论
2.1乳腺癌t-AL的发生率Renella等[5]随访6 360例乳腺癌患者6.6年后发现,接受化疗的乳腺癌患者发生AML的总风险为0.2%,是普通人群的3.5倍;Patt等[6]随访64 715例乳腺癌患者后发现,接受辅助化疗和未接受辅助化疗的患者10年发生AML的绝对风险分别为1.8%和1.2%,风险比率(hazard ratio,HR)为1.53。t-AL以t-AML多见,t-ALL较少见。Howard等[7]统计了376 825例乳腺癌患者,中位随访时间为8.9年,共有363例乳腺癌t-AML患者、48例乳腺癌t-ALL患者,乳腺癌t-AML患者数量是乳腺癌t-ALL患者的7.6倍。
2.2t-AML的分类2002年WHO髓系肿瘤分类[8]将t-AML大致分为2类。一类主要由烷化剂(如CTX)或放疗引起,潜伏期较长(中位时间为4~7年),主要类型是M1/M2,2/3患者前期有骨髓增生异常,常有5号、7号染色体异常。另一类由DNA拓扑异构酶Ⅱ抑制剂(如蒽环类药物)引起,潜伏期较短(中位时间为2~3年),主要类型为M4/M5,前期没有骨髓增生异常,常有11q23、21q22、t(8;21)、t(15;17)、inv(16)等染色体平衡异位。
2.3发生乳腺癌t-AL的危险因素CTX和蒽环类药物被广泛应用于乳腺癌的术后化疗,许多临床研究证实,其可增加乳腺癌t-AL的发生率,且化疗药物剂量与乳腺癌t-AL发生率直接相关[9-10]。Praga等[9]报道7 110例乳腺癌患者接受包含EPI和CTX的辅助化疗,中位随访时间为8年,EPI累计剂量为300 mg/m2时乳腺癌t-AML/骨髓异常增生综合征(MDS)发生率仅为0.07%,当累计剂量达到900 mg/m2时乳腺癌t-AML/MDS发生率升高至9.94%;CTX累计剂量为3 000 mg/m2时乳腺癌t-AML/MDS发生率仅为0.08%,当累计剂量达到9 000 mg/m2时乳腺癌t-AML/MDS发生率升高至0.98%。Curtis等[10]也证明,随着CTX累计剂量的增加,t-AL的发生风险也随之升高。采用大剂量化疗方案可提高乳腺癌患者的DFS时间及OS时间[11],但同时也应考虑到t-AL的发生风险。
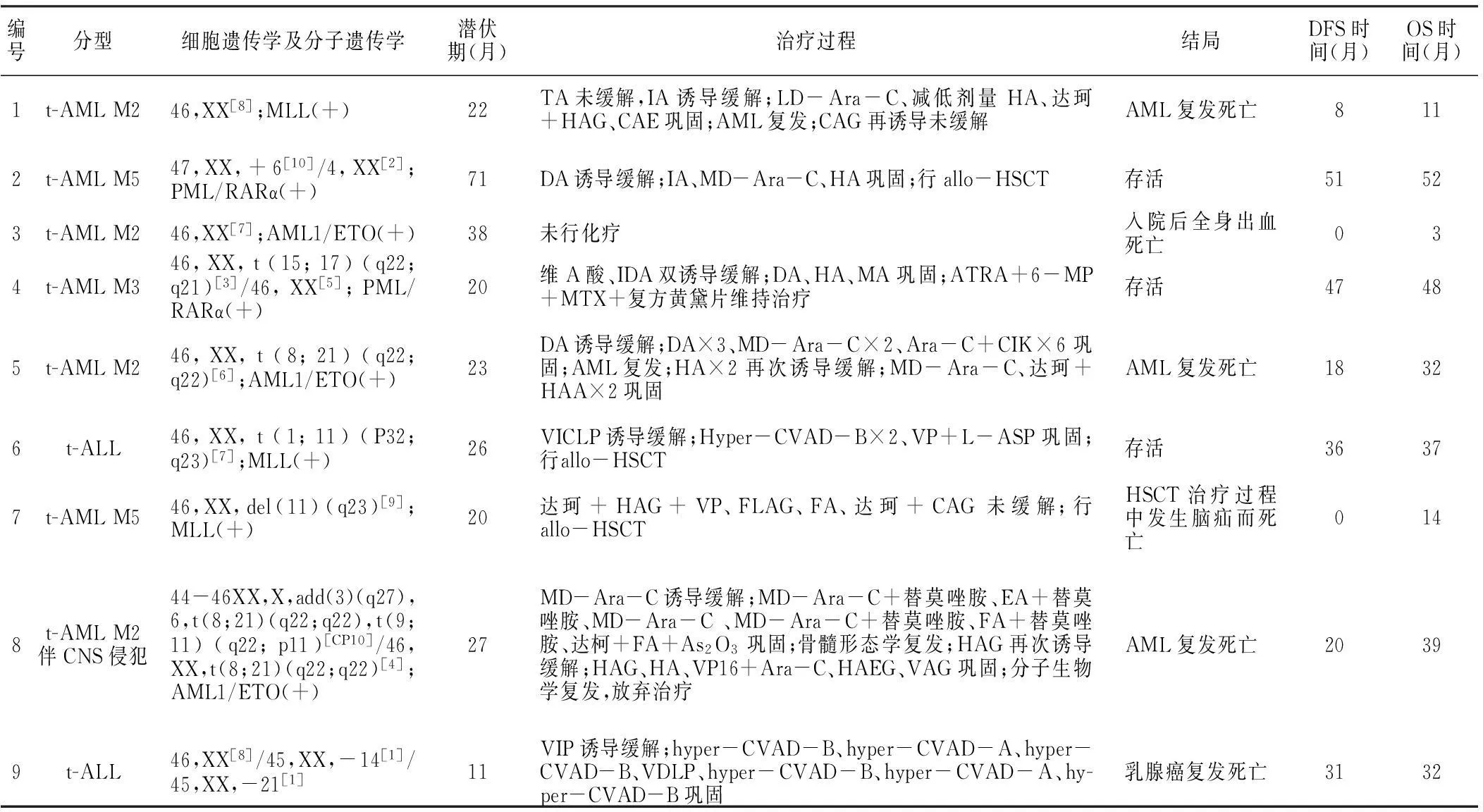
表2 乳腺癌t-AL患者乳腺癌治疗后的临床情况
注:DFS=无疾病生存,OS=总生存,t-AML=治疗相关性急性髓系白血病,TA=吡柔比星(THP)+阿糖胞苷(Ara-C),IA=去甲氧柔红霉素(IDA)+Ara-C,LD-Ara-C=低剂量阿糖胞苷,HA=高三尖杉酯碱(HHT)+Ara-C,达珂=注射用地西他滨,HAG=HHT+Ara-C+重组人粒细胞集落刺激因子(G-CSF),CAE=环磷酰胺(CTX)+Ara-C+依托泊苷(VP16),AML=急性髓系白血病,CAG=阿克拉霉素(Acla)+Ara-C+G-CSF,DA=柔红霉素(DNR)+Ara-C,MD-Ara-C=中剂量阿糖胞苷,allo-HSCT=异基因造血干细胞移植,MA=米托蒽醌(Mit)+Ara-C,ATRA=全反式维甲酸,6-MP=6-巯基嘌呤,MTX=甲氨蝶呤,CIK=细胞因子诱导的杀伤细胞,HAA=HHT+Acla+Ara-C,t-ALL=治疗相关性急性淋巴细胞白血病,VICLP=长春地辛(VDS)+去甲氧柔红霉素(IDA)+左旋门冬酰胺酶(L-ASP)+泼尼松(Pred),Hyper-CVAD-B=MTX+Ara-C,VP=VDS+Pred,L-ASP=左旋门冬酰胺酶,FLAG=氟达拉宾(Flu)+Ara-C+G-CSF,FA=Flu+Ara-C,CNS=中枢神经系统,EA=VP16+Ara-C,As2O3=三氧化二砷,HAEG=HHT+Ara-C+VP16+G-CSF,VAG=VP16+Ara-C+G-CSF,VIP=长春新碱(VCR)+IDA+Pred,hyper-CVAD-A=CTX+VCR+表阿霉素(E-ADM)+地塞米松(DEX),VDLP=VCR+DNR+L-ASP+Pred
本研究报道的9例乳腺癌t-AL患者中,1例同时使用蒽环类药物和CTX的患者潜伏期接近6年,其余8例患者的潜伏期为1~3年,其中7例同时使用蒽环类药物和CTX、1例只使用蒽环类药物而未使用CTX。9例乳腺癌t-AL患者皆未发现5号、7号染色体异常,但有5例发生11q23、21q22、t(8;21)、t(15;17)等染色体异常。因此推测,蒽环类药物对于乳腺癌t-AL的影响效力比CTX大。
放疗也可明显增加乳腺癌t-AL的发生率,与化疗药物联用时治疗乳腺癌t-AL的效果更明显[5,10]。Curtis等[10]报道,单独局部放疗导致乳腺癌t-AL的相对危险度(relative risk,RR)为2.4,单独使用烷化剂时RR为10.0,而两者联用时RR为17.4。Renella等[5]的研究也得出类似结果,仅接受放疗的乳腺癌患者发生乳腺癌t-AL的HR为4.0,联合使用化疗和放疗时HR为7.2。但目前尚未见文献报道乳腺癌t-AL与放疗剂量之间的关系。
目前无研究证明紫杉醇类药物可增加乳腺癌t-AL的发生率。一项比较FEC(5-FU+EPI+CTX)与FEC-D(FEC序贯TXT)化疗方案的研究结果显示,随访5年后,FEC组(966例患者)有3例发生乳腺癌t-AL,而FEC-D组(1 003例患者)只有1例发生乳腺癌t-AL[12]。另一项比较AC(多柔比星+CTX)和TC(TXT+CTX)化疗方案的研究,随访7年后,AC组(510例患者)有2例发生乳腺癌t-AL,TC组(506例患者)没有发生乳腺癌t-AL[13]。
G-CSF被用于缩短乳腺癌患者化疗后的骨髓抑制期,预防败血症的发生,但G-CSF对乳腺癌t-AL的影响目前尚未明确。Le Deley等[14]研究表明,使用G-CSF的患者发生乳腺癌t-AML/MDS的风险为单纯化疗者的6.3倍;Hershman等[15]报道,G-CSF的应用使乳腺癌t-AML/MDS的发生率比单纯化疗者增加了1倍。但另外一些研究却未能发现G-CSF与乳腺癌t-AML/MDS有关[6,16]。
2.4乳腺癌t-AL的预后乳腺癌t-AL的预后比原发AL差[17-19]。Smith等[17]随访306例乳腺癌t-AML/MDS患者的中位OS时间为8个月,5年生存率为10%。Takeyama等[18]分析256例乳腺癌t-AML/MDS患者,有85例(46%)获得CR,中位DFS时间、OS时间分别为8.2个月和9.7个月,预后不良因素包括5号染色体异常、低蛋白血症、C反应蛋白水平升高、血小板计数减少及原发肿瘤持续存在。Abdulwahab等[19]报道23例乳腺癌t-ALL患者,中位OS时间为13.6个月,3年OS率为37.6%,而CR患者的中位DFS时间为27个月,3年DFS率为37.1%。本研究报道的9例乳腺癌t-AL患者的中位OS时间为32个月,3年OS率为44.4%;有7例(77.8%)患者达到CR,中位DFS时间为31个月。
染色体核型对乳腺癌t-AML患者预后有重要意义[20]。Kern等[20]对比分析了121例乳腺癌t-AML患者和1 511例原发性AML患者,将染色体分为低危、中危、高危核型,发现乳腺癌t-AML患者高危核型比例为48%,而原发性AML患者仅为20%,乳腺癌t-AML高危、中危、低危核型患者中位OS时间分别为6、12、12个月,而原发性AML患者分别为7、16、>60个月。本研究报道的7例乳腺癌t-AML患者,4例高危核型患者的中位OS时间为26.5个月;2例中危核型患者的中位OS时间为40个月;而1例低危核型患者入院即因全身出血死亡。
HSCT治疗可显著改善乳腺癌t-AL患者的预后[21]。Yokoyama等[21]发现,接受HSCT治疗的乳腺癌t-AML患者的3年OS率为71%,而未接受HSCT治疗者3年OS率仅为31%。本研究报道的2例HSCT治疗成功的乳腺癌t-AL患者中位OS时间为44个月,3年OS率为100.0%;7例未行HSCT治疗及HSCT治疗失败的乳腺癌t-AL患者中位OS时间为32个月,3年OS率为28.6%;4例高危核型乳腺癌t-AML患者中,仅1例行HSCT治疗成功者存活至今。
本研究仅纳入9例乳腺癌t-AL患者,样本数量较少,且随访时间较短,因此对乳腺癌t-AL的认识存在局限性,今后将继续对存活的乳腺癌t-AL患者进行随访和进一步的研究。
综上所述,乳腺癌放、化疗可发生t-AL,需严格把握放、化疗适应证及化疗药物的剂量。乳腺癌患者辅助化疗结束后,如无明显原因出现贫血、血小板计数减少及白细胞计数增高,需警惕乳腺癌t-AL的发生。在乳腺癌t-AL的治疗上,应综合考虑患者的临床情况,遵循个体化治疗原则制定合适的治疗方案。由于乳腺癌t-AL发病率较低,建议今后多中心合作对乳腺癌t-AL进行更深入的研究。
作者贡献:蔡耿喜、卢绮思、刘情负责病例资料收集整理、撰写论文,并对文章负责;姚广裕、陈路嘉、叶长生对病例资料及文章内容进行审校。
本文无利益冲突。
参考文献
[1]Kaplan H,Malmgren J,De Roos AJ.Risk of myelodysplastic syndrome and acute myeloid leukemia post radiation treatment for breast cancer:a population-based study[J].Breast Cancer Res Treat,2013,137(3):863-867.
[2]Morton LM,Dores GM,Tucker MA,et al.Evolving risk of therapy-related acute myeloid leukemia following cancer chemotherapy among adults in the United States,1975—2008[J].Blood,2013,121(15):2996-3004.
[3]张斌,张霞,孙亮新,等.乳腺癌化疗后继发淋巴瘤细胞白血病一例及文献复习[J].中华乳腺病杂志:电子版,2012,6(4):461-465.
[4]Bennett JM,Catovsky D,Daniel MT,et al.Proposals for the classification of the acute leukaemias.French-American-British (FAB) co-operative group[J].Br J Haematol,1976,33(4):451-458.
[5]Renella R,Verkooijen HM,Fioretta G,et al.Increased risk of acute myeloid leukaemia after treatment for breast cancer[J].Breast,2006,15(5):614-619.
[6]Patt DA,Duan Z,Fang S,et al.Acute myeloid leukemia after adjuvant breast cancer therapy in older women:understanding risk[J].J Clin Oncol,2007,25(25):3871-3876.
[7]Howard RA,Gilbert ES,Chen BE,et al.Leukemia following breast cancer:an international population-based study of 376,825 women[J].Breast Cancer Res Treat,2007,105(3):359-368.
[8]Vardiman JW,Harris NL,Brunning RD.The World Health Organization (WHO) classification of the myeloid neoplasms[J].Blood,2002,100(7):2292-2302.
[9]Praga C,Bergh J,Bliss J,et al.Risk of acute myeloid leukemia and myelodysplastic syndrome in trials of adjuvant epirubicin for early breast cancer:correlation with doses of epirubicin and cyclophosphamide[J].J Clin Oncol,2005,23(18):4179-4191.
[10]Curtis RE,Boice JD Jr,Stovall M,et al.Risk of leukemia after chemotherapy and radiation treatment for breast cancer[J].N Engl J Med,1992,326(26):1745-1751.
[11]Zhang Y,Li M,Zhao L,et al.Analysis of adjuvant chemotherapy effect between different dose of epirubicin for breast cancer[J].Chinese Journal of Cancer Prevention and Treatment,2014,21(15):1168-1173.(in Chinese)
张彦,李曼,赵璐,等.乳腺癌不同剂量表柔比星联合辅助化疗的疗效分析[J].中华肿瘤防治杂志,2014,21(15):1168-1173.
[12]Roché H,Fumoleau P,Spielmann M,et al.Sequential adjuvant epirubicin-based and docetaxel chemotherapy for node-positive breast cancer patients:the FNCLCC PACS 01 Trial[J].J Clin Oncol,2006,24(36):5664-5671.
[13]Jones S,Holmes FA,O′Shaughnessy J,et al.Docetaxel with cyclophosphamide is associated with an overall survival benefit compared with doxorubicin and cyclophosphamide:7-year follow-up of US Oncology Research Trial 9735[J].J Clin Oncol,2009,27(8):1177-1183.
[14]Le Deley MC,Suzan F,Cutuli B,et al.Anthracyclines,mitoxantrone,radiotherapy,and granulocyte colony-stimulating factor:risk factors for leukemia and myelodysplastic syndrome after breast cancer[J].J Clin Oncol,2007,25(3):292-300.
[15]Hershman D,Neugut AI,Jacobson JS,et al.Acute myeloid leukemia or myelodysplastic syndrome following use of granulocyte colony-stimulating factors during breast cancer adjuvant chemotherapy[J].J Natl Cancer Inst,2007,99(3):196-205.
[16]Citron ML,Berry DA,Cirrincione C,et al.Randomized trial of dose-dense versus conventionally scheduled and sequential versus concurrent combination chemotherapy as postoperative adjuvant treatment of node-positive primary breast cancer:first report of Intergroup Trial C9741/Cancer and Leukemia Group B Trial 9741[J].J Clin Oncol,2003,21(8):1431-1439.
[17]Smith SM,Le Beau MM,Huo D,et al.Clinical-cytogenetic associations in 306 patients with therapy-related myelodysplasia and myeloid leukemia:the University of Chicago series[J].Blood,2003,102(1):43-52.
[18]Takeyama K,Seto M,Uike N,et al.Therapy-related leukemia and myelodysplastic syndrome:a large-scale Japanese study of clinical and cytogenetic features as well as prognostic factors[J].Int J Hematol,2000,71(2):144-152.
[19]Abdulwahab A,Sykes J,Kamel-Reid S,et al.Therapy-related acute lymphoblastic leukemia is more frequent than previously recognized and has a poor prognosis[J].Cancer,2012,118(16):3962-3967.
[20]Kern W,Haferlach T,Schnittger S,et al.Prognosis in therapy-related acute myeloid leukemia and impact of karyotype[J].J Clin Oncol,2004,22(12):2510-2511.
[21]Yokoyama H,Mori S,Kobayashi Y,et al.Hematopoietic stem cell transplantation for therapy-related myelodysplastic syndrome and acute leukemia:a single-center analysis of 47 patients[J].Int J Hematol,2010,92(2):334-341.
(本文编辑:崔丽红)
【关键词】乳腺肿瘤;放化疗,辅助;急性白血病
蔡耿喜,卢绮思,刘情,等.乳腺癌治疗相关性急性白血病九例临床分析并文献复习[J].中国全科医学,2016,19(6):710-714.[www.chinagp.net]
Cai GX,Lu QS,Liu Q,et al.Breast cancer therapy-related acute leukemia:clinical study of 9 cases and literature review[J].Chinese General Practice,2016,19(6):710-714.
Breast Cancer Therapy-related Acute Leukemia:Clinical Study of 9 Cases and Literature ReviewCAIGeng-xi,LUQi-si,LIUQing,etal.DepartmentofBreastSurgery,SouthernMedicalUniversity,NanfangHospital,Guangzhou510515,China
【Abstract】ObjectiveTo explore the clinical characteristics,treatment and prognosis of patients with breast cancer t-AL.MethodsReported 9 cases of breast cancer t-AL and conducted a literatures review.Results9 patients had used anthracyclines,8 cases had used cyclophosphamide,and 5 patients had received radiotherapy.All patients had used granulocyte colony-stimulating factor.The median incubation period was 23 months.There were 7 cases of therapy-related acute myeloid leukemia(t-AML) and 2 cases of therapy-related acute lymphoblastic leukemia(t-ALL).Balanced traslocations like 11q23,21q22,t (8;21) and t (15;17) were identified.Molecular cytogenetic abnormalities including AML1/ETO(+),PML/RARα(+) and MLL(+) were found.8 patients received chemotherapy,and 3 patients underwent hematopoietic stem cell transplantation (HSCT).The median survival time of these 9 patients was 32 months,and 3-year-survival rate was 44.4%.7 patients achieved complete remission,and the median disease-free survival time was 31 months.The median survival time of 2 patients who succeeded in transplant was 44 months,and the 3-year-survival rate was 100.0%. ConclusionThe use of anthracyclines,alkylating agents and radiotherapy on breast cancer patients can lead to t-AL which is mainly t-AML and often combined with various kinds of molecular cytogenetic abnormalities.Chemotherapy is the main treatment.HSCT can improve the survival of t-AL.The prognosis of t-AL patients is poor.
【Key words】Breast neoplasms;Chemoradiotherapy,adjuvant;Acute leukemia
(收稿日期:2015-06-18;修回日期:2015-12-28)
【中图分类号】R 733.71
【文献标识码】B
doi:10.3969/j.issn.1007-9572.2016.06.018
通信作者:叶长生,510515 广东省广州市,南方医科大学 南方医院乳腺科;E-mail:yechsh2006@126.com
·临床诊疗提示·



