张 涛,葛成群
·论著·
肺结核患者髓源性抑制细胞水平变化及其对T淋巴细胞增殖的影响研究
张 涛,葛成群
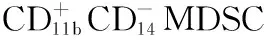
结核,肺;结核分枝杆菌;髓源性抑制细胞;精氨酸;一氧化氮
张涛,葛成群.肺结核患者髓源性抑制细胞水平变化及其对T淋巴细胞增殖的影响研究[J].中国全科医学,2016,19(35):4359-4363.[www.chinagp.net]
ZHANG T,GE C Q.Level changes of myeloid-derived suppressor cell and its effect on the proliferation of T lymphocytes among patients with pulmonary tuberculosis[J].Chinese General Practice,2016,19(35):4359-4363.
肺结核(pulmonary tuberculosis,PTB)是由结核分枝杆菌(mycobacterium tuberculosis,MTB)引起的慢性传染病,MTB可侵及多个脏器,以肺部最为常见。MTB逃脱宿主的免疫防御机制以及对药物的抗药性是治疗结核病的主要障碍,使得结核病已成为全球发病率和病死率较高的传染病之一[1]。因此,深入研究PTB发病机制,寻找和研发针对PTB的靶向治疗药物是当前亟须解决的问题。

1 对象与方法
1.1 研究对象 选取2011年1月—2014年1月于临沂市人民医院诊断为活动性PTB患者30例,其中男19例,女11例;年龄18~65岁,平均年龄(47.4±11.5)岁。患者经MTB指示培养基痰液培养呈阳性,并经聚合酶链式反应(PCR)确认。选取痰液涂片镜检MTB阳性和结核菌素皮肤试验阳性(TST+)的活动性PTB患者家属,即接触PTB患者12例,其中男8例,女4例;年龄22~70岁,平均年龄(46.5±13.0)岁。选取同期经本院结核内科检查为非结核病的健康对照者15例,其中男7例,女8例;年龄21~68岁,平均年龄(45.5±9.6)岁。选取同期本院痰液涂片镜检MTB阴性的肺部感染疾病患者7例,其中男5例,女2例;年龄28~65岁,平均年龄(46.0±10.5)岁。受试者均未接受过免疫抑制治疗。受试者均签署知情同意书,本研究经本院伦理委员会批准。
1.2 治疗 活动性PTB患者和接触PTB患者经异烟肼、利福平、吡嗪酰胺和乙胺丁醇治疗2个月,再经异烟肼和利福平单独治疗4个月。痰液涂片镜检呈阴性者为治愈,观察1年后未复发者为康复。
1.3 方法
1.3.1 试剂 CD11b、CD14、CD15、CD33、CD3抗体购自英国Abcam公司;丝裂霉素C、HLA-DR抗体购自美国Sigma公司。
1.3.2 外周血单核细胞(PBMC)和支气管肺泡细胞(BALC)的制备 参照文献[12],取活动性PTB患者、接触PTB患者和健康对照者外周血,采用葡聚糖密度梯度离心法分离制备PBMC;缓慢滴入0.9%氯化钠溶液至活动性PTB患者、肺部感染疾病患者肺部,收集支气管肺泡灌洗液,用Sputasol痰消化液(OXOID,英国)室温处理15 min后再经100 μm细胞滤网过滤,分离制备BALC。
1.3.3 流式细胞术 PBMC和BALC经FACSFlow平衡缓冲液重悬吹打混匀后,加入荧光素标记的单克隆抗体CD11b、CD14、CD15、CD33、CD3和HLA-DR,4 ℃孵育30 min。磷酸盐缓冲液(PBS)洗涤3次,PBMC用1%多聚甲醛溶液固定,BALC用4%多聚甲醛溶液固定,再重悬于FACSFlow平衡缓冲液中,立即运用流式细胞仪(FACS CANTO Ⅱ,美国)进行流式分选。每个样本以4.5×105个细胞上流式细胞仪,采用CellQuest流式分析软件进行细胞分类,记录MDSC在PBMC和BALC中的比例。按上述方法再次对治疗结束的活动性PTB患者、治愈PTB患者和康复PTB患者检测MDSC在PBMC中的比例。
1.3.4 MDSC形态学观察 收集部分细胞悬液,按照细胞离心涂片机(Shandon Cytospin 4,美国)说明书制备细胞涂片,500×g离心5 min。制备的细胞涂片经HE染色后在显微镜下观察和拍照。

1.3.6 高效液相色谱法(HPLC)检测L-精氨酸、NO、鸟氨酸水平 取活动性PTB患者和健康对照者血样本以12 300×g离心15 min,去除杂质,收集血清,加入内标物缬氨酸和肌氨酸,吹打混匀制成血清悬液。通过10 K超滤管(0.5 ml,Millipore,美国)进行超滤浓缩去除蛋白,收集浓缩液,运用1200自动进样器加入邻苯二甲醛(OPA)和9-芴甲氧羰酰氯(FMOC)进行衍生化作用。参照文献[13],以标准氨基酸混合物作为OPA衍生物和次级氨基酸混合物作为FMOC衍生物注射进入反相柱,标准氨基酸在激发波长为230 nm,发射波长为455 nm处检测;次级氨基酸在激发波长为266 nm,发射波长为310 nm处检测。运用1200系列高效液相色谱仪(安捷伦科技有限公司)进行分离和测定荧光强度。
1.4 统计学方法 采用SPSS 17.0软件进行统计学分析,非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验。以P<0.05为差异有统计学意义,多重比较调整检验水准为0.05/比较次数。
2 结果
2.1 不同受试者MDSC比例比较 活动性PTB患者、接触PTB患者、健康对照者PBMC中MDSC比例分别为0.338(0.274,0.399)、0.115(0.073,0.201)和0.042(0.031,0.103),不同受试者PBMC中MDSC比例比较,差异有统计学意义(H=16.450,P<0.001);其中活动性PTB患者PBMC中MDSC比例高于接触PTB患者、健康对照者,差异有统计学意义(P<0.001);接触PTB患者PBMC中MDSC比例与健康对照者比较,差异无统计学意义(P=0.374)。活动性PTB患者BALC中MDSC比例为0.425(0.219,0.483),高于肺部感染疾病患者的0.031(0.011,0.100),差异有统计学意义(Z=9.675,P=0.004)。光学显微镜下,MDSC呈规则的圆形或椭圆形(见图1,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章附件)。

图1 光学显微镜下MDSC形态(HE染色,×40)
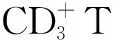
2.3 血清L-精氨酸、NO、鸟氨酸水平比较 活动性PTB患者血清L-精氨酸水平为31.72(18.37,59.58)μmol/L,低于健康对照者的57.88(35.11,77.93)μmol/L,差异有统计学意义(Z=9.030,P=0.008)。活动性PTB患者血清NO水平为63.54(51.83,81.33)μmol/L,高于健康对照者的30.31(28.19,40.28)μmol/L,差异有统计学意义(Z=10.033,P=0.004)。活动性PTB患者、健康对照者血清鸟氨酸水平分别为47.76(30.72,82.58)μmol/L、52.47(34.32,58.96)μmol/L,差异无统计学意义(Z=0.288,P=0.874)。
2.4 抗PTB治疗与MDSC的关系 活动性PTB患者治愈10例,康复5例。治疗结束时治愈PTB患者PBMC中MDSC比例为0.024(0.008,0.0389),低于活动性PTB患者治疗期间PBMC中MDSC的比例0.323(0.264,0.388),差异有统计学意义(Z=18.880,P<0.001)。康复PTB患者PBMC中MDSC比例为0.034(0.018,0.039),低于其治疗结束时PBMC中MDSC的比例0.053(0.017,0.084),差异有统计学意义(Z=11.125,P=0.004)。
3 讨论
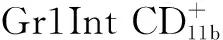
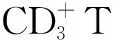
既往研究发现,MTB感染部位的MTB特异性T淋巴细胞的数量是周围未感染部位的10倍[14]。胸膜液中的MDSC显著增加[11],而本研究发现BLAC中MDSC比例升高,提示MDSC对MTB感染引起的炎性反应产生免疫应答,从而发挥免疫调节功能。
综上所述,活动性PTB患者MDSC比例增加,治愈及康复者MDSC比例下降;MDSC可抑制T淋巴细胞增殖,其机制可能与激活NO信号通路有关。MDSC在MTB传染性疾病中发挥重要的免疫调节作用,通过增强MDSC的免疫调节活性有望成为MTB感染性疾病新的治疗手段。但是,MDSC在PTB发病过程中的作用仍不完全清楚。因此,深入了解MDSC在PTB中的作用,为诊断和治疗PTB提供新的思路。
作者贡献:张涛进行课题设计、评估、质量控制及审校,并对文章负责;葛成群进行课题实施、评估、资料收集整理、成文。
本文无利益冲突。
[1]GUPTA A,KAUL A,TSOLAKI A G,et al.Mycobacterium tuberculosis:immune evasion,latency and reactivation[J].Immunobiology,2012,217(3):363-374.
[2]RICH E A,TORRES M,SADA E,et al.Mycobacterium tuberculosis(MTB)-stimulated production of nitric oxide by human alveolar macrophages and relationship of nitric oxide production to growth inhibition of MTB[J].Tuber Lung Dis,1997,78(5/6):247-255.
[3]HERZMANN C,ERNST M,EHLERS S,et al.Increased frequencies of pulmonary regulatory T-cells in latent Mycobacterium tuberculosis infection[J].Eur Respir J,2012,40(6):1450-1457.
[4]YOUNG M R,NEWBY M,WEPSIC H T.Hematopoiesis and suppressor bone marrow cells in mice bearing large metastatic lewis lung carcinoma tumors[J].Cancer Res,1987,47(1):100-105.
[5]GRETEN T F,MANNS M P,KORANGY F.Myeloid derived suppressor cells in human diseases[J].Int Immunopharmacol,2011,11(7):802-807.
[6]OCHOA A C,ZEA A H,HERNANDEZ C,et al.Arginase,prostaglandin and myeloid derived suppressor cells in renal cell carcinoma[J].Clin Cancer Res,2007,13(2 Pt 2):721s-726.
[7]ALMAND B,CLARK J I,NIKITINA E,et al.Increase production of immature myeloid cells in cancer patients: a machanism of immunosuppression in cancer[J].J Immunol,2001,166(1):678-689.
[8]BRONTE V,ZANOVELLO P.Regulation of immune responses by L-arginine metabolism[J].Nat Rev Immunol,2005,5(8):641-654.
[9]YANG B,WANG X,JIANG J,et al.Identification of CD244-expressing myeloid-derived suppressor cells in patients with active tuberculosis[J].Immunol Lett,2014,158(1/2):66-72.
[11]DU PLESSIS N,LOEBENBERG L,KRIEL M,et al.Increased frequency of myeloid-derived suppressor cells during active tuberculosis and after recent mycobacterium tuberculosis infection suppresses T-cell function[J].Am J Respir Crit Care Med,2013,188(6):724-732.
[12]EL DAKER S,SACCHI A,MONTESANO C,et al.An abnormal phenotype of lung Vγ9Vδ2 T cells impairs their responsiveness in tuberculosis patients[J].Cell Immunol,2013,282(2):106-112.
[13]SCHUSTER R.Determination of amino acids in biological,pharmaceutical,plant and food samples by automated precolumn derivatization and high performance liquid chromatography[J].J Chromatogr,1998,43(2):271-284.
[14]CHIACCHIO T,PETRUCCIOLI E,VANINI V,et al.Higher frequency of T cell response to M.tuberculosis latency antigen Rv2628 at the site of active tuberculosis disease than in peripheral blood[J].PLoS One,2011,6(11):e27539.
(本文编辑:吴立波)
Level Changes of Myeloid-derived Suppressor Cell and Its Effect on the Proliferation of T Lymphocytes among Patients with Pulmonary Tuberculosis
ZHANGTao,GECheng-qun.
DepartmentofInternalMedicineTuberculosis,LinyiPeople′sHospital,Linyi276034,China
Correspondingauthor:ZHANGTao,DepartmentofInternalMedicineTuberculosis,LinyiPeople′sHospital,Linyi276034,China;E-mail:iamzhangtao1977@163.com
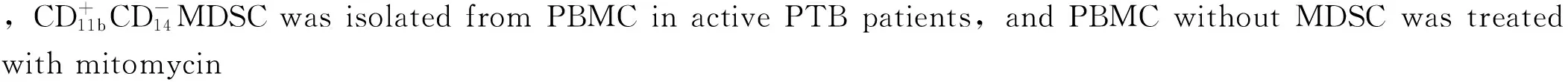
Tuberculosis,pulmonary;Mycobacterium tuberculosis;MDSC;Arginine;Nitric oxide
276034山东省临沂市人民医院结核内科
张涛,276034山东省临沂市人民医院结核内科;E-mail:iamzhangtao1977@163.com
R 521
A
10.3969/j.issn.1007-9572.2016.35.014
2016-03-10;
2016-10-09)



