林 璐,金 楠,谷伟军,杨丽娟,臧 丽,杜 锦,陈 康,郭清华, 王先令,杨国庆,吕朝晖*,窦京涛,巴建明,母义明
·临床诊疗提示·
肾上腺醛固酮-皮质醇共分泌瘤七例临床分析
林 璐1,2,金 楠1,谷伟军1,杨丽娟1,臧 丽1,杜 锦1,陈 康1,郭清华1, 王先令1,杨国庆1,吕朝晖1*,窦京涛1,巴建明1,母义明1
目的 回顾性分析7例肾上腺醛固酮-皮质醇共分泌瘤(A/CPA)患者的临床特点,并进行相关文献复习,以提高对该病的认识和诊疗水平。方法 回顾性收集2010—2016年中国人民解放军总医院收治的7例A/CPA患者的临床资料。总结并分析A/CPA患者的一般情况、一般资料、治疗及随访情况。结果 7例A/CPA患者中男1例,女6例;平均就诊年龄(49.1±12.8)岁;体质指数21.5~28.5 kg/m2;平均肾上腺肿瘤最大直径(3.4±1.6)cm。7例患者均进行血浆醛固酮水平与血浆肾素活性比值(ARR)测定,且均≥25;卡托普利试验和/或生理盐水输注试验结果支持PA诊断。所有患者无典型库欣综合征临床表现,血清皮质醇昼夜节律紊乱,过夜1 mg地塞米松抑制试验或经典小剂量地塞米松抑制试验结果支持亚临床库欣综合征诊断。6例患者术后病理提示为肾上腺皮质腺瘤。术后2例患者出现乏力、食欲不振,其中患者1复查血浆醛固酮水平、血清皮质醇水平明显降低,予泼尼松替代治疗5个月。结论 对于肾上腺肿瘤直径>2.0 cm的APA患者,需警惕合并亚临床库欣综合征的可能。术前应完善相关内分泌激素水平测定以明确诊断,术后根据临床症状和激素水平以判定是否需予以糖皮质激素替代治疗。
肾上腺疾病;醛固酮增多症;皮质醇;库欣综合征
林璐,金楠,谷伟军,等.肾上腺醛固酮-皮质醇共分泌瘤七例临床分析[J].中国全科医学,2017,20(24):3038-3042.[www.chinagp.net]
LIN L,JIN N,GU W J,et al.Clinical analysis of 7 cases of aldosterone-and cortisol-producing adenoma [J].Chinese General Practice,2017,20(24):3038-3042.
原发性醛固酮增多症(PA)简称原醛症,主要分为5个亚型,包括醛固酮瘤(APA)、特发性醛固酮增多症(简称特醛症)、原发性肾上腺皮质增生、家族性醛固酮增多症(Ⅰ~Ⅲ型)、分泌醛固酮的肾上腺皮质癌和异位醛固酮分泌瘤或癌[1]。近年来,国内外逐渐出现关于肾上腺APA同时分泌皮质醇的报道,称为肾上腺醛固酮-皮质醇共分泌瘤(A/CPA)[2]。这类患者大多表现为PA合并亚临床库欣综合征(SCS),曾被认为是一种少见的类型[2]。然而最近的研究提出这一类型肾上腺肿瘤可能占所有APA患者10%以上[3-4],但由于临床医生认识不足,常被忽略。本研究通过收集中国人民解放军总医院收治的7例A/CPA患者的临床资料,分析其临床特征,以提高临床医生对A/CPA的认识和诊治水平。
1 资料与方法
1.1 一般资料 回顾性收集2010—2016年中国人民解放军总医院收治的7例A/CPA患者的临床资料。
1.2 研究方法 总结并分析A/CPA患者的一般情况(性别、就诊年龄、体质指数)、一般资料(最高血压、肾上腺肿瘤位置、肾上腺肿瘤情况等)、内分泌激素水平、生化指标(血钾、血糖、血脂等)、治疗及随访情况。
1.3 诊断标准及方法
1.3.1 PA诊断标准[5-6]7例患者均存在持续性高血压、自发性低钾血症,肾上腺影像学检查提示单侧肾上腺腺瘤,为PA的高危人群。采用血浆醛固酮水平与血浆肾素活性比值(ARR)作为初步筛查指标。ARR>20提示可能为PA,随后进行卡托普利试验和/或生理盐水输注试验进行确诊。其中血浆醛固酮抑制率(%)=(服药前血浆醛固酮水平-服药后血浆醛固酮最小值)/服药前血浆醛固酮水平×100%。
1.3.1.1 ARR测定 入院纠正自发性低钾血症,维持正常钠盐摄入。入院前停用对ARR测定干扰较大的药物(包括醛固酮受体拮抗剂、利尿剂等)至少4周,停用血管紧张素转换酶抑制剂、二氢吡啶类钙离子拮抗剂、β-受体阻滞剂等药物至少2周。改用α-受体阻滞剂和非二氢吡啶类药物调控血压。清晨起床后保持立位状态4 h,静坐5~15 min取空腹肘静脉血检测血浆醛固酮水平、血浆肾素活性,并计算ARR。
1.3.1.2 卡托普利试验 清晨起床后保持坐位1 h后口服50 mg卡托普利,服药前及服药后1、2 h测定血浆醛固酮水平、血浆肾素活性。试验期间患者保持坐位。正常人口服卡托普利后血浆醛固酮水平下降>30%,而PA患者血浆醛固酮不受抑制。
1.3.1.3 生理盐水输注试验 试验前卧床休息1 h,持续静脉滴注2 L 0.9%氯化钠溶液4 h,静脉滴注前后分别取肘静脉血检测血浆醛固酮水平、血浆肾素活性。静脉滴注后血浆醛固酮水平>10.0 ng/dl(277 pmol/L),即PA诊断成立。
1.3.2 SCS诊断标准 患者无典型的库欣综合征的临床表现,即向心性肥胖、满月脸、多毛和多血质等,但实验室检查异常,符合中华医学会内分泌学分会库欣综合征专家共识(2011年)[7]提出的诊断标准。初步检查示血清皮质醇昼夜节律紊乱〔0:00血清皮质醇水平>1.8 μg/dl(50.00 nmol/L)〕;初步检查结果异常时,进行过夜1 mg地塞米松抑制试验(1 mg DST)和/或经典小剂量地塞米松抑制试验(LDDST)以确诊库欣综合征。
1.3.2.1 1 mg DST 第1天8:00取肘静脉血(作为对照)后,于次日0:00口服地塞米松1 mg,服药后8:00再次取血,分别测定各时间点促肾上腺皮质素、血清皮质醇水平。服药后8:00血清皮质醇水平≥5 μg/dl(138 nmol/L)为阳性。
1.3.2.2 LDDST 口服地塞米松0.5 mg/次,1次/h,连续2 d,服药前(0:00)和服药第2天分别测定促肾上腺皮质素、血清皮质醇水平。服药后血清皮质醇水平≥1.8 μg/dl(50 nmol/L)为阳性。
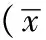
2 结果
2.1 一般情况和部分一般资料 7例A/CPA患者中男1例,女6例;就诊年龄31~69岁,平均就诊年龄(49.1±12.8)岁;体质指数21.5~28.5kg/m2,其中2例肥胖。患者均存在中重度血压升高,最高血压波动在160~200/110~140mmHg(1mmHg=0.133kPa);平均高血压病程(12.1±7.9)年,使用1种或多种降压药物,血压控制情况不佳;肾上腺肿瘤位置:左侧3例,右侧4例;平均肾上腺肿瘤最大直径(3.4±1.6)cm。
2.2 内分泌激素水平 7例患者均进行ARR测定,且进一步行卡托普利试验和/或生理盐水输注试验进行确诊,详见表1。患者4和患者6进行了生理盐水输注试验,血浆醛固酮水平分别为13.1、23.0ng/dl,均>10.0ng/dl(277pmol/L),支持PA诊断。
7例患者血清皮质醇昼夜节律紊乱,0:00血清皮质醇水平均>50.00nmol/L,详见表2。4例患者同时进行了1mgDST和LDDST,服药后血清皮质醇水平均>50.00nmol/L(1.8μg/dl)。2例患者仅进行了1mgDST,服药后血清皮质醇水平均>140.00nmol/L(5.0μg/dl)。患者5直接进行了LDDST,服药后血清皮质醇水平>50.00nmol/L(1.8μg/dl)(见表2)。
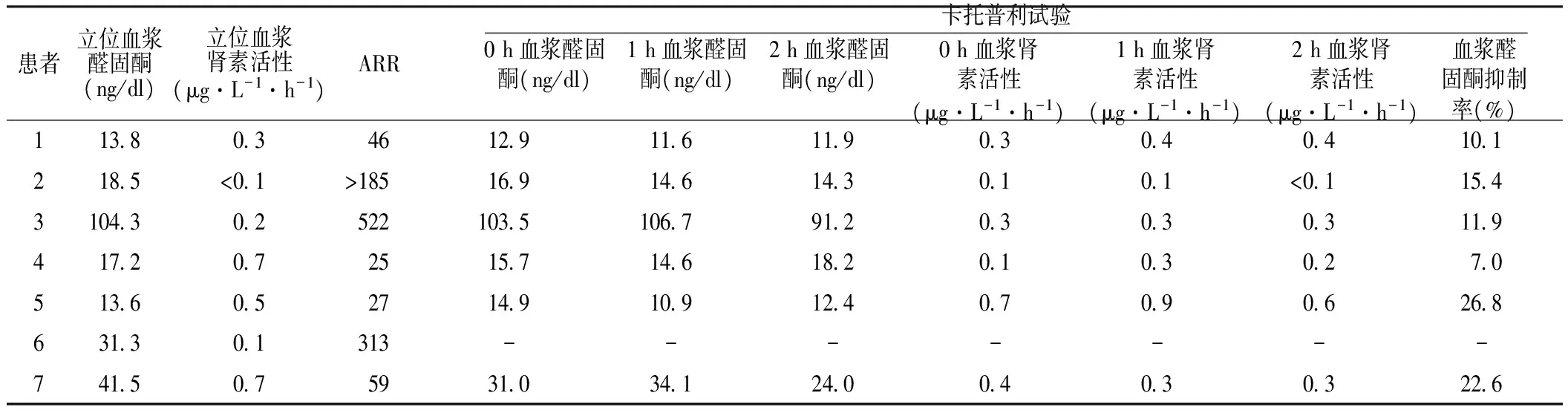
表1 ARR及卡托普利试验结果
注:-表示无此项数据,ARR=血浆醛固酮水平与血浆肾素活性比值
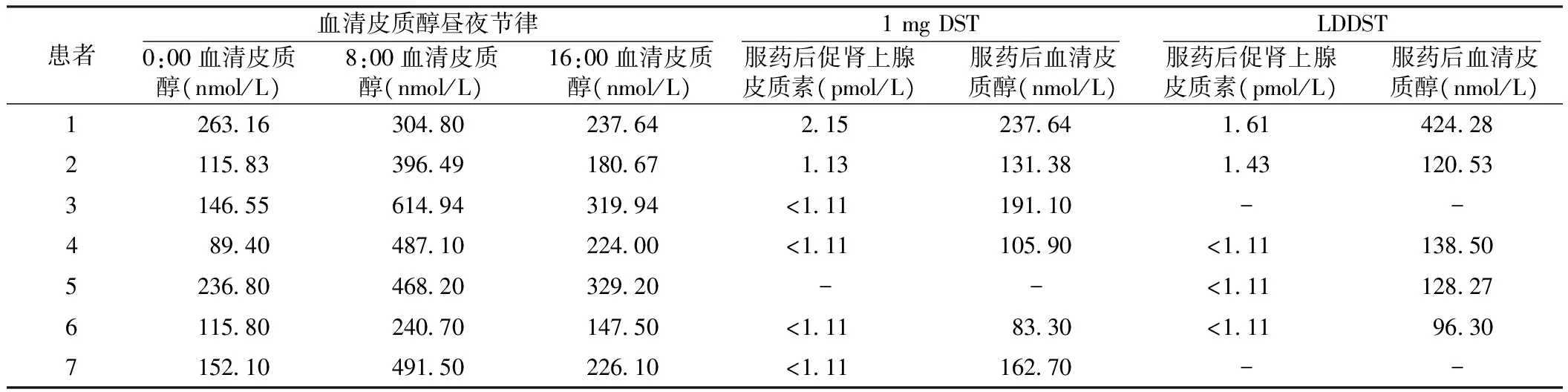
表2 7例患者的血清皮质醇昼夜节律及地塞米松抑制试验结果
注:-表示无此项数据,1 mg DST=过夜1 mg地塞米松抑制试验,LDDST=经典小剂量地塞米松抑制试验
2.3 生化指标 7例患者中1例合并糖尿病病史,其余6例中4例进行了口服葡萄糖耐量试验(OGTT),其中3例存在糖代谢异常。7例患者平均总胆固醇水平(5.2±0.5)mmol/L(参考范围3.1~5.7 mmol/L);平均低密度脂蛋白胆固醇水平(3.4±0.6)mmol/L(参考范围0~3.4 mmol/L)。
2.4 治疗及随访情况 7例患者中6例进行了手术切除单侧肾上腺肿瘤,术后组织病理学证实为肾上腺皮质腺瘤。患者1术后出现明显乏力、不适,复查血钾3.87 mmol/L(参考范围3.50~5.50 mmol/L),卧位血浆醛固酮水平2.05 ng/dl,卧位血浆肾素活性0.3 μg·L-1·h-1,血清皮质醇水平<25.7 nmol/L,予泼尼松片(2.5 mg/次,2次/d)替代治疗5个月。1个月后停用降压药物,监测血压处于参考范围。半年后复查血清皮质醇昼夜节律有所恢复(8:00血清皮质醇水平210.56 nmol/L,16:00血清皮质醇水平73.24 nmol/L),其余患者均进行电话随访。患者2术后出现明显乏力、食欲不振,但患者未遵医嘱及时复诊,上述症状持续半个月后好转,监测血压、血钾处于参考范围。其余4例患者术后未出现明显不适,复查血压、血钾处于参考范围。患者3未行手术治疗,目前治疗方案为:予螺内酯、盐酸特拉唑嗪、苯磺酸左旋氨氯地平联合硝苯地平控释片调控血压,监测血压130/90 mm Hg左右,同时予以氯化钾缓释片(0.5 g/次,2次/d)治疗,监测血钾处于参考范围。
3 讨论
PA是指肾上腺皮质分泌过多醛固酮,导致潴钠排钾、血容量增多、肾素-血管紧张素系统受抑制,临床表现为高血压、低钾血症的综合征群。PA是继发性高血压最常见的病因之一,其中APA为PA最常见的两个亚型之一。随着对PA认识的深入,许多关于PA合并SCS的患者也逐渐被报道[3-4]。SCS是指轻度失调的高皮质醇血症,伴有与库欣综合征相符的代谢和其他指标异常[4]。SCS无典型的库欣综合征的临床表现,即向心性肥胖、满月脸、多毛和多血质等,是基于内分泌功能试验异常明确诊断。据报道,肾上腺意外瘤的患者中5%~20%存在SCS[8-9]。
近年来,国内外学者报道的A/CPA患者日渐增多,甚至可能占所有APA患者的10%以上[2-3],提示这一类型并不如以往所认为的那样罕见。早在1977年,HOGAN等[10]报道了1例同时分泌皮质醇和醛固酮的单侧肾上腺瘤患者。1984年,NOMURA等[11]对8例APA患者进行肾上腺静脉采血检测发现肾上腺APA在促肾上腺皮质素作用下可同时分泌血清皮质醇。随后在1989年,SASANO等[12]发现在APA中,一些肿瘤细胞中存在17α-羟化酶的表达。孕酮在17α-羟化酶的作用下形成17-羟孕酮,17-羟化作用是糖皮质激素合成中的必须环节,而肾上腺球状带中无17α-羟化酶的表达。在APA肿瘤细胞中发现17α-羟化酶的表达,为A/CPA的诊断提供了组织病理学依据。ADACHI等[2]对7例A/CPA患者进行了报道,患者术后肿瘤标本免疫组化染色17α-羟化酶均呈阳性表达。由于条件限制,本组报道的7例患者术后病理标本未能进行17α-羟化酶免疫组化染色测定,但从现有的临床资料进行判断,A/CPA诊断成立。
有研究显示,PA合并SCS患者的心血管事件发病率较单纯PA患者增高[13]。本研究报道的7例患者分别存在不同程度的肥胖、高血压、糖代谢异常或血脂紊乱等1种和/或多种代谢异常,以上代谢异常为心、脑血管疾病的重要危险因素。对于A/CPA患者,首选手术治疗,特别是对于伴多种合并症或代谢紊乱者。SCS术后因下丘脑-垂体轴的长期抑制可出现明显的肾上腺皮质功能减退症状,严重时甚至发生肾上腺危象[14-15],需用肾上腺糖皮质激素短期替代治疗。部分研究亦提示术后是否出现肾上腺皮质功能不足与术前皮质醇升高有关[16]。张锐强等[17]报道的24例SCS患者中术后6例(25%)出现了肾上腺皮质功能减退,表现为乏力、表情淡漠、心悸、心率加快、血压降低,予口服泼尼松(5~15 mg/d)替代治疗后好转,3~5周后停药。本研究报道的患者1即在术后出现明显乏力、食欲不振,复查血清皮质醇水平明显低下,予糖皮质激素替代治疗5个月后停药,术后半年复查血清皮质醇昼夜节律有所恢复。因此术前明确A/CPA诊断对治疗措施的拟定及术后护理意义重大。对于术后是否予以糖皮质激素替代治疗及替代疗程,目前仍无统一定论,仍需根据患者临床症状及血清皮质醇水平进行个体化判定。
研究显示,肾上腺肿瘤直径>2.4~2.5 cm的APA患者需注意合并SCS可能[18-19]。国内仅有的5例A/CPA报道中,平均肾上腺肿瘤直径为3.18 cm[20]。本研究中7例患者平均肾上腺肿瘤最大直径为(3.4±1.6) cm,与文献报道相近[20]。而中华医学会内分泌学分会肾上腺学组提出的PA诊断治疗的专家共识[1]指出单纯APA直径一般<2.0 cm。因此,在临床工作中,对于肾上腺肿瘤直径>2.0 cm的APA患者要警惕合并SCS的可能。
综上所述,由于对PA亚型缺乏认识,临床工作中易出现误诊或漏诊。本文报道的7例患者初步诊断无一例诊断A/CPA。因此笔者建议临床医师应加强对A/CPA的认识,并尽早诊断,这对肾上腺肿瘤患者选择治疗方式及术后护理有重要意义。
作者贡献:林璐进行课题设计与实施、资料收集整理、撰写论文、成文并对文章负责;金楠、谷伟军、杨丽娟、臧丽、杜锦、陈康、郭清华、王先令、杨国庆、窦京涛、巴建明、母义明进行课题实施、评估、资料收集;吕朝晖进行质量控制及审校。
本文无利益冲突。
[1]中华医学会内分泌学分会肾上腺学组.原发性醛固酮增多症诊断治疗的专家共识[J].中华内分泌代谢杂志,2016,32(3):188-195.DOI:10.3760/cma.j.issn.1000-6699.2016.03.003. The Adrenal Group of Chinese Society of Endocrinology.Expert consensus about diagnosis and treatment of primary aldosteronism[J].Chinese Journal of Endocrinology and Metabolism,2016,32(3):188-195.DOI:10.3760/cma.j.issn.1000-6699.2016.03.003.
[2]ADACHI J,HIRAI Y,TERUI K,et al.A report of 7 cases of adrenal tumors secreting both cortisol and aldosterone[J].Intern Med,2003,42(8):714-718.
[3]FUJIMOTO K,HONJO S,TATSUOKA H,et al.Primary aldosteronism associated with subclinical Cushing syndrome[J].J Endocrinol Invest,2013,36(8):564-567.DOI:10.3275/8818.
[4]LAU J H,SZE W C,REZNEK R H,et al.A prospective evaluation of postural stimulation testing,computed tomography and adrenal vein sampling in the differential diagnosis of primary aldosteronism[J].Clin Endocrinol(Oxf),2012,76(2):182-188.DOI:10.1111/j.1365-2265.2011.04202.x.
[5]FUNDER J W,CAREY R M,FARDELLA C,et al.Case detection,diagnosis,and treatment of patients with primary aldosteronism:an endocrine society clinical practice guideline[J].J Clin Endocrinol Metab,2008,93(9):3266-3281.DOI:10.1210/jc.2008-0104.
[6]朱笑笑,唐志清,杨国庆,等.醛固酮瘤腺瘤直径相关的临床特点分析[J].中华内分泌代谢杂志,2013,29(5):390-394.DOI:10.3760/cma.j.issn.1000-6699.2013.05.010. ZHU X X,TANG Z Q,YANG G Q,et al.Adenoma size-related clinical characteristics in patients with aldosterone-producing adenoma[J].Chinese Journal of Endocrinology and Metabolism,2013,29(5):390-394.DOI:10.3760/cma.j.issn.1000-6699.2013.05.010.
[7]中华医学会内分泌学分会.库欣综合征专家共识(2011年)[J].中华内分泌代谢杂志,2012,28(2):96-102.DOI:10.3760/cma.j.issn.1000-6699.2012.02.002. Chinese Society of Endocrinology.Expert consensus about Cushing′s syndrome(2011) [J].Chinese Journal of Endocrinology and Metabolism,2012,28(2):96-102.DOI:10.3760/cma.j.issn.1000-6699.2012.02.002.
[8]NIEMAN L K.Update on subclinical Cushing′s syndrome[J].Curr Opin Endocrinol Diabetes Obes,2015,22(3):180-184.DOI:10.1097/MED.0000000000000159.
[9]ZOGRAFOS G N,PERYSINAKIS I,VASSILATOU E.Subclinical Cushing′s syndrome:current concepts and trends[J].Hormones(Athens),2014,13(3):323-337.DOI:10.14310/horm.2002.1506.
[10]HOGAN M J,SCHAMBELAN M,BIGLIERI E G.Concurrent hypercortisolism and hypermineralocorticoidism[J].Am J Med,1977,62(5):777-782.
[11]NOMURA K,NARUSE M,NARUSE K,et al.In vivo evidence of cortisol secretion by aldosterone-producing adenomas[J].Acta Endocrinol(Copenh),1984,106(4):516-520.
[12]SASANO H,MASON J I,SASANO N.Immunohistochemical study of cytochrome P-45017 alpha in human adrenocortical disorders[J].Hum Pathol,1989,20(2):113-117.
[13]NAKAJIMA Y,YAMADA M,TAGUCHI R,et al.Cardiovascular complications of patients with aldosteronism associated with autonomous cortisol secretion[J].J Clin Endocrinol Metab,2011,96(8):2512-2518.DOI:10.1210/jc.2010-2743.
[14]ALLAN C A,KALTSAS G,PERRY L,et al.Concurrent secretion of aldosterone and cortisol from an adrenal adenoma-value of MRI in diagnosis[J].Clin Endocrinol(Oxf),2000,53(6):749-753.DOI:10.1046/j.1365-2265.2000.01022.x.
[15]IMAI T,SEO H,MURATA Y,et al.Dexamethasone-nonsuppressible cortisol in two cases with aldosterone-producing adenoma[J].J Clin Endocrinol Metab,1991,72(3):575-581.DOI:10.1210/jcem-72-3-575.
[16]DI DALMAZI G,BERR C M,FASSNACHT M,et al.Adrenal function after adrenalectomy for subclinical hypercortisolism and Cushing′s syndrome:a systematic review of the literature[J].J Clin Endocrinol Metab,2014,99(8):2637-2645.DOI:10.1210/jc.2014-1401.
[17]张锐强,张玉石,王海,等.亚临床库欣综合征临床分析[J].中华泌尿外科杂志,2010,31(1):42-44.DOI:10.3760/cma.j.issn.1000-6702.2010.01.013. ZHANG R Q,ZHANG Y S,WANG H,et al.Analysis of subclinical Cushing syndrome [J].Chinese Journal of Urology,2010,31(1):42-44.DOI:10.3760/cma.j.issn.1000-6702.2010.01.013.
[18]MORELLI V,REIMONDO G,GIORDANO R.Long-term follow-up in adrenal incidentalomas:an Italian multicenter study[J].J Clin Endocrinol Metab,2014,99(3):827-834.DOI:10.1210/jc.2013-3527.
[19]DI DALMAZI G,VICENNATI V,RINALDI E,et al.Progressively increased patterns of subclinical cortisol hypersecretion in adrenal incidentalomas differently predict major metabolic and cardiovascular outcomes:a large cross-sectional study[J].Eur J Endocrinol,2012,166(4):669-677.DOI:10.1530/EJE-11-1039.
[20]张开颜,刘春晓,郑嘉欣,等.原发性醛固酮增多症合并亚临床型皮质醇增多症临床特点及其发病机制探讨[J].中华临床医师杂志(电子版),2013,7(15):6858-6863.DOI:10.3877/cma.j.issn.1674-0785.2013.15.020. ZHANG K Y,LIU C X,ZHENG J X,et al.Clinical study and pathogenesis analysis of primary hyperaldosteronism concurrent with subclinical hypercortisolism [J].Chinese Journal of Clinicians(Electronic Edition),2013,7(15):6858-6863.DOI:10.3877/cma.j.issn.1674-0785.2013.15.020.
(本文编辑:毛亚敏)
Clinical Analysis of 7 Cases of Aldosterone-and Cortisol-producing Adenoma
LINLu1,2,JINNan1,GUWei-jun1,YANGLi-juan1,ZANGLi1,DUJin1,CHENKang1,GUOQing-hua1,WANGXian-ling1,YANGGuo-qing1,LYUZhao-hui1*,DOUJing-tao1,BAJian-ming1,MUYi-ming1
1.DepartmentofEndocrinology,ChinesePLAGeneralHospital,Beijing100853,China2.DepartmentofEndocrinology,HainanGenaralHospital,Haikou570311,China*Correspondingauthor:LYUZhao-hui,Professor,Chiefphysician;E-mail:metabolism301@126.com
Objective To retrospectively investigate the clinical features of 7 patients with aldosterone-and cortisol-producing adenoma(A/CPA) and reviewe the related literatures in order to improve the understanding and diagnosis and treatment of the disease.Methods The clinical data of 7 patients with A/CPA admitted to Chinese PLA General Hospital from 2010 to 2016 were retrospectively collected.The general situation,some general information,endocrine hormone levels,biochemical indexes,treatment and follow-up of A/CPA patients were summarized and analyzed.Results There were 1 male and 6 female in the 7 A/CPA patients,and the average age of visiting was(49.1±12.8)years old.The body mass index(BMI) was 21.5-28.5 kg/m2.The mean longest diameter of the adrenal adenomas was(3.4±1.6)cm.The plasma aldosterone level and plasma renin activity ratio(ARR) were measured in all 7 patients,and all of which were ≥25.The captopril challenge test and/or saline infusion test confirmed the diagnosis of primary aldosteronism(PA).All the patients had no clinical manifestations of typical Cushing′s syndrome and serum cortisol circadian rhythm disorder.And the results of overnight 1 mg dexamethasone suppression test or classic low-dose dexamethasone suppression test supported the diagnosis of subclinical Cushing′s syndrome.The postoperative pathological findings of 6 patients suggested adrenocortical adenoma.After surgery,2 patients presented symptoms of fatigue and anorexia.The plasma aldosterone and serum cortisol levels were reexamined in case 1 of the 2 patients and showed significantly reduced.The patinet was given prednisone replacement therapy for 5 months.Conclusion We should be aware of the possibility of merger of subclinical Cushing′s syndrome for APA patients with adrenal tumor diameter >2.0 cm.Preoperative measurement of relevant endocrine hormone levels should be completed to confirm the diagnosis.According to clinical symptoms and hormone levels to determine whether glucocorticoid replacement therapy is required after surgery.
Adrenal gland diseases;Hyperaldosteronism;Cortisol;Cushing syndrome
R 586
B
10.3969/j.issn.1007-9572.2017.06.y37
2017-03-06;
2017-06-06)
1.100853北京市,中国人民解放军总医院内分泌科
2.570311海南省海口市,海南省人民医院内分泌科
*通信作者:吕朝晖,教授,主任医师;E-mail:metabolism301@126.com



