魏伟平,刘海蔚,全会标,张玉海,陈道雄,陈开宁
肿瘤性低磷骨软化症(tumor-induced osteomalacia,TIO)早在1947年被首次报道[1],国内最早的病例报告发表于1980年[2]。TIO是一种罕见的肿瘤引起的低血磷骨软化症,截至2011年,全世界报道300余例[1,3]。TIO患者多为青春期后起病,典型临床症状为骨痛,呈进行性,多以负重部位为主,常伴有身高变矮,肢体乏力等;血磷降低伴尿磷排出增加,血钙正常或偏低,血碱性磷酸酶(ALP)增高,肾小管磷重吸收率下降,血清活性维生素D水平正常或降低;X线检查可见骨密度普遍降低,骨小梁模糊,有时可见假性骨折[4]。TIO肿瘤位置隐匿,由于临床表现与骨质疏松类似,故误诊率高,常造成患者反复住院,医疗费用高,治疗效果差,甚至加重病情[4]。早期诊断并切除肿瘤,可明显缩减住院时间,降低医疗费用,减少患者痛苦,改善治疗效果和患者预后。本文回顾性分析了海南省人民医院成功诊治的TIO患者1例,并检索国内外相关文献进行分析、总结,以提高临床医生对本病的认识,为临床工作提供借鉴。
1 病例简介
患者女,47岁,因“骨痛2年,加重1年”于2016-02-15到海南省人民医院骨科门诊就诊,后收入内分泌科。患者2年前无诱因出现膝关节疼痛,逐渐发展至全身骨痛,以肋骨、肩胛骨下缘、腰背部痛较为显著,伴有双下肢麻木,身高缩短12 cm,逐渐出现行走困难。至当地医院行磁共振成像(MRI)检查示:腰椎及下段胸椎骨质疏松并压缩性改变。半年前在海南省人民医院行腰椎+胸椎MRI,结果显示:胸腰椎椎体形态信号改变,多考虑代谢性骨病,肾性骨病?L4/5及L5/S1椎间盘轻度后突。S1-2成角改变,考虑骨折(见图1)。一直间断予补钙等治疗,疼痛无明显缓解且体质量共减轻约7 kg。5年前有甲状腺腺瘤切除术史。婚育史:17岁结婚,育有2子1女。月经史、家族史无异常。
入院查体:体温36.8 ℃,脉搏106次/min,呼吸频率20次/min,血压116/86 mm Hg(1 mm Hg=0.133 kPa);身高143 cm,体质量40 kg;轻度贫血貌,坐立及站立困难,步态蹒跚,颈部可见长约8 cm的陈旧性手术疤痕;心肺腹检查(-);脊柱向右侧弯畸形,活动受限,胸骨、腰椎、肋骨、骨盆均有压痛,四肢肌肉未见萎缩,肌肉无明显压痛。
实验室检查:血常规:血红蛋白93 g/L(130~175 g/L),血钙2.05 mmol/L(参考范围2.03~2.54 mmol/L)、血磷0.22 mmol/L(参考范围0.90~1.34 mmol/L)。清蛋白37.3 g/L(35.0~50.0 g/L)、C反应蛋白20.230 mg/L(0.068~8.200 mg/L),血钾 3.23 mmol/L(3.50~5.30 mmol/L)、血钠 134.0 mmol/L(137.0~147.0 mmol/L)、血肌酐41 μmol/L(57~111 μmol/L),肝功能、尿常规正常。甲状旁腺素49.10 ng/L(参考范围12.00~88.00 ng/L)。肿瘤标志物未见异常。血碱性磷酸酶:273 U/L(参考范围35~100 U/L),骨碱性磷酸酶:250 U/L(参考范围<200 U/L)。血气分析示pH 7.48,2次查25-羟维生素D为17.5 μg/L 及 16.3 μg/L(参考范围 25.0~150.0 μg/L)。尿本周氏蛋白定性检查(-)。24 h尿磷:11.04 mmol(13.00~42.00 mmol),24 h 尿钙:0.89 mmol(2.50~7.50 mmol)。肾小管磷重吸收率:59.1%(85.0%~95.0%)。腰椎骨密度测定:T值=-3.74 SD,腰椎体严重骨质疏松。胸部X线检查:主动脉硬化,双侧多根肋骨骨质变形,建议行进一步检查。肩关节前后位直接数字化X线摄影(DR):左肩未见明显异常。左侧多发肋骨形态欠自然。请结合临床或进一步检查。骨盆X线检查结果显示:骨盆构成骨可见普遍骨质疏松,右耻骨上下支及左耻骨上支病理性骨折,考虑代谢性骨病可能(肾性骨病?)(见图2)。全身骨显像:左股骨头及左膝关节骨质代谢异常。因病情较为复杂,科室经过讨论后,再次请影像科主任阅片,会诊,最后修正影像报告为:腰椎+胸椎MRI,结果显示:椎体上下缘呈双凹状变形(非个别椎体),呈鱼尾状,椎间盘增宽,呈卵圆形,符合骨软化症表现(见图1)。骨盆X线检查结果显示:骨盆入口呈三角形或心形,可见耻骨联合上、下支假骨折线,符合骨软化症表现(见图2)。给予口服中性磷及补钙治疗,患者肌无力症状稍缓解,骨痛无明显改善。经反复查体,发现患者右侧腘窝可扪及一大小约为4 cm×5 cm的包块,无压痛。立即完善右腘窝彩色超声检查:腘窝内可见一稍强回声团,大小58 mm×26 mm×35 mm,边界清,内回声不均匀,可见较丰富血流信号。诊断:右腘窝异常包块(错构瘤?)。因经济原因患者不愿行正电子发射计算机断层显像(PET-CT)进一步明确肿瘤病灶。
患者于2016-04-25转至外科行手术切除右腘窝肿物治疗。术中切除(右腘窝囊肿)不规则组织一块,大小约5.5 cm×4 cm×3 cm,切面灰白灰黄,质韧,部分呈囊性,囊壁厚0.1 cm,光滑。术后第1~4天患者血磷变化:0.44、0.36、0.48、0.50 mmol/L,术后第6~7天患者血磷变化:0.86、0.82 mmol/L。术后复查肾小管磷重吸收率为90.2%。术后病理检查结果显示:部分区域呈囊壁样;部分区域呈实性,见梭形细胞弥漫增生,其间散在成熟脂肪细胞(见图3)。免疫组化标记显示CD34(+)、胶质纤维酸性蛋白(GFAP)(-)、CD31(-)、CD68(-)、S-100部分(+)。病理诊断:(右腘窝)梭形细胞脂肪瘤伴腘窝囊肿。术后随访2个月后,复查血磷为1.39 mmol/L,骨痛、肌无力症状基本消失,可独立行走及活动。
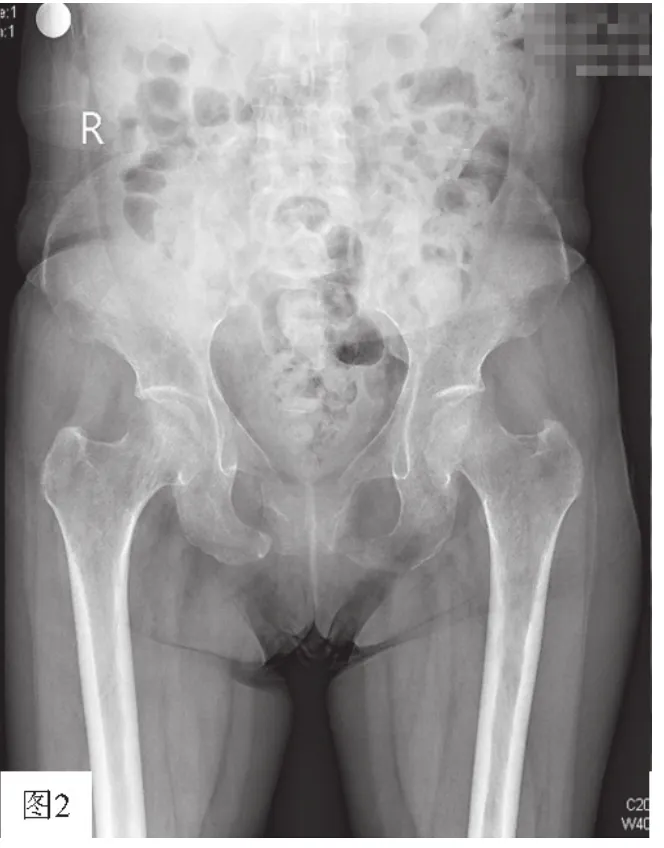
图2 患者骨盆X线检查Figure 2 Patient's pelvic X-ray image
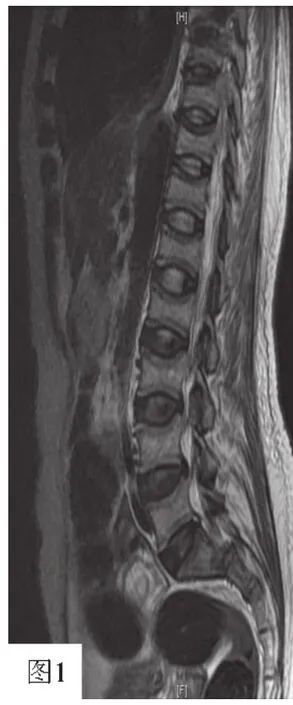
图1 患者腰椎+胸椎MRIFigure 1 Patient's lumbar and thoracic MRI image
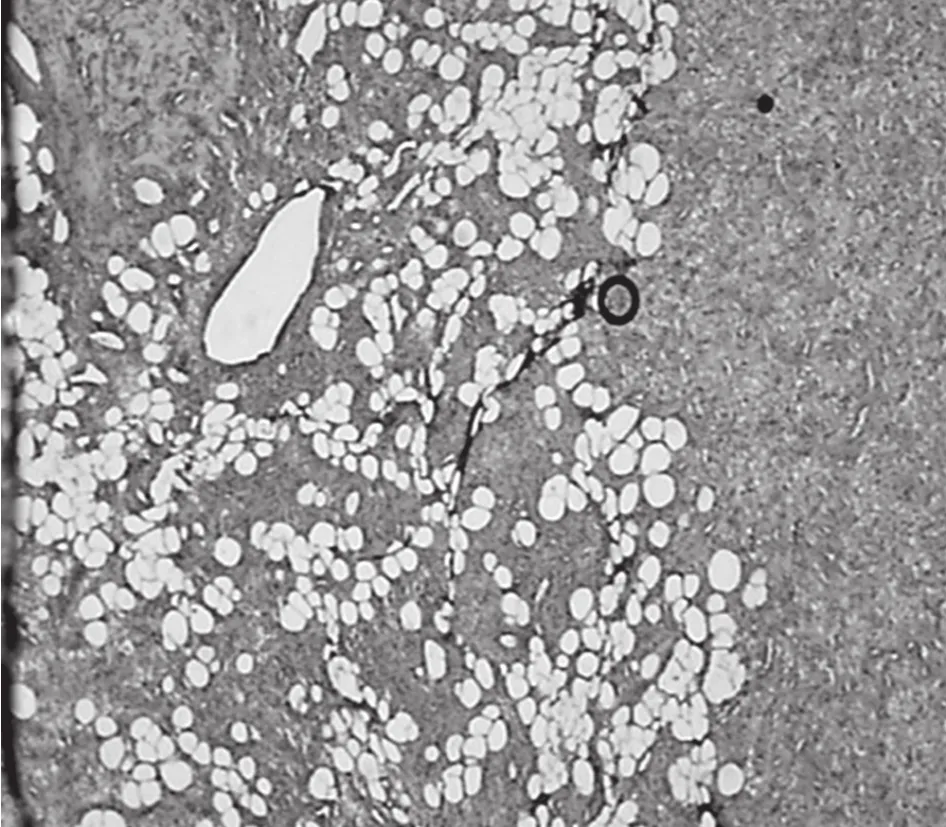
图3 患者病理检查结果Figure 3 Pathological examination
2 讨论
骨软化症是由于钙磷代谢紊乱,导致新形成的骨基质矿化障碍为特征的一种代谢性骨病,发生在骨骺生长板闭合以后[5],若发生在骨骺闭合以前,称为VitD缺乏症,本病以骨痛、骨折、身高变矮为主要临床表现,易与原发性骨质疏松症等疾病相混淆。本例患者腰椎骨密度测定显示T值=-3.74 SD,故早期易被误诊为重度骨质疏松症,其与骨软化症的主要鉴别点为:原发性骨质疏松症好发于绝经女性或老年人,通常情况下患者血钙、磷、碱性磷酸酶在参考范围内(骨折情况下除外),而该患者存在骨代谢指标异常,血磷降低及血碱性磷酸酶升高,最关键的鉴别点在于影像学改变,骨软化症具有特殊的影像学改变[5]:脊椎椎体上下缘呈双凹变形,呈鱼尾状,骨盆呈三叶状,假性骨折线是骨软化症有诊断意义的X线表现,表现为一种条状透明区,一般对称分布。本病例报道中该患者影像学检查显示其骨盆入口呈三角形或心形,可见耻骨联合上支假骨折线,两侧对称存在,椎体上下缘呈双凹状变形(非个别椎体),呈鱼尾状,椎间盘增宽,呈卵圆形,符合骨软化症典型的X线表现,因此诊断骨软化症明确。
骨软化症的病因较多,大致可归纳为以下几类:(1)维生素D代谢异常:①维生素D缺乏(常由营养不良、日照不足、吸收不良引起);②肝脏维生素D羟化减弱;③肾脏1-α羟化缺陷(常见病因为甲状旁腺功能减退症、慢性肾功能不全等);④服用抗癫痫药物、合并肾病综合征等。(2)磷缺失:①摄入减少(药物引起);②肾小管磷重吸收减少。原发性:遗传性、散发性、范可尼综合征;继发性:甲状旁腺功能减退症、肾小管酸中毒、肿瘤所致等。(3)矿化缺陷:①钙化抑制:慢性肾衰竭,低磷酸酶血症(焦磷酸盐增加);②胶原异常:慢性肾衰竭、成骨不全等。(4)其他:骨形成过快(甲状旁腺功能减退症术后)等[6]。本病例报道中该患者反复检查结果显示均存在低磷血症,故骨软化症病因考虑为磷缺失,实验室检查提示24 h尿磷明显增多,肾小管磷重吸收率明显降低,故低磷骨软化症诊断明确。低磷性骨软化症是以磷代谢异常为病因,导致的骨软化症,可分为遗传性和获得性。获得性主要为TIO,遗传性包括:常染色体显性遗传低血磷性佝偻病、X染色体连锁低磷性佝偻病、X连锁隐性低磷性佝偻病、遗传性低磷性佝偻病合并高尿钙症[7]。上述遗传性低磷性骨软化症发病年龄小,常有遗传家族史,易与TIO鉴别,但少数病例呈散发性,可以青中年起病,并且无家族史[8],与TIO难以鉴别,除非发现明确的肿瘤病灶。药物性因素,如长期服用抗病毒药物阿德福韦酯,导致的低磷性骨软化症近来亦有文献报道[9]。本病例报道中该患者无家族史,中年起病,故诊断上倾向于肿瘤性与散发性,结合患者右侧腘窝可扪及一逐渐增大的包块,首先考虑为TIO,最终进行手术切除肿瘤证实。术后患者骨痛症状逐渐改善,骨代谢异常指标恢复正常,故确诊为TIO。
TIO是一种少见的伴瘤综合征,目前研究表明主要与肿瘤细胞分泌的一些激素样排磷因子有关,这些因子可抑制肾小管重吸收磷,导致大量磷从尿中排出,血磷水平明显降低,长时间可导致骨矿化不全和一系列临床表现[10]。常见的磷调节因子是成纤维细胞生长因子23(fibroblast groth factor 23,FGF23),于2000年被发现,主要在骨原细胞及成骨细胞中产生和分泌,在脑、胸腺、小肠、心脏、肝脏、淋巴结、甲状腺等组织中均有表达,FGF23可影响肾小管,减少近曲小管促进钠磷共转运蛋白Ⅱa的表达,同时还影响维生素D的羟化,使得1,25-二羟维生素D3下降,最终导致体内磷排出增加,吸收不足,血磷显著降低[10]。WHITE等[11]观察了TIO患者肿瘤切除前后的血清中FGF23水平的变化,发现肿瘤切除前,血清中FGF23水平明显高于正常人,而肿瘤切除后,FGF23可显著下降,甚至降至正常人水平。另外,有研究表明细胞外基质磷酸糖蛋白、分泌性卷曲蛋白4等因子也具有调磷功能,可能也与TIO有关[12]。
引起TIO的肿瘤广泛分布于人体,多位于骨骼和软组织,常见于四肢,其次为头面部、躯干[13],JIANG等[14]报道的39例TIO患者中肿瘤多在下肢,占40%。TIO肿瘤多为良性,生长较缓慢,大部分来源于间叶组织,约10%为恶性,恶性多见于前列腺癌,常见的病理类型为:血管瘤与血管内皮瘤(二者占50%左右)、纤维瘤、巨细胞瘤等,病理类型不典型可统称为磷酸盐尿性间叶组织肿瘤,包括混合结缔组织亚型,成骨细胞瘤样亚型,非骨化纤维瘤亚型,骨化纤维瘤样亚型[15]。
TIO常见的临床特点:(1)青春期后起病,多为中年患者;(2)进行性骨关节痛,身高变矮,步态异常,肌力下降;(3)低磷血症,尿磷排泄增加;(4)血钙正常或降低,血1,25二羟维生素D3水平低,甲状旁腺激素正常,少数升高;(5)血碱性磷酸酶升高,常规补磷效果差;(6)可发现相关肿瘤[13]。明确对肿瘤进行定性及定位诊断是TIO治疗的前提和关键,部分患者可通过详细的体格检查发现肿瘤。致骨软化的肿瘤多来自间叶组织,多种间叶组织来源的肿瘤上可有生长抑素受体(SSTR)存在,故可利用奥曲肽(生长抑素类似物)与该受体结合显像,来对肿瘤进行定位[16]。奥曲肽显像对肿瘤部位的发现具有重要价值,灵敏度较高,但特异度低,某些炎症反应和骨折可造成假阳性结果,且国内开展极少,PET-CT检查也可作为肿瘤定位的手段,但价格较高[17],另外,CT、MRI、超声等影像学检查以及分段静脉采血测定FGF23水平对肿瘤的发现和定位也有重要意义[18]。
TIO治疗的关键是找到原发肿瘤的位置,若能明确肿瘤部位,手术完整切除,可达到治愈的效果。根据巴建明等[13]观察,大部分患者血磷水平在术后1~2周左右可恢复正常,骨痛症状术后短期内可呈一过性加重,之后缓解,通常半年内可改善,在观察的12例患者中,仅有1例术后血磷无法恢复正常,考虑与瘤体没有切除干净或肿瘤复发有关。本病例报道中该患者术后随访1年,术后1周有骨痛加重表现,其后症状逐渐改善,血磷完全恢复正常,半年后骨痛基本缓解,1年后正常行走及生活。另外,还有使用射频消融、冷冻疗法、无水酒精注射治疗该病的报道[19-20]。若肿瘤无法定位,可补充中性磷、活性维生素D缓解症状。
综上所述,TIO临床罕见,起病隐匿,临床上误诊率高,但仍具有典型的临床特点,临床中应提高对该病的认识,若能早期诊断,明确肿瘤位置,手术切除可达到治愈效果,对于疑似该病的患者,仔细进行体格检查以及奥曲肽显像等影像学检查对肿瘤的发现和定位具有重要意义。
作者贡献:魏伟平负责病例资料收集整理、撰写论文、成文并对文章负责;魏伟平、刘海蔚、张玉海参与病例诊治及护理;魏伟平负责病例资料的收集;刘海蔚、全会标、陈道雄、陈开宁负责论文的修改及审校。
本文无利益冲突。
[1]赵永强,田德增,金楠,等.低磷骨软化症11例分析[J].疑 难 病 杂 志,2014,13(1):88-89,91.DOI:10.3969/j.issn.1671-6450.2014.01.031.ZHAO Y Q,TIAN D Z,JIN N,et al.Analysis of 11-cases of hypophosphatemia osteomalacia[J].Chinese Journal of Difficult and Complicated Cases,2014,13(1):88-89,91.DOI:10.3969/j.issn.1671-6450.2014.01.031.
[2]李梅,孟迅吾,邢小平,等.胸腺类癌导致肿瘤性低磷软骨病一例[J].中华医学代谢杂志,2003,83(23):2028.DOI:10.3760/j:issn:0376-2491.2003.23.027.LI M,MENG X W,XING X P,et al.Thymic carcinomas induced osteomalacia:one case report[J].National Medical Journal of China,2003,83(23):2028.DOI:10.3760/j:issn:0376-2491.2003.23.027.
[3]CHONG W H,MOLINOLO A A,CHEN C C,et al.Tumorinduced osteomalacia[J].Endocr Relat Cancer,2011,18(3):R53-77.DOI:10.1530/ERC-11-0006.
[4]柯耀华,章振林,张惠箴,等.肿瘤性骨软化症二例并文献复习[J].中华内分泌代谢杂志,2009,25(4):465-467.DOI:10.3760/cma.j.issn.1000-6699.2009.04.036.KE Y H,ZHANG Z L,ZHANG H Z,et al.Tumor induced osteomalacia:two case reports and literature review[J].Chinese Journal of Endocrinology and Metabolism,2009,25(4):465-467.DOI:10.3760/cma.j.issn.1000-6699.2009.04.036.
[5]杜洪泉,郑燕,章振林,等.低磷性骨软化症的临诊应对[J].中 华 内 分 泌 代 谢 杂 志,2014,30(8):697-700.DOI:10.3760/cma.j.issn.1000-6699.2014.08.015.DU H Q,ZHENG Y,ZHANG Z L,et al.Approach to the patient with hypophosphatemic osteomalacia[J].Chinese Journal of Endocrinology and Metabolism,2014,30(8):697-700.DOI:10.3760/cma.j.issn.1000-6699.2014.08.015.
[6]伍汉文.佝偻病与骨软化症[J].医学临床研究,2002,19(9):263-267.DOI:10.3969/j.issn.1671-7171.2002.09.011.WU H W.Rickets and osteomalacia[J].Journal of Clinical Research,2002,19(9):263-267.DOI:10.3969/j.issn.1671-7171.2002.09.011.
[7]MINISOLA S,PEACOCK M,FUKUMOTO S,et al.Tumourinduced osteomalacia[J].Nat Rev Dis Primers,2017,3:17044.DOI:10.1038/nrdp.2017.44.
[8]QUARLES L D.FGF23,PHEX,and MEPE regulation of phosphate homeostasis and skeletal mineralization[J].Am J Physiol Endocrinol Metab,2003,285(1):e1-9.DOI:10.1152/ajpendo.00016.2003.
[9]KAHN J,LAGAKOS S,WULFSOHN M,et al.Efficacy and safety of adefovir dipivoxil with antiretroviral therapy:a randomized controlled trial[J].JAMA,1999,282(24):2305-2312.DOI:10.1001/jama.282.24.2305.
[10]DADONIENE J,MIGLINAS M,MILTINIENE D,et al.Tumourinduced osteomalacia:a literature review and a case report[J].World J Surg Oncol,2016,14(1):4.DOI:10.1186/S12957-015-0763-7.
[11]WHITE K E,JONSSON K B,CARN G,et al.The autosomal dominant hypophosphatemic rickets(ADHR) gene is a secreted polypeptide overexpressed by tumors that cause phosphate wasting[J].J Clin Endocrinol Metab,2001,86(2):497-500.DOI:10.1210/jcem.86.2.7408.
[12]姜艳,夏维波,孟迅吾,等.FGF23、MEPE和sFRP4在肿瘤性骨软化症发病机制中的作用[J].国际内分泌代谢杂志,2009,29(3):190-192,207.DOI:10.3760/cma.j.issn.1673-4157.2009.03.013.JIANG Y,XIA W B,MENG X W,et al.Roles of FGF23,MEPE and sFRP4 in the pathogenesis of tumor induced osteomalacia[J].International Journal of Endocrinology and Metabolism,2009,29(3):190-192,207.DOI:10.3760/cma.j.issn.1673-4157.2009.03.013.
[13]巴建明,桑艳红,陆菊明,等.12例肿瘤性骨软化症的临床诊治及术后随访[J].中华内分泌代谢杂志,2011,27(1):19-23.DOI:10.3760/cma.j.issn.1000-6699.2011.01.007.BA J M,SANG Y H,LU J M,et al.Clinical management and postoperative follow up of 12 patients with tumor-induced osteomalacia[J].Chinese Journal of Endocrinology and Metabolism,2011,27(1):19-23.DOI:10.3760/cma.j.issn.1000-6699.2011.01.007.
[14]JIANG Y,XIA W B,XING X P,et al.Tumor- induced osteomalacia:an important cause of adult-onset hypophos-phatemic osteomalacia in China:report of 39 cases and review of the literature[J].J Bone Mineral Res,2012,27(9):1967-1975.DOI:10.1002/jbmr.1642.
[15]ZUO Q Y,WANG H,LI W,et al.Treatment and outcomes of tumor-induced osteomalacia associated with phosphaturic mesenchymal tumors:retrospective review of 12 patients[J].BMC Musculoskelet Disord,2017,18(1):403.DOI:10.1186/s12891-017-1756-1.
[16]张化冰,潘慧,李方,等.奥曲肽显像诊断肿瘤性骨软化一例[J].中华医学杂志,2005,85(33):2375-2376.DOI:10.3760/j:issn:0376-2491.2005.33.020.ZHANG H B,PAN H,LI F,et al.A case of osteomalacia was diagnosed by octreotide imaging[J].National Medical Journal of China,2005,85(33):2375-2376.DOI:10.3760/j:issn:0376-2491.2005.33.020.
[17]CLIFLON-BLIGH R J,HOFMAN M S,DUNCAN E,et al.Impmving diagnosis of tumor-induced osteomalacia with Gallium-68 DOTATATE PET/CT[J].J Clin Endocdnol Metab,2013,98(2):678-694.DOI:10.1210/jc.2012-3642.
[18]CHONG W H,MOLLNOJO A A,CHEN C C,et al.Tumorinduced osteomalacia[J].Endocr Relat Cancer,2011,18(3):R53-77.DOI:10.1530/ERC-11-0006.
[19]HESSE E,ROSENTHAL H,BASTIAN L.Radiofrequency ablation of a tumor causing oncogenic osteomalacia[J].N Engl J Med,2007,357(4):422-424.DOI:10.1056/NEJMc070347.
[20]TUTTON S,0LSON E,KING D,et al.Successful treatment of tumor-induced osteomalacia with CT-guided percutaneous ethanol and cryoab-lation[J].J Clin Endocrinol Metab,2012,97(10):3421-3425.DOI:10.1210/jc.2012-1719.
(收稿日期:2017-12-06;修回日期:2018-03-16)
(本文编辑:石敏杰)



