贺继刚,李贝贝,韩金秀,李洪荣,撒亚莲,严丹,杨晓华*
冠心病引起的心肌梗死(即心肌损伤)已成为目前世界范围内的头号“杀手”。据世界卫生组织(WHO)统计:2000—2012年冠心病位居世界人口死亡原因首位[1-2]。目前冠心病的治疗主要包括外科治疗、内科治疗及细胞治疗。细胞治疗中应用最为成熟的是骨髓间充质干细胞(BMSCs),虽然已有大量文献证实BMSCs可以改善心肌梗死患者心功能[3]。但亦有学者提出,BMSCs临床应用尚不成熟,主要表现为:(1)BMSCs安全性仍不确切;(2)目前为止国际、国内尚无文献报道BMSCs能够有效分化成为心肌细胞;(3)异体BMSCs治疗心肌梗死依然遥远。前期研究证实过表达GATA-4 BMSCs可以更为有效地增强BMSCs的抗凋亡能力从而修复受损心肌[4]。在前期研究基础上[4],本研究进一步聚焦于细胞分泌外泌体(Exosome),其具有多种生物学功能,可以使细胞在不需要直接接触下完成细胞间生物信号转导。
本研究提取慢病毒携带GATA-4转染小鼠BMSCs分泌的Exosome,通过采用体外流式细胞术、Western blotting法检测Exosome对心肌细胞的保护作用;给予心肌梗死模型小鼠干预措施后提高其心功能并行心肌梗死局部脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(Tunnel)检验,表明过表达GATA-4 BMSCs分泌的Exosome可以通过增强BMSCs抗凋亡能力,有效改善心肌梗死后小鼠的心功能,现报道如下。
本研究创新点:
(1)本课题根据国内外关于GATA-4、外泌体(Exosome)及骨髓间充质干细胞(BMSCs)修复心肌梗死后损伤心肌结果的提示,结合本课题组的前期研究结果提出科学问题及假说。(2)近几年国内外学者的研究侧重点为BMSCs修复心肌梗死后损伤心肌的作用及细胞中的GATA-4独立发生的作用,而关于BMSCs、GATA-4及Exosome与心肌损伤修复的研究鲜有报道。本研究首次明确过表达GATA-4 BMSCs分泌的Exosome在改善心功能中起重要作用。(3)本研究从细胞系、原代细胞、组织和动物整体水平等多方面进行实验设计,挖掘Exosome、GATA-4及BMSCs三者间的关系,探索Exosome修复心肌损伤可能的机制。
1 材料与方法
1.1 实验动物 2017年1—12月选取健康4周龄SPF级C57BL/6小鼠45只,均为雄性,由成都达硕实验动物中心提供,动物许可证号为SCXK(川)2015—030。小鼠的喂养、观察均按照非临床研究管理规范(GLP)规定执行[4]。30只小鼠用于体外提取细胞共培养实验,12只用于体内实验构建心肌梗死模型,其余3只不做任何处理。
1.2 主要试剂和仪器 C57BL/6小鼠BMSCs培养基(低糖培养基,含10%胎牛血清)购自美国Cyagen Biosciences公 司。Dead Cell Apoptosis Kit with Annexin V Alexa Fluor®488 & PI- for Flow Cytometry 购 自 美 国Invitrogen 公司。CASPASE3、CASPASE9、CASPASE8、Cytochrome C购自美国CST公司。Tunnel试剂盒购自美国Roche公司。CD29、CD44、CD11b、干细胞抗原1(SCA-1)抗体购自美国BioLegend公司。CD11b Micro Beads购自美国Miltenyi公司。ExoQuick-TC、Exosome Antibodies、Array & ELISA Kits均购自美国SBI公司。小鼠心肌细胞购自赛齐(上海)生物工程有限公司。PHILIPS EPIQ 7C心脏超声仪购自美国PHILIPS公司。
1.3 小鼠BMSCs的培养及鉴定 采用全骨髓培养法培养小鼠BMSCs,胰酶消化传代至第3代时采用CD11b的磁珠负选,去除造血干祖细胞。取生长第8代BMSCs,待细胞融合达80%~90%时,制备单细胞悬液,采用流式细胞术检测CD29、CD11b、CD44、SCA-1(PE-CD29 单抗 5 μl以 1∶20 稀释至 100 μl、PE-CD11b 单抗 5 μl以 1∶40 稀释至 100 μl、PE/Cy5-CD44 5μl以 1∶20稀 释 至 100 μl、FITC anti-mouse SCA-1 5 μl以 1∶20 稀释至 100 μl)。
1.4 GATA-4表达丰度的检测 采用慢病毒载体及基因开启技术构建过表达GATA-4 BMSCs,将GATA-4基因插入慢病毒包装质粒GV308中,构建GV308-GATA-4重组慢病毒包装质粒。然后将GV308-GATA-4重组慢病毒包装质粒转染入小鼠BMSCs并加入基因开启剂强力霉素(DOX)。转染成功后采用RT-PCR法检测转染48 h GATA-4表达丰度。
1.5 Exosome提取及检测 按照ExoQuick-TC说明书提取Exosome,利用Exosome Antibodies、Array & ELISA Kits试剂盒检测Exosome中CD9表达量并计算纯度,绘制OD450处吸光度相关-回归曲线并建立回归方程,采用电镜观察Exosome形态。
1.6 体外实验 分组情况:与过表达GATA-4 BMSCs分泌的Exosome共同培养的心肌细胞为A组(体外),与空载体BMSCs分泌的Exosome共同培养的心肌细胞为B组(体外),与BMSCs分泌的Exosome共同培养的心肌细胞为C组(体外),低氧(1%)无血清条件下培养的心肌细胞为D组(体外),正常条件下单独培养的心肌细胞为E组(体外)。各组均培养48 h,后采用流式细胞术检测各组心肌细胞凋亡率(按Dead Cell Apoptosis Kit with Annexin V Alexa Fluor®488 & PI-for Flow Cytometry说明书完成流式细胞术检测)。采用Western blotting法检测各组细胞相应时间点Caspase-3、Caspase-8、Caspase-9、细胞色素C表达水平。实验独立重复3次。
1.7 体内实验
1.7.1 小鼠心肌梗死模型的制备 选取30只小鼠建立心肌梗死模型。直视下气管插管并与小动物呼吸机连接,由第3肋间进入小鼠胸腔,以肺动脉圆锥与左心耳右缘之间交点和心尖的假想连线作为小鼠冠状动脉前降支走行标志,以9-0缝线于左心耳根部下方进行缝扎,缝扎方向和左心耳下缘平行。结扎成功标志为左心室前壁及心尖周围心肌组织运动减弱,心电图出现明显的S-T段抬高、aVF导联见S-T段抬高超过0.2 mV。最后缝合肋骨,关闭肋间隙。
1.7.2 检测过表达GATA-4小鼠BMSC分泌的Exosome通过抗凋亡作用修复心肌损伤的效果 采用ExoQuick TC法提取过表达GATA-4 BMSCs、空载体BMSCs、BMSCs分泌的Exosome。小鼠心肌梗死模型建模后48 h注射80 000 μg的Exosome,分组情况(每组3只小鼠):A组(体内)注射过表达GATA-4 BMSCs分泌的Exosome;B组(体内)注射空载体BMSCs分泌的Exosome;C组(体内)注射BMSCs分泌的Exosome;另取3只心肌梗死未处理小鼠作为D组(体内)、3只正常小鼠作为E组(体内)。于注射Exosome后48 h采用心脏超声仪评估各组小鼠心功能。完成心脏彩超后采用原位免疫组化法评估心肌梗死小鼠心脏凋亡细胞数量。
1.8 统计学方法 采用SPSS 15.0统计软件进行数据分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Bonferroni post-hoc检验。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠BMSCs鉴定结果 超过90%的小鼠BMSCs表达CD29(表达率为98.0%)、CD44(表达率为100.0%)和SCA-1(表达率为99.5%),但很少细胞表达CD11b(表达率为0.1%)。
2.2 GATA-4表达丰度 过表达GATA-4 BMSCs的GATA-4表达丰度为未过表达GATA-4 BMSCs的97.269倍,差异有统计学意义(P<0.05)。
2.3 BMSCs分泌的Exosome提取及检测结果 绘制OD450处吸光度相关-回归曲线(见图1)。回归方程y=0.014 3x+0.197 4,小鼠BMSCs分泌的Exosome 表达量为0.272 5,Exosome纯度为5.25×108个。Exosome大小40~100 nm,颗粒成团聚集(见图2)。
2.4 体外实验心肌细胞凋亡率 体外实验5组心肌细胞凋亡率比较,差异有统计学意义(P<0.05)。A组(体外)细胞凋亡率低于B组(体外)、C组(体外)、D组(体外),高于E组(体外),差异有统计学意义(P<0.05,见表1)。
2.5 体外实验5组Caspase-3、Caspase-8、Caspase-9、细胞色素C表达水平比较 体外实验5组Caspase-3、Caspase-9表达水平比较,差异无统计学意义(P>0.05);体外实验5组Caspase-8、细胞色素C表达水平比较,差异有统计学意义(P<0.05)。A组(体外)Caspase 8、细胞色素C表达水平低于B组(体外)、C组(体外)、D组(体外)及E组(体外),差异有统计学意义(P<0.05,见表2、图3)。
2.6 小鼠心肌梗死模型心电图 小鼠心肌梗死模型心电图示aVF导联S-T段明显抬高,幅度>0.2 mV,提示心肌梗死模型建立成功。开胸后结扎前,记录aVF导联心电图;结扎后再次记录aVF导联心电图可见aVF导联S-T明显抬高,幅度超过0.2 mV(见图4)。
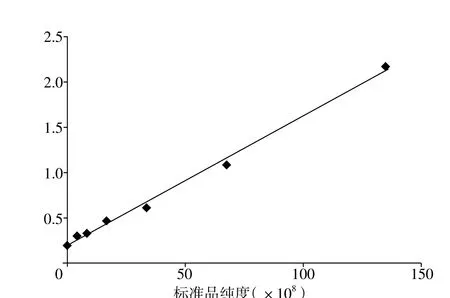
图1 相关-回归曲线Figure 1 Correlation regression curve

图2 Exosome形态Figure 2 Exosome form
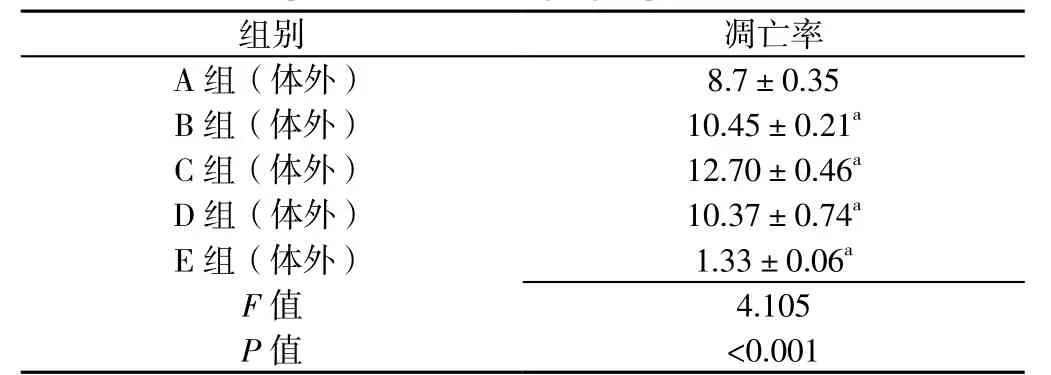
表1 体外实验5组心肌细胞凋亡率比较(n=3,x±s,%)Table 1 Proportion of apoptotic cells in myocardial infarction focus after intervention and adoption for 48 h among 5 groups in vitro
2.7 体内实验5组小鼠心功能比较 体内实验5组小鼠射血分数(EF)、环比收缩(FS)前后差值比较,差异有统计学意义(P<0.05);5组小鼠环比舒张直径(LVIDd)、环比收缩直径(LVIDs)前后差值比较,差异无统计学意义(P>0.05)。A组(体内)小鼠EF、FS前后差值高于B组(体内)、C组(体内)、D组(体内)及E组(体内),差异有统计学意义(P<0.05,见表3)。
2.8 体内实验5组小鼠心肌细胞凋亡数量比较 镜下可见A组(体内)的褐色凋亡细胞较B组(体内)及C组(体内)少,但较E组(体内)多(见图5)。体内实验5组小鼠心肌细胞凋亡数量比较,差异有统计学意义(P<0.05)。A组(体内)小鼠心肌细胞凋亡细胞数量高于E组(体内),而低于B组(体内)、C组(体内)、D组(体内),差异有统计学意义(P<0.05,见表4)。
表2 体外实验5组Caspase-3、Caspase-8、Caspase-9、细胞色素C表达水平比较(n=3,±s)Table 2 Comparison of expression levels of caspase-3,caspase-8,caspase-9,and cytochrome C among 5 groups in vitro
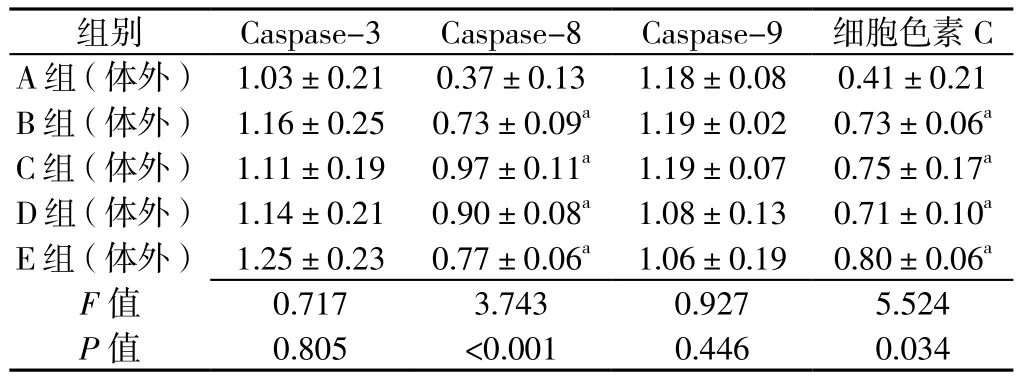
表2 体外实验5组Caspase-3、Caspase-8、Caspase-9、细胞色素C表达水平比较(n=3,±s)Table 2 Comparison of expression levels of caspase-3,caspase-8,caspase-9,and cytochrome C among 5 groups in vitro
注:与A组(体外)比较,aP<0.05
组别 Caspase-3 Caspase-8 Caspase-9 细胞色素C A组(体外) 1.03±0.21 0.37±0.13 1.18±0.08 0.41±0.21 B组(体外) 1.16±0.25 0.73±0.09a 1.19±0.02 0.73±0.06a C组(体外) 1.11±0.19 0.97±0.11a 1.19±0.07 0.75±0.17a D组(体外) 1.14±0.21 0.90±0.08a 1.08±0.13 0.71±0.10a E组(体外) 1.25±0.23 0.77±0.06a 1.06±0.19 0.80±0.06a F值 0.717 3.743 0.927 5.524 P值 0.805 <0.001 0.446 0.034

图3 体外实验Caspase-3、Caspase-8、Caspase-9、细胞色素C表达水平Figure 3 Expression levels of Caspase-3,Caspase-8,Caspase-9,and cytochrome C among 5 groups in vitro
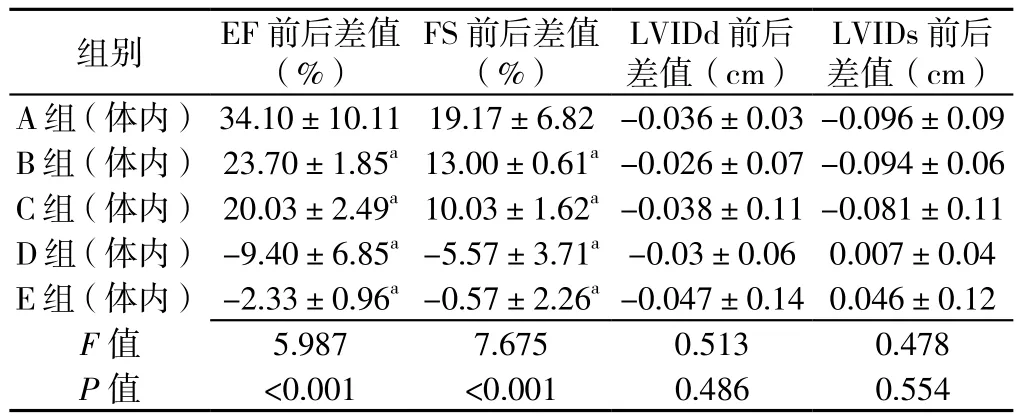
表3 体内实验5组小鼠心功能比较(n=3,x±s)Table 3 Comparison of the cardiac functions among 5 groups of mice in vivo
3 讨论
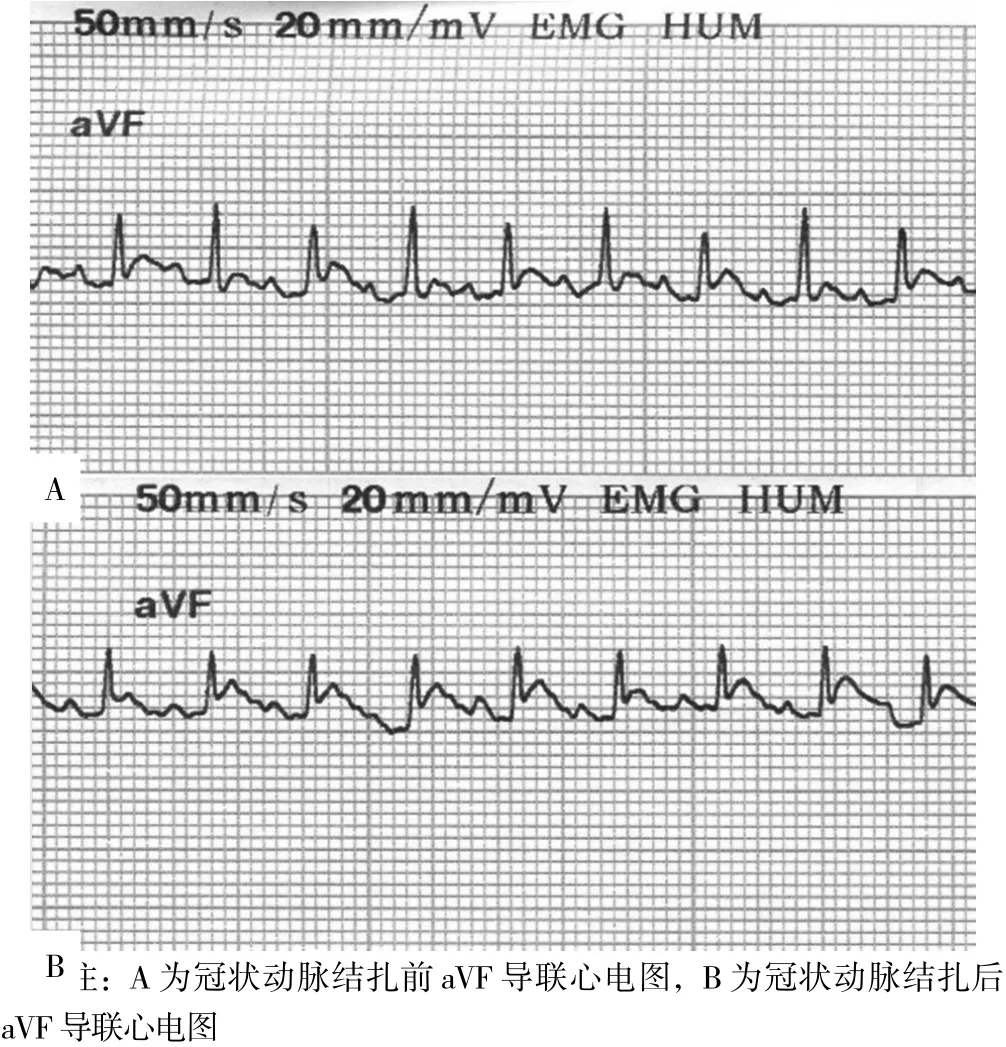
图4 小鼠心肌梗死模型建模前后aVF导联心电图Figure 4 aVF lead electrocardiogram before and after the establishment of mouse myocardial infarction model
治疗冠心病引起的心肌梗死占用了大量医疗资源。目前BMSCs治疗冠心病引起的心肌细胞损伤成为研究热点。但多年来BMSCs发展却相对滞后,主要原因是BMSCs的临床应用安全性一直存在争议。前期研究发现过表达GATA-4 BMSCs可以通过增强干细胞的抗凋亡能力改善心肌梗死后的心功能[4]。GATA结合蛋白是具有Ⅳ型锌指结构的转录因子。有证据表明GATA-4在心肌肥大期间抑制成体心肌细胞凋亡过程中具有重要作用[4],当细胞发生凋亡时GATA-4表达下降[5]。表明细胞的凋亡可以通过恢复GATA-4的作用而被减弱,GATA-4可以调节成体心脏细胞的存活。
本研究正是在前期研究基础上[4],将目光聚焦于BMSCs分泌的Exosome。Exosome是小的膜性囊泡,从20世纪90年代起受到极大关注[6-8]。此词于1981年首先提出,是指从细胞上产生的鳞片状脱落的囊泡,具有胞外酶的活性[7]。Exosome可能扮演细胞与细胞之间的信号作用,其可以远距离运输并将所携带物质释放入细胞影响受体细胞的处理过程。如RNA从一个细胞穿梭到另一个细胞,被称为“exosomal载体RNA”,能够影响受体细胞的蛋白质产生[9-10]。
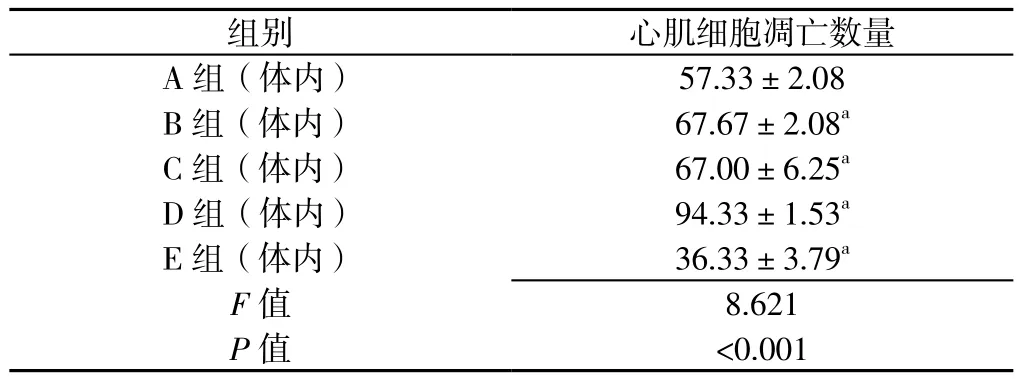
表4 体内实验5组小鼠心肌细胞凋亡数量比较(n=3,x± s,个/高倍镜)Table 4 Comparison of the number of cardiomyocytes apoptosis in 5 groups of mice in vivo
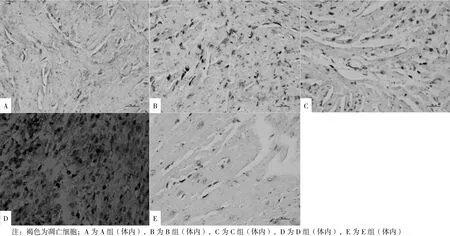
图 5 心肌梗死局部凋亡细胞(原位免疫组化法,×40)Figure 5 Apoptotic cells in myocardial infarction focus after intervention and adoption for 48 h in 5 groups
本研究提出通过提取过表达GATA-4 BMSCs分泌的Exosome是否也可以通过增强干细胞抗凋亡能力进而改善心肌梗死后小鼠的心功能。
目前认为影响细胞凋亡的途径主要有两条:(1)通过以 Caspase-8 活化为代表的死亡受体通路,如Fas通路。(2)细胞色素C释放及Caspase-9活化为代表的线粒体信号通路[11-12]。如果过表达GATA-4 BMSCs分泌的Exosome具有增强抗凋亡能力,其是通过哪条途径改善了细胞的凋亡情况,目前尚不清楚。而据DENG等[13]报道过表达GATA-4 BMSCs可以显著降低心肌细胞凋亡率,改善心肌梗死后心功能。本研究首次对其是否通过Exosome完成上述功能进行了证实。
本研究结果显示:A组(体外)Caspase 8、细胞色素C表达水平低于B组(体外)、C组(体外)、D组(体外)及E组(体外);A组(体内)小鼠心肌细胞凋亡数量高于E组(体内),而低于B组(体内)、C组(体内)、D组(体内)。初步证明过表达GATA-4 BMSCs分泌的Exosome可能是通过抑制细胞色素C释放为代表的线粒体信号通路和Fas通路改善细胞凋亡情况。
本实验为了进一步证实体外实验结果,在小鼠心肌梗死模型造模48 h后,经尾静脉注射过表达GATA-4-BMSCs分泌的Exosome、空载体-BMSCs分泌的Exosome、BMSCs分泌的Exosome,将不给予任何处理的心肌梗死模型小鼠及正常喂养的小鼠作为对照组。检测给予干预措施48 h后的心功能改善情况,结果显示:A组(体内)小鼠EF、FS前后差值高于B组(体内)、C组(体内)、D组(体内)及E组(体内);A组(体内)小鼠心肌细胞凋亡细胞数量高于E组(体内),而低于B组(体内)、C组(体内)、D组(体内)。
综上所述,过表达GATA-4 BMSCs分泌的Exosome可以通过增强心肌细胞的抗凋亡能力,有效改善心肌梗死后小鼠的心功能。
作者贡献:贺继刚、杨晓华进行文章的构思与设计;贺继刚、李贝贝、韩金秀进行文章的可行性分析;李洪荣进行文献/资料收集、整理;贺继刚、杨晓华撰写论文;撒亚莲、严丹进行论文的修订,英文的修订;贺继刚负责文章的质量控制及审校;贺继刚、杨晓华对文章整体负责,监督管理。
本文无利益冲突。



