唐彬,银河,杨博文,金哲峰,秦晓宽,刘志伟,魏戌,孙凯,齐宝玉,陈忻*,朱立国,3*
脊髓型颈椎病(cervical spondylotic myelopathy,CSM)是由于椎间盘突出、韧带骨化、颈椎失稳或畸形、生物力学改变等导致脊髓受压或缺血损伤,进而引起的脊髓传导功能障碍性疾病[1]。近年来其发病率逐年升高,发病年龄趋于年轻化,成为严重危害中老年乃至青年人健康的常见颈椎疾患之一[2]。手术疗法能够有效解除脊髓的压迫,并同时改善脊柱的稳定性,是临床上治疗CSM的重要手段。但对于不能耐受手术、轻度或症状不明显的中度CSM患者,非手术疗法仍然是必要的。
前期临床研究已证实益肾养髓方用于治疗病情平稳、手术指征不明显的早中期CSM患者已获得比较满意的临床疗效,且其可缓解CSM患者术后临床症状[3]。在临床证据较为充分的前提下,益肾养髓方的药效研究及其对神经元保护作用的基础研究,对于阐明其疗效机制和促进中医药的现代化具有非常重要的意义。
本研究采用国际公认的吸水膨胀材料压迫脊髓的方法建立CSM动物模型,前期相关基础研究已证实该造模方法的稳定性较好并得到了研究者的认可[4]。本研究通过观察造模后大鼠运动功能指数评分(Basso,Beattie & Bresnahan locomotor rating scale,BBB评分)记录大鼠四肢运动功能情况,采用尼氏体焦油染色、实时荧光定量逆转录聚合酶链式反应(quantitative reverse transcription PCR,RT-qPCR)法和免疫组织化学等技术检测受压节段脊髓神经细胞功能形态、脊髓组织中相关mRNA、蛋白表达分布情况,旨在从分子水平探讨益肾养髓方对慢性脊髓压迫后受损脊髓神经修复的干预作用,以期阐明该药治疗CSM的疗效,为下一步深入研究作用机制奠定基础,并为益肾养髓方的临床应用提供实验理论依据。
本研究创新点:
本研究采用吸水膨胀凝胶材料,能够更真实地模拟脊髓型颈椎病患者脊髓慢性受压的病理过程。随后在不同时间点对神经元修复情况进行研究,发现脊髓慢性受压后可能存在一定自我修复,中医药治疗早期能明显提高脊髓中神经营养相关因子的表达,促进脊髓神经元修复,这提示对该病早期治疗的重要性,也为中医药治疗开启了新思路。
待研究的问题:
中医药治疗是如何提高神经营养相关因子表达,及相关因子如何调控下游分子,最终促进脊髓神经元修复的机制有待后续研究探索。
1 材料与方法
1.1 实验动物 于2019年1月选取SPF级雌性SD大鼠96只,240~250 g/只,购于北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2017-0033。大鼠饲养于中国食品药品检定研究院,适应性饲养3 d,室温25 ℃左右,光照时间为8:00~20:00。本研究经中国食品药品检定研究院伦理委员会批准,严格遵守中国食品药品检定研究院实验动物保护和使用规定。
1.2 试剂与仪器 0.9%氯化钠注射液、乙醇、碘伏、青霉素,纯净水、PBS、4%多聚甲醛溶液、2%水合氯醛;尼氏染色液(焦油紫法,Solarbio,货号:G1430),Trizol(Invitrogen,货号:15596018),通用反转录试剂盒M-MLV(Solarbio,货号:RP1100),SYBR Green PCR Mix(Solarbio,货号:SR1110),NGF多克隆抗体(Solarbio,货号:K001636P)、中性树胶(Solarbio,货号:G8590)、柠檬酸钠抗原修复液(Solarbio,货号:C1031)、苏木素染色液(Solarbio,货号:G1080);引物由北京索莱宝科技有限公司设计,由擎科生物合成;刀柄、眼科剪、线剪、有齿镊、无齿镊、持针器、弯钳、直钳、单关节骨剪,购于上海医疗器械(集团)有限公司;不锈钢高压锅、电磁炉、湿盒/孵育盒、电热恒温水浴锅(上海一恒科技有限公司,型号:KH-5000E)、电子天平(Mettler公司,AE160型)、离心机(Eppendorf,型号:5427R)、PCR仪(Thermo,型号:4375786)、组织脱水机(德国Leica公司,型号:ASP200S)、组织包埋机(德国Leica公司,型号:EG1150C)、石蜡切片机(德国Leica公司,型号:RM2245)等;5 ml注射器、三角缝合针、2-0医用真丝缝合线、刀片、医用纱布、棉球。
1.3 中药制备 益肾养髓方药物组成:巴戟天9 g、熟地黄12 g、鹿角霜12 g、白芍12 g、黄芪15 g、桂枝6 g、丹参9 g、鬼箭羽12 g、羌活6 g,购自中国中医科学院望京医院药剂科,中药煎煮后水浴浓缩,用纯净水对浓缩后的药液进行等比稀释,冷藏备用,水煎煮和浓缩程序按照《中国药典》2010版规定执行。大鼠灌胃给药剂量,采用体表面积系数换算,以成人 70 kg,大鼠200 g,换算系数6.3计算[5],高浓度为16.74 g·kg-1·d-1、中浓度为 8.37 g·kg-1·d-1、低浓度为 4.19 g·kg-1·d-1。
1.4 CSM模型建立 采用吸水膨胀材料聚乙烯醇丙烯酰胺互穿网络水凝胶(由北京师范大学化学学院提供)压迫脊髓的方法进行造模[4]。术前采用BBB评分评估大鼠后肢运动功能(正常大鼠为满分21分)。造模:取72只大鼠用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,剃除大鼠颈后部皮毛,常规碘伏消毒、铺巾,大鼠颈椎后正中做一3~4 cm切口,暴露颈肩部肌群,找到第2胸椎棘突,自下往上正中切开肌肉群向两侧牵开,沿棘突两侧剥离棘突上附着肌肉,找到并暴露整个C5~7颈椎骨椎板,剔除C7和T1椎板间黄韧带和部分椎板,从椎板间隙小心将吸水膨胀材料(1.5 mm×0.7 mm×0.3 mm)植入C5~7椎板下,操作要轻柔以防止脑脊液漏出、脊髓损伤。逐层缝合肌肉、皮肤,肌肉注射青霉素8万U/只,术毕。术后2周评价大鼠BBB评分[6],8~14分为造模成功,随机分组以保证灌胃前每组CSM模型大鼠脊髓损伤程度的一致性。
假手术:取24只大鼠采用上述方法暴露C5~7椎板,剔除C7和T1椎板间黄韧带和部分椎板,小心将同体积吸水膨胀材料植入C5~7椎板下后随即取出,不造成脊髓压迫。
术后将大鼠放入鼠笼,于25 ℃左右室温喂养。每日早晚人工挤压膀胱协助排尿,至形成反射性排尿为止,如有死亡及时补充。
1.5 分组 假手术大鼠作为假手术组(n=24),造模成功的大鼠随机分为模型组(n=24)、中药高浓度组(n=16)、中药中浓度组(n=16)、中药低浓度组(n=16)。中药灌胃的各组按照对应浓度进行灌胃,药液浓缩后以1 ml/100 g体积灌胃给药,模型组及假手术组灌服等量(1 ml/100 g)0.9%氯化钠注射液,1次/d。分别于术后4、6、8、10周,评价各组大鼠BBB评分。
1.6 脊髓样本取材 第一次取材于术后2周从假手术组和模型组中每组随机选取8只大鼠,第二次取材于术后6周从5组中每组随机选取8只大鼠,第三次取材于术后10周从5组中每组随机选取8只大鼠。
每个时间点每组随机选取的8只大鼠中,有4只大鼠采用2%戊巴比妥钠(40 mg/kg)腹腔注射进行麻醉,手术剪打开大鼠胸腔,暴露心脏,于左心室靠近心尖搏动处插入灌流针头,注入0.9%氯化钠溶液250 ml,直到肝脏和肺脏颜色转白及右心房流出液体澄清,再使用4%多聚甲醛溶液进行灌注,大鼠出现四肢抽搐、四肢及尾巴僵硬和全身强直现象时停止灌流。取C5~7对应脊髓节段,固定、脱水、透明、石蜡包埋,冠状切片厚约3 mm,用于尼氏染色和免疫组织化学法检测。
每组随机选取的另外4只大鼠,腹腔注射2%戊巴比妥钠(40 mg/kg),处死,取C5~7对应脊髓节段到冻存管后,放置于液氮速冻,随后转入-80 ℃冰箱保存,用于RT-qPCR检测。
1.7 尼氏染色 用二甲苯常规脱蜡15 min,然后梯度乙醇脱水5 min,蒸馏水冲洗3次,5 min/次,然后置于60 ℃温箱用焦油紫染色10 min,蒸馏水洗净染料后,分别置于梯度乙醇中脱水,再用二甲苯透明,最后用中性树胶封片。利用数字扫描仪进行扫描,adimec Q-12A-180Fc相机拍照,用CaseViewer 2.4软件放大400倍观察脊髓前角神经元形态,并计算视野下尼氏染色阳性的正常脊髓前角神经元数量。1.8 RT-qPCR 采用RT-qPCR检测各组大鼠脊髓中神经生长因子(nerve growth factor,NGF)、神经营养因子3(neurotrophin-3,NT3)和胶质细胞源性神经营养因子(glialcellline-derivedneurotrophicfactor,GDNF),以β-actin为内参基因,引物序列信息见表1,将引物离心(转速13 000 rpm,5 min),根据标示量,加入灭菌水至终浓度10 μmol/L,溶解后分装,-20 ℃以下保存备用。组织总RNA提取后,在260/280 nm下测定纯度和浓度(A260/A280=1.8-2.0);核酸电泳检测RNA完整性(28 s、18 s)。根据通用反转录试剂盒M-MLV合成互补DNA。荧光染料采用SYBR Green PCR Mix。配制总反应体系25 μl。反应条件:95 ℃预变性10 min,1个循环;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸20 s,共45个循环。每个指标/样本均做3个技术重复,要求3个重复产生的Ct值偏差不超过0.5。当样本Ct值的偏差超过0.5时,可将明显偏离的孔扣除后计算;当3个孔Ct值的偏差均超过1.0,样本数据不采用。空白孔Ct值要大于35,当Ct值偏小时,数据不采用。样本扩增后的溶解曲线应只有一个峰。Roche lightcycler 480输出原始数据,导出文件。采用2-ΔΔCt计算样本各指标mRNA表达水平。
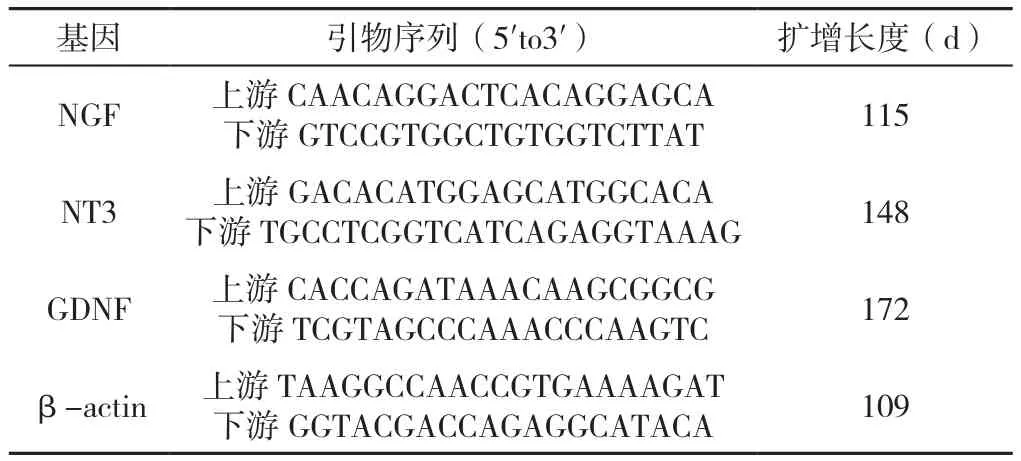
表1 目的基因及内参基因的引物序列Table 1 Primer sequence of target gene and internal reference gene
1.9 免疫组织化学法检测NGF 脊髓前角区蛋白表达及分布情况取大鼠脊髓切片,脱蜡,脱苯,入水,抗原高压修复,孵育,加30 μl NGF一抗,37 ℃孵育90 min,清洗,加二抗,37 ℃孵育30 min,清洗,加DAB显色剂后,在显微镜下控制染色深浅,水洗,衬染,蓝化,脱水,透明,封片。利用数字扫描仪进行扫描,adimec Q-12A-180Fc相机拍照,用CaseViewer 2.4软件放大400倍观察脊髓前角区域。使用IPP 6.0图像分析软件对图像进行分析,测定组织中显示棕色的阳性细胞数,计算平均吸光度值。每个样本分别统计5个视野,结果取均值。
1.10 统计学方法 采用GraphPad Prism 8.0统计软件进行数据分析。正态性检验采用Shapiro-Wilk检验,符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,各组间两两比较采用Tukey法[7-8]。以P<0.05为差异有统计学意义。
2 结果
2.1 BBB评分 术后2周,即灌胃前,5组BBB评分比较,差异有统计学意义(P<0.05);其中假手术组BBB评分高于模型组、中药高浓度组、中药中浓度组和中药低浓度组,差异均有统计学意义(P<0.05);模型组、中药高浓度组、中药中浓度组和中药低浓度组之间的BBB评分两两比较,差异均无统计学意义(P>0.05)。术后4周,即灌胃2周后,5组BBB评分比较,差异有统计学意义(P<0.05);其中假手术组BBB评分高于模型组、中药高浓度组、中药中浓度组和中药低浓度组,差异均有统计学意义(P<0.05);模型组、中药高浓度组、中药中浓度组和中药低浓度组之间的BBB评分两两比较,差异均无统计学意义(P>0.05)。术后6周,即灌胃4周后,5组BBB评分比较,差异有统计学意义(P<0.05);其中假手术组BBB评分高于模型组、中药高浓度组、中药中浓度组和中药低浓度组,差异均有统计学意义(P<0.05);模型组BBB评分低于中药高浓度组,差异有统计学意义(P<0.05);模型组分别与中药中、低浓度组BBB评分比较,差异均无统计学意义(P>0.05);中药高浓度组BBB评分高于中药中、低浓度组,差异均有统计学意义(P<0.05);中药中浓度组与中药低浓度组BBB评分比较,差异无统计学意义(P>0.05)。术后8周,即灌胃6周后,5组BBB评分比较,差异有统计学意义(P<0.05);其中假手术组BBB评分高于模型组、中药高浓度组、中药中浓度组和中药低浓度组,差异均有统计学意义(P<0.05);模型组BBB评分低于中药高浓度组,差异有统计学意义(P<0.05);模型组分别与中药中、低浓度组BBB评分比较,差异均无统计学意义(P>0.05);中药高浓度组BBB评分高于中药中、低浓度组,差异均有统计学意义(P<0.05);中药中浓度组与中药低浓度组BBB评分比较,差异无统计学意义(P>0.05)。术后10周,即灌胃8周后,5组BBB评分比较,差异有统计学意义(P<0.05);其中假手术组BBB评分高于模型组、中药高浓度组、中药中浓度组和中药低浓度组,差异均有统计学意义(P<0.05);模型组BBB评分低于中药高、中浓度组,差异均有统计学意义(P<0.05);模型组与中药低浓度组BBB评分比较,差异无统计学意义(P>0.05);中药高浓度组BBB评分高于中药中、低浓度组,差异均有统计学意义(P<0.05);中药中浓度组与中药低浓度组BBB评分比较,差异无统计学意义(P>0.05),见表2。
表2 五组大鼠肢体运动功能指数评分比较(±s,分)Table 2 Comparison of Basso,Beattie & Bresnahan locomotor rating scale scores of motor function of the five groups of rats
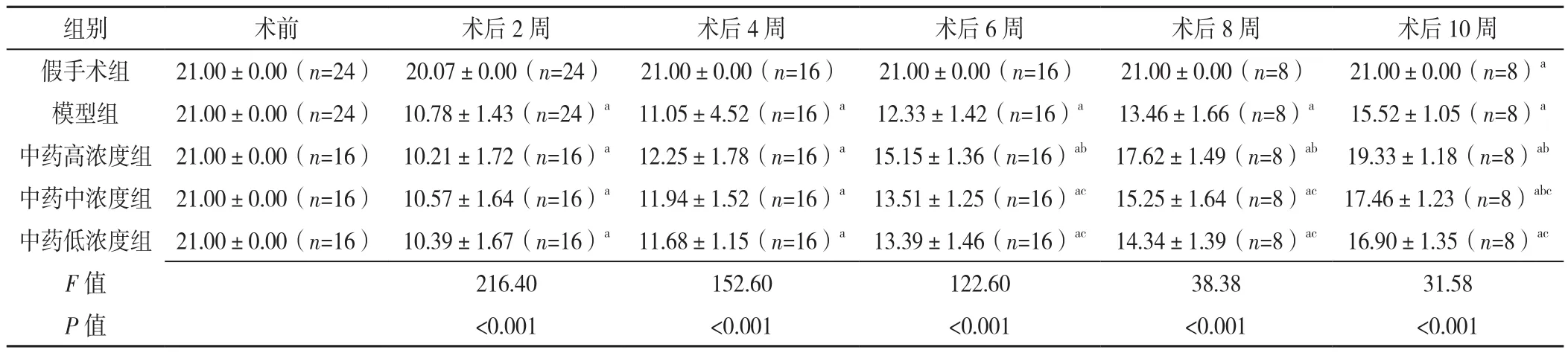
表2 五组大鼠肢体运动功能指数评分比较(±s,分)Table 2 Comparison of Basso,Beattie & Bresnahan locomotor rating scale scores of motor function of the five groups of rats
注:a表示与假手术组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与中药高浓度组比较,P<0.05
组别 术前 术后2周 术后4周 术后6周 术后8周 术后10周假手术组 21.00±0.00(n=24) 20.07±0.00(n=24) 21.00±0.00(n=16) 21.00±0.00(n=16) 21.00±0.00(n=8) 21.00±0.00(n=8)a模型组 21.00±0.00(n=24) 10.78±1.43(n=24)a 11.05±4.52(n=16)a 12.33±1.42(n=16)a 13.46±1.66(n=8)a 15.52±1.05(n=8)a中药高浓度组 21.00±0.00(n=16) 10.21±1.72(n=16)a 12.25±1.78(n=16)a 15.15±1.36(n=16)ab 17.62±1.49(n=8)ab 19.33±1.18(n=8)ab中药中浓度组 21.00±0.00(n=16) 10.57±1.64(n=16)a 11.94±1.52(n=16)a 13.51±1.25(n=16)ac 15.25±1.64(n=8)ac 17.46±1.23(n=8)abc中药低浓度组 21.00±0.00(n=16) 10.39±1.67(n=16)a 11.68±1.15(n=16)a 13.39±1.46(n=16)ac 14.34±1.39(n=8)ac 16.90±1.35(n=8)ac F值 216.40 152.60 122.60 38.38 31.58 P值 <0.001 <0.001 <0.001 <0.001 <0.001
2.2 尼氏染色 染色切片中可见颗粒状的小神经元和斑块状脊髓运动神经元中的尼氏体嗜碱性物质被染成浅紫色,散在均匀分布于核周细胞质及树突内,而轴突内缺失。脊髓前角中正常运动神经元胞体较大且成多边形,尼氏体数目较多,代谢合成旺盛,通过尼氏染色可清晰反映其数量和细胞功能。术后2周,即灌胃前,假手术组脊髓前角运动神经元形态正常,无损伤,可见大量虎斑状尼氏体,丰富饱满;模型组脊髓前角神经元细小,细胞形态由多极形状变为圆形,分布稀疏,并形成较多空洞,细胞内尼氏体溶解减少甚至消失;在术后6周、10周时,中药高、中浓度组脊髓前角神经元虽有一定程度损伤,但细胞形态丰满、可见细胞内虎斑状尼氏体;中药低浓度组脊髓前角可见少量空泡,神经元细胞分布略稀疏,单个细胞内尼氏体数目比中药高、中浓度组含量少,见图1。
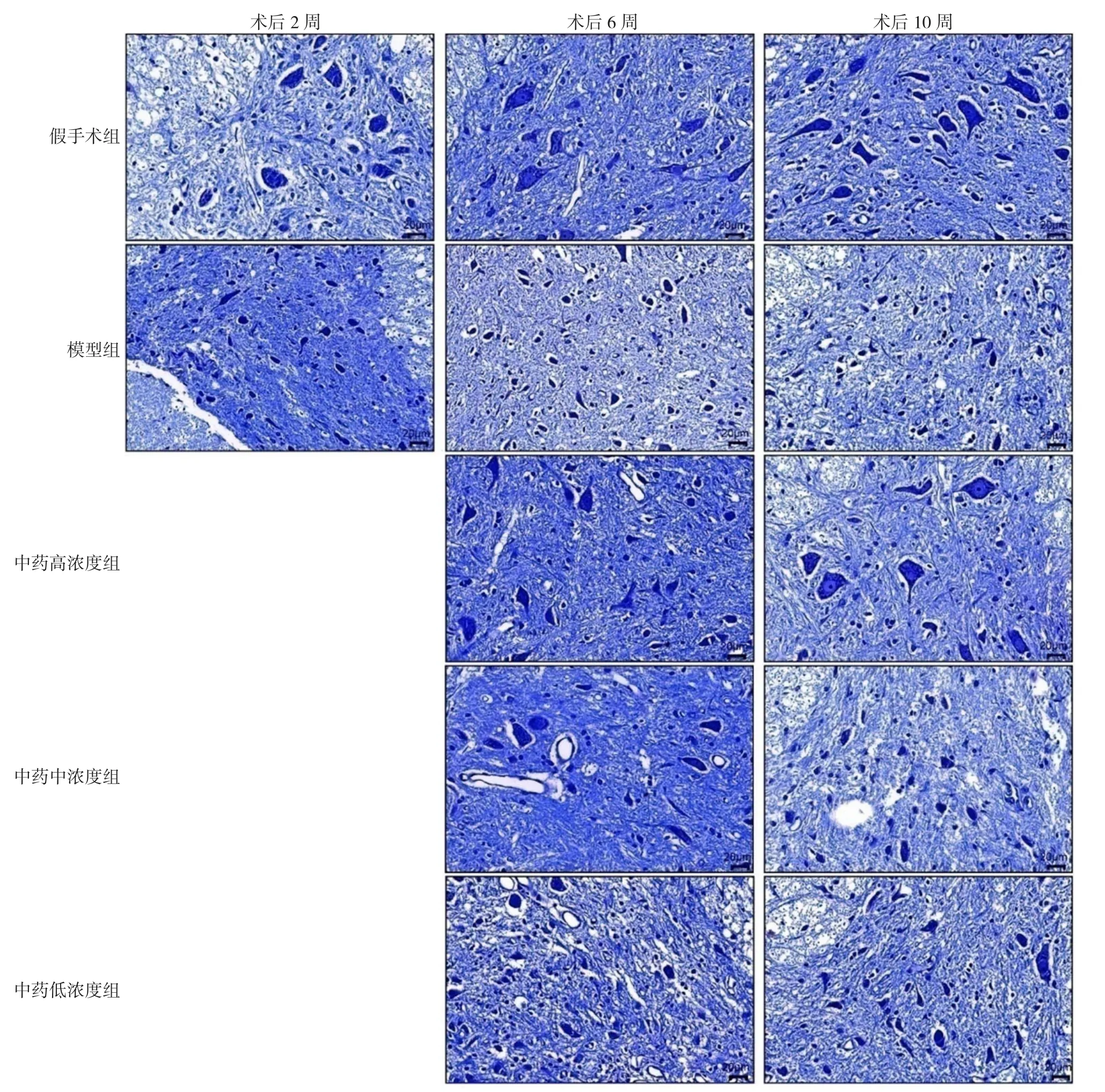
图1 不同时间点各组大鼠脊髓前角尼氏染色(×400,n=4)Figure 1 Nissl's staining results of anterior horn of spinal cord in rats at different time points
术后2周,假手术组正常神经元数目多于模型组,差异有统计学意义(P<0.05)。术后6周,5组正常神经元数目比较,差异有统计学意义(P<0.05);其中假手术组正常神经元数目多于模型组、中药中浓度组和中药低浓度组,差异有统计学意义(P<0.05);假手术组正常神经元数目与中药高浓度组比较,差异无统计学意义(P>0.05);模型组正常神经元数目少于中药高浓度组,差异有统计学意义(P<0.05);模型组正常神经元数目分别与中药中、低浓度组比较,差异均无统计学意义(P>0.05);中药高浓度组正常神经元数目多于中药低浓度组,差异均有统计学意义(P<0.05);中药高浓度组正常神经元数目与中药低浓度组比较,差异无统计学意义(P>0.05);中药中浓度组正常神经元数目与中药低浓度组比较,差异无统计学意义(P>0.05)。术后10周,5组正常神经元数目比较,差异有统计学意义(P<0.05);其中假手术组正常神经元数目多于模型组、中药低浓度组,差异有统计学意义(P<0.05);假手术组正常神经元数目与中药高、中浓度组比较,差异均无统计学意义(P>0.05);模型组正常神经元数目少于中药高浓度组,差异有统计学意义(P<0.05);模型组正常神经元数目分别与中药中、低浓度组比较,差异均无统计学意义(P>0.05);中药高浓度组正常神经元数目与中药中、低浓度组比较,差异均无统计学意义(P>0.05);中药中浓度组正常神经元数目与中药低浓度组比较,差异无统计学意义(P>0.05),见表3。
表3 五组大鼠脊髓前角神经元数目比较(±s,n=4)Table 3 The number of healthy neurons positive for Nissl's stain in the anterior horn of the spinalcord of the five groups of rats
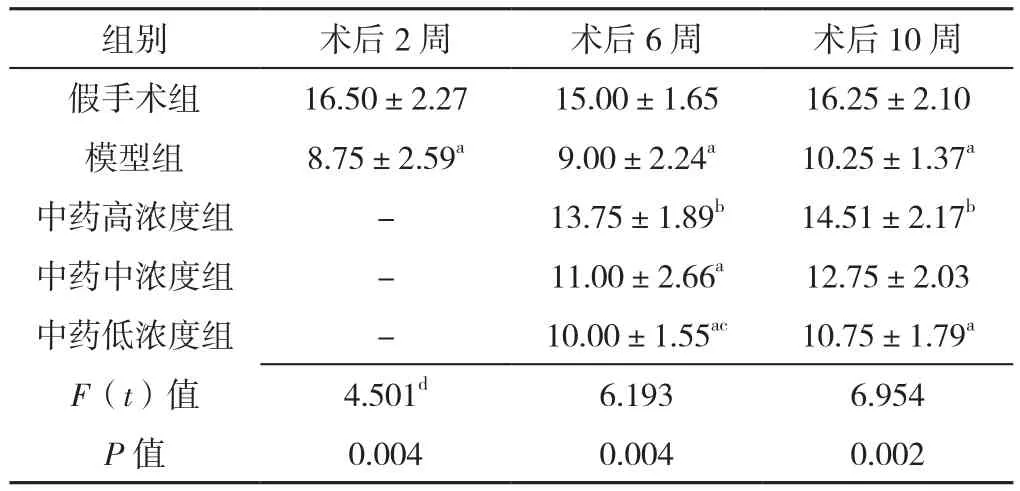
表3 五组大鼠脊髓前角神经元数目比较(±s,n=4)Table 3 The number of healthy neurons positive for Nissl's stain in the anterior horn of the spinalcord of the five groups of rats
注:a表示与假手术组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与中药高浓度组比较,P<0.05;d表示t值;-表示无相关数据
组别 术后2周 术后6周 术后10周假手术组 16.50±2.27 15.00±1.65 16.25±2.10模型组 8.75±2.59a 9.00±2.24a 10.25±1.37a中药高浓度组 - 13.75±1.89b 14.51±2.17b中药中浓度组 - 11.00±2.66a 12.75±2.03中药低浓度组 - 10.00±1.55ac 10.75±1.79a F(t)值 4.501d 6.193 6.954 P值 0.004 0.004 0.002
2.3 RT-qPCR结果 术后2周,即灌胃前,假手术组与模型组的NGF、NT3、GDNF的mRNA表达水平比较,差异无统计学意义(P>0.05)。术后6周,5组NGF mRNA表达水平比较,差异有统计学意义(P<0.05);中药高浓度组NGF mRNA表达水平高于假手术组、模型组和中药低浓度组,差异均有统计学意义(P<0.05),其他组间比较差异均无统计学意义(P>0.05)。5组NT3 mRNA表达水平比较,差异有统计学意义(P<0.05);中药高浓度组NT3 mRNA表达水平高于模型组,差异有统计学意义(P<0.05),其他组间比较差异均无统计学意义(P>0.05)。5组GDNF mRNA表达水平比较,差异有统计学意义(P<0.05);中药高浓度组GDNF mRNA表达水平高于假手术组、模型组和中药中、低浓度组,差异均有统计学意义(P<0.05),其他组间比较差异均无统计学意义(P>0.05)。术后10周,5组NGF、NT3、GDNF的mRNA表达水平比较,差异无统计学意义(P>0.05),见表4。
表4 五组大鼠NGF、NT3、GDNF的mRNA表达水平比较(±s,n=4)Table 4 Comparison of mRNA of NGF,NT3 and GDNF of the five groups of rats
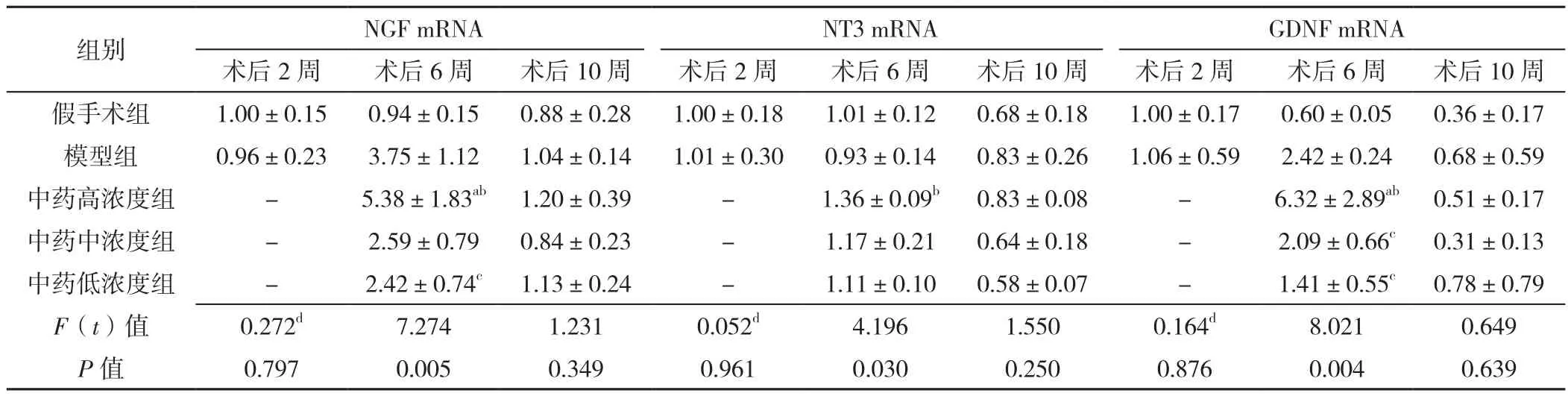
表4 五组大鼠NGF、NT3、GDNF的mRNA表达水平比较(±s,n=4)Table 4 Comparison of mRNA of NGF,NT3 and GDNF of the five groups of rats
注:a表示与假手术组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与中药高浓度组比较,P<0.05;d表示t值;-表示无相关数据
组别 NGF mRNA NT3 mRNA GDNF mRNA术后2周 术后6周 术后10周 术后2周 术后6周 术后10周 术后2周 术后6周 术后10周假手术组 1.00±0.15 0.94±0.15 0.88±0.28 1.00±0.18 1.01±0.12 0.68±0.18 1.00±0.17 0.60±0.05 0.36±0.17模型组 0.96±0.23 3.75±1.12 1.04±0.14 1.01±0.30 0.93±0.14 0.83±0.26 1.06±0.59 2.42±0.24 0.68±0.59中药高浓度组 - 5.38±1.83ab 1.20±0.39 - 1.36±0.09b 0.83±0.08 - 6.32±2.89ab 0.51±0.17中药中浓度组 - 2.59±0.79 0.84±0.23 - 1.17±0.21 0.64±0.18 - 2.09±0.66c 0.31±0.13中药低浓度组 - 2.42±0.74c 1.13±0.24 - 1.11±0.10 0.58±0.07 - 1.41±0.55c 0.78±0.79 F(t)值 0.272d 7.274 1.231 0.052d 4.196 1.550 0.164d 8.021 0.649 P值 0.797 0.005 0.349 0.961 0.030 0.250 0.876 0.004 0.639
2.4 免疫组织化学结果 术后2、6、10周的假手术组和模型组中脊髓前角神经元NGF染色程度较浅,呈弥漫性稀疏分布;中药高、中浓度组大鼠的脊髓前角神经元NGF染色较明显,细胞形态完整,见图2。大鼠术后2周时,即灌胃前,假手术组与模型组的大鼠脊髓前角神经元NGF平均积分光密度值比较,差异无统计学意义(P>0.05)。术后6周,5组NGF平均积分光密度值比较,差异有统计学意义(P<0.05);中药高浓度组NGF平均积分光密度值高于假手术组和模型组,差异均有统计学意义(P<0.05),其他组间比较差异均无统计学意义(P>0.05)。术后第10周,5组NGF平均积分光密度值比较,差异无统计学意义(P>0.05),见表5。
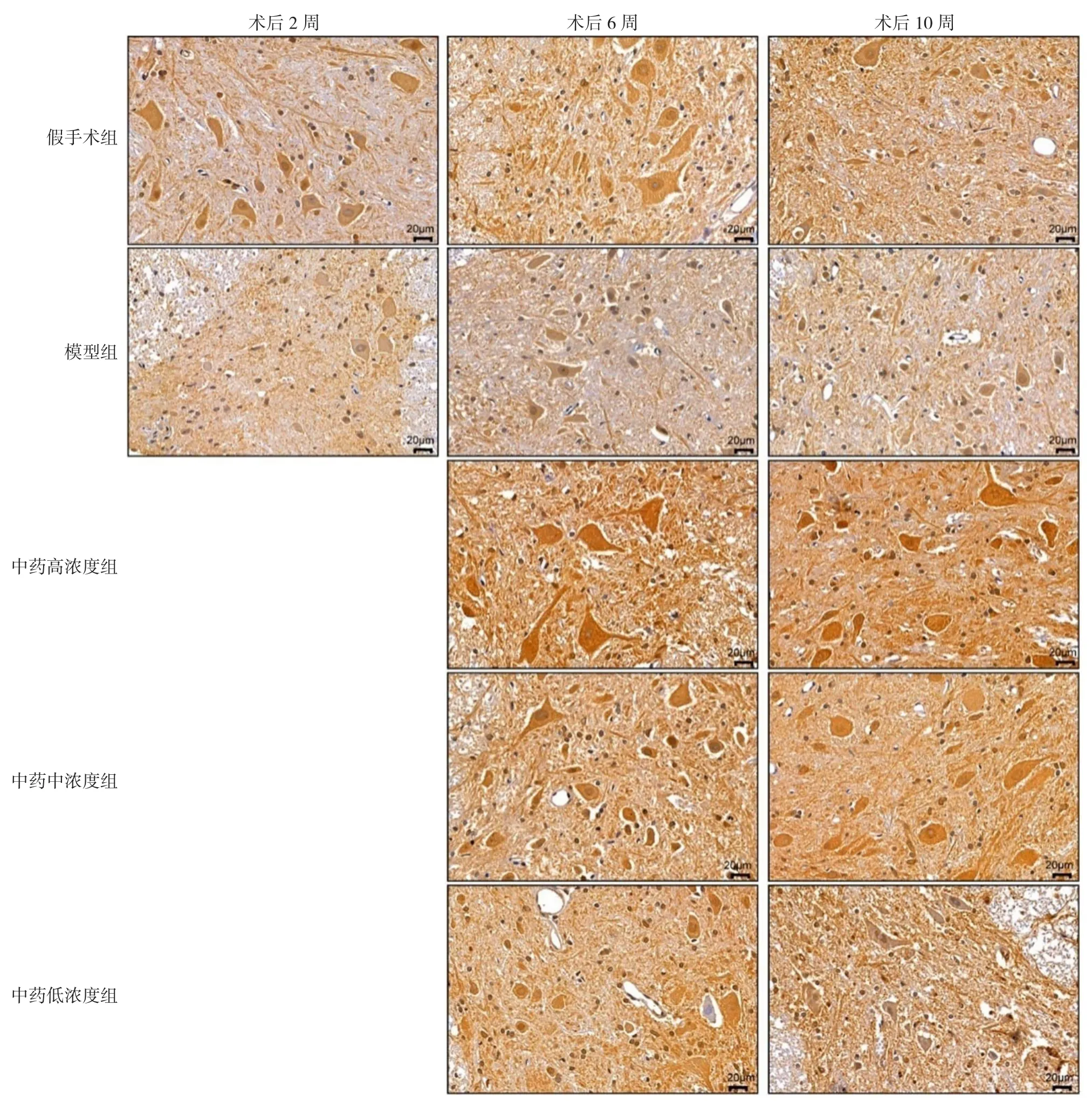
图2 不同时间点各组大鼠脊髓前角NGF免疫组织化学染色结果(×400,n=4)Figure 2 Immunohistochemistry results of NGF in the anterior horn of spinal cord of rats at different time points
表5 五组大鼠NGF平均积分光密度值比较(±s,n=4)Table 5 Comparison of mean integrated optical density of NGF of the five groups of rats
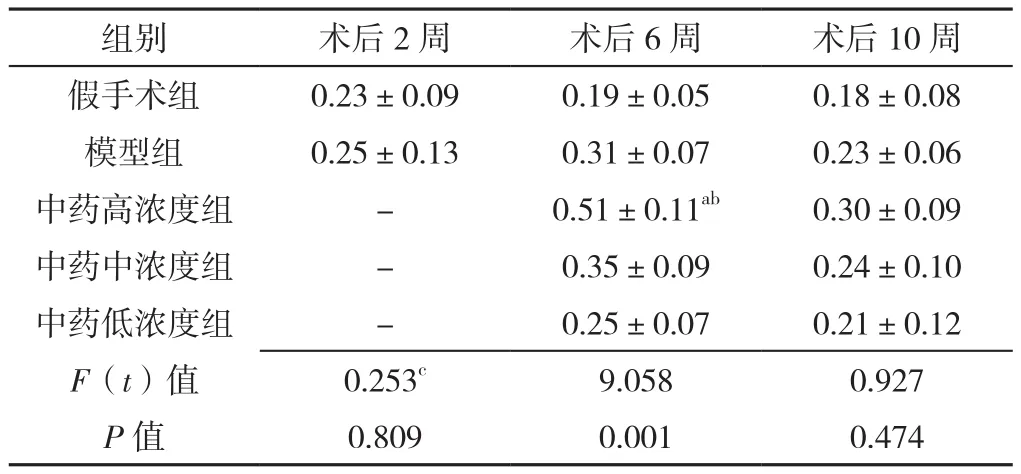
表5 五组大鼠NGF平均积分光密度值比较(±s,n=4)Table 5 Comparison of mean integrated optical density of NGF of the five groups of rats
注:a表示与假手术组比较,P<0.05;b表示与模型组比较,P<0.05;c表示t值;-表示无相关数据
组别 术后2周 术后6周 术后10周假手术组 0.23±0.09 0.19±0.05 0.18±0.08模型组 0.25±0.13 0.31±0.07 0.23±0.06中药高浓度组 - 0.51±0.11ab 0.30±0.09中药中浓度组 - 0.35±0.09 0.24±0.10中药低浓度组 - 0.25±0.07 0.21±0.12 F(t)值 0.253c 9.058 0.927 P值 0.809 0.001 0.474
3 讨论
结合古籍及现代医家对CSM的认识,该病当从“痹证”和“痿证”辨证论治[9],根本病机是本虚标实,肝肾不足、气血亏虚为本,外邪侵袭、经络不通、风寒湿邪客居于经脉为标[10-12]。益肾养髓方由巴戟天、熟地、丹参、鬼箭羽等9味药物组成,其中巴戟天补肾温阳、强筋壮骨,熟地补血滋阴、益精填髓,二者合而为君;丹参、鬼箭羽等活血通经、通络止痛、畅督脉经气,使药力达于颈部。从CSM“本虚标痹”的病机出发,共奏补肝益肾、活血通经之效。
本研究动物行为学评价结果显示,益肾养髓方能较好的改善大鼠四肢运动功能,增加步态动作协调性,在灌胃4周时疗效开始显现,在灌胃8周后效果更为明显,且中药高浓度组的改善效果最为显著。尼氏体由粗面内质网和游离核糖体组成,其功能是合成更新细胞器所需的结构蛋白、合成神经递质所需的酶类以及肽类的神经调质。代谢功能旺盛的神经元中尼氏体特别丰富,当神经元受到损伤或过度疲劳时,尼氏体可减少、解体甚至消失。在损伤或疲劳恢复过程中,尼氏体又重新出现、增多,并可至正常水平,故尼氏体可作为神经元功能状态的标志[13-15]。本研究尼氏焦油紫染色结果显示,中药高、中浓度组可以有效增加脊髓前角正常神经元的数量,同时提高神经元细胞内尼氏体数量,提示中药能增强细胞代谢和蛋白质合成的能力,与动物行为学结果一致。动物行为学和尼氏焦油紫染色结果均提示高、中浓度的益肾养髓方能起到保护脊髓前角运动神经元细胞、改善运动功能的作用。
NGF、NT3、GDNF是促进脊髓修复较为经典的神经营养因子,中药增加神经元数量可能与促进神经营养因子的分泌有关。NGF是神经营养因子中目前研究最明确的分子之一,当神经元受到机械刺激、缺血缺氧时,NGF增加并作用于含有相关受体的神经元细胞,使脊髓损伤后的神经再生、组织重塑和功能恢复[16],对于延缓神经退行性病变,或者刺激脊髓损伤患者运动神经的生长,其效果尤为显著,已有研究证实NGF是治疗受损中枢神经系统神经再生的有效药物[17]。NT3与NGF的氨基酸序列类似,其能作用于皮质脊髓束,促进细胞轴突生长,提高运动行走的能力,且不会刺激感觉神经元产生疼痛相关反应[18-20]。GDNF是很强的胆碱能运动神经营养因子,其能促进神经元的轴突生长,减少神经元凋亡。在用损伤诱导的脊髓运动神经元退变模型中,用GDNF治疗可防止50%神经元的丢失,且使运动神经元体积增大,起到支持神经元存活的作用[21-23]。众多研究报道中药复方或中药单体可以提高NGF、NT3、GDNF水平,达到促进脊髓神经修复的作用[24-28]。本研究RT-qPCR和免疫组织化学结果显示,造模后第2周到第10周,模型组、假手术组NGF的mRNA表达处于较低水平,其中第4周模型组比假手术组水平稍高,但不显著。在益肾养髓方灌胃4周时,中药高浓度组能显著提高脊髓中NGF的mRNA表达水平,同时也能促进的NGF蛋白表达增加,特别是脊髓前角中大神经元更为显著。但在灌胃8周时,NGF的mRNA表达又回落到较低水平,NT3和GDNF的mRNA表达情况也与NGF类似。这提示大鼠自身针对外界的机械损伤有一定程度的自我修复作用,但并不明显,中药干预后能显著增加神经元的自我修复功能,刺激神经元生长,进而缓解慢性压迫脊髓造成的病变;在中药干预后期,中药组NGF、NT3、GDNF的mRNA表达降低,并与假手术组趋于一致,这可能是脊髓内的修复过程基本完成,大鼠运动功能和神经元细胞的数量和形态已有较大改善,故脊髓中相关神经营养因子的需求和合成有所降低,也间接提示脊髓型颈椎病早期治疗干预的意义较大。
综上所述,益肾养髓方可明显改善CSM模型大鼠的四肢运动功能,增加脊髓前角中正常功能运动神经元的数量。同时显著增加脊髓中NGF、NT3、GDNF的mRNA表达水平,以及脊髓前角神经元中NGF的蛋白表达水平,进而达到促进神经修复的作用。
作者贡献:陈忻、朱立国进行研究思路设计并对文章负责;唐彬进行研究实施、资料收集整理、撰写论文;银河进行研究的质量控制及审校;杨博文、金哲峰、秦晓宽、刘志伟、魏戌、孙凯、齐宝玉参与动物实验实施评估、技术操作和资料收集。
本文无利益冲突。



