洪子强,金大成,白向豆,崔百强,苟云久*
肺癌是全球癌症相关死亡的主要原因[1]。随着CT 在肺癌筛查中的广泛应用,多原发肺癌(multiple primary lung cancer,MPLC)的检出率逐渐增加[2]。MPLC 根据病变发生的时间分为同时性MPLC(synchronous MPLC,sMPLC)和异时性MPLC(metachronous MPLC,mMPLC)两种类型[3]。尽管有既定的标准,但鉴别MPLC 与肺内转移(intrapulmonary metastasis,IM)仍具有挑战性,这也是胸外科医生和病理科医生长期面临的难题[4-5]。近年来,随着新技术的发展,下一代测序技术(next generation sequencing,NGS)在MPLC 的诊断和治疗中发挥重要作用。本研究将探讨MPLC 诊断与治疗的最新进展,以期为临床实践提供参考。
1 检索策略
计算机检索PubMed、EMBase、Cochrane Library、Web of Science、万方数据知识服务平台、维普网和中国知网(CNKI)数据库的相关文献,检索时重点关注近5 年发表的文献。英文检索词包括“multiple primary lung cancer”“diagn osis”“surgery”“stereotactic ablative radiotherapy”“targeted therapy”“immunotherapy”,中文检索词包括“多原发肺癌”“诊断”“手术治疗”“立体定向治疗”“靶向治疗”“免疫疗法”,同时追溯纳入文献的参考文献。纳入标准:与本研究主题有关的临床试验研究、指南/共识、Meta 分析/系统评价、评论、随机对照试验、图书和文件。排除标准:重复发表和质量较差的文献。
2 诊断标准
1975 年,MARTINI 等[6]基于肿瘤部位和主要病理学类型建立了MPLC 的临床病理学诊断标准(即M-M 标准)。2003 年,美国胸科 医师协会(American College of Chest Physicians,ACCP)发布了MPLC 的诊断标准[7],该标准考虑了癌症的分子遗传学特征,并将无瘤间期延长至4 年以诊断sMPLC。2017 年发布的第8 版TNM 分期系统对sMPLC 的临床诊断标准和病理学诊断标准进行了分类,同时在该分期系统中第一次把综合组织学评估(comprehensive histologic assessment,CHA)作为MPLC 的诊断标准[8]。CHA 即对肿瘤每一种组织学亚型的百分比进行计算,评估肿瘤组织学分级、细胞形态和肿瘤间质病理学特征,这种方法可以更好地鉴别诊断MPLC 与IM[9]。尽管目前还没有全球公认的标准,但sMPLC 和mMPLC 的三种常见诊断标准已在临床实践中广泛使用[6-8],见表1。

表1 MPLC 的三种常见诊断标准Table 1 Three common diagnostic criteria for multiple primary lung cancer
3 鉴别诊断
3.1 MPLC 和IM 的基因组学与分子学区别 MPLC 基因组学研究已有20 多年历史。早期基因组学研究多集中在MPLC 和IM 鉴别方面。1995 年,ANTAKLI 等[10]在MPLC 与转移癌的鉴别诊断中纳入了DNA 倍体类型差异和p53 基因突变的同源性分析,由此开启了基于基因分析对MPLC 与IM 鉴别的先河。ASMAR 等[11]通过比较表皮生长因子受体(epidermal growth factor receptor,EGFR)、大鼠肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)、V-Raf鼠肉瘤病毒癌基因同源物B1(V-raf murine sarcoma viral oncogene homolog B1,BRAF)和间变淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因的突变情况,用以鉴别MPLC 和IM。另外有研究提出利用染色体位点杂合性缺失(loss of heterozygosity,LOH)分析、比较基因组杂交技术(comparative genomic hybridization,CGH)和基于识别基因组上拷贝数变化的比较基因组杂交技术进行鉴别诊断的思路,但其均有各自的局限性,如灵敏度和特异度无法保证,以及无可靠方法对其结果进行验证等[12]。尽管有个别研究利用预后差异对其基因分析的鉴定结果进行反向验证,但样本量较小,说服力不强[13]。目前,仅梅奥诊所的一项研究中利用基因重排对MPLC 和IM进行鉴别诊断,且得出了相对满意的结果[14]。
许多研究探讨了分子分析方法在MPLC 和IM 中的应用,包括DNA 微卫星分析、TP53 突变分析、致癌驱动热点突变检测、基因组断点分析,以及NGS[15-16]。目前利用NGS 面板进行基因组图谱分析已广泛应用于肺癌的临床诊断中。NGS 能够同时研究许多基因突变,包括致癌驱动基因突变和其他共同发生的突变。致癌驱动基因突变中的不同突变谱表明不同的克隆起源;然而,相同驱动基因突变的存在并不一定表明肿瘤的克隆起源相同。共同的遗传背景和环境暴露可能导致多个独立的原发性肺癌具有相同的KRAS 或EGFR 突变[16]。因此,对一小部分致癌驱动基因突变的测试并不足以区分MPLC 和IM。使用大规模NGS 面板的研究通常可以很好地区分MPLC 和IM。一项研究使用大规模NGS 试验来分析肺癌的分子改变,发现MPLC 表现为完全不重叠,且具有独特的基因突变;IM 是多个(≥2)基因突变的肿瘤;对于单一基因突变的肿瘤,不同原发性肺癌和IM 的区分是通过在个体基础上的扩展分子检查得出的[15]。研究还发现,一个全面的NGS 检测可以明确区分MPLC 和IM,然而在22%的病例中,组织学解释与NGS 不一致[15]。尽管与IM 相比,MPLC 分子分类的最佳方法尚不清楚,但这些结果强调了分子分析的重要性。
3.2 MPLC 和IM 的组织学区别 MPLC 与IM 之间的组织学区分具有挑战性。组织学特征在一些情况下有助于鉴别MPLC和IM。(1)不同组织学类型的肿瘤,如鳞癌和腺癌,被认为是不同的原发肿瘤。(2)多灶性原位腺癌、微浸润腺癌、贴壁腺癌也被认为是不同的原发肿瘤[4]。(3)具有前体病变或原位癌成分的肿瘤,例如伴有邻近原位鳞癌或伴有贴壁细胞的腺癌,通常被认为是不同的原发性肺癌[17]。然而,应该谨慎使用这些标准。因为在一些腺癌中,鳞状结构可能代表侵袭性肿瘤的生长,而不是前体病变[15,18]。此外,贴壁成分的存在,特别是存在于有限区域时,并不排除IM 的可能性。(4)对于浸润性黏液腺癌,最近的分子研究表明,大部分独立的肺浸润性黏液腺癌均来自单个肿瘤的IM[19]。(5)对于侵袭性非黏液腺癌,目前美国癌症联合委员会的分期系统建议使用CHA 来区分MPLC 和IM[4]。国际肺癌病理研究协会最近进行的一项研究调查了病理医生应用此方法的能力和可重复性,结果显示,病理医生在评估MPLC 与IM 时存在良好的观察者间一致性,Cohen kappa 统计量为0.596,总体一致性为81%[17]。然而,这种一致性并不“完美”。因为,多达25.5%的病例可能被视为“不确定”,即不属于MPLC或IM[15]。以上结果表明需要改进目前基于组织学的分类方法。
3.3 MPLC和IM的蛋白表达谱区别 在组织学匹配的情况下,为了鉴别MPLC 与IM,可以运用另一种方法,即在组织学相同的肿瘤中研究蛋白表达谱的差异。假设IM 中蛋白质表达的差异较小(因为它们共享克隆起源),而MPLC 中蛋白质表达的差异较大(由于其克隆起源不同)。ONO 等[20]评估了MPLC 和IM 中4 种癌症相关基因产物(p53、p16、p27 和c-erbB2)在样本中表达率的差异,发现在IM 患者中4 种蛋白质表达率的差异在90%以内,而在单独的原发肿瘤中超过90%,这一结果确认上述假设成立。由于这方面的研究尚缺乏,未来希望有更多蛋白表达谱方面的研究进行验证。
3.4 MPLC 和IM 的影像学区别 胸部CT 或正电子发射型计算机断层显像-CT(positron emission computed tomography,PET-CT)是目前术前鉴别MLPC 和IM 的主要方法,临床医生常通过多个病灶的形态、肿瘤倍增时间等综合判断,MPLC的病灶在CT 上以磨玻璃成分多见,而IM 以实性结节为主[21]。但需警惕多发磨玻璃结节(GGN)的部分病灶可能是IM,LI等[22]研究对两例影像学表现为GGN 的多灶肺腺癌肿瘤组织及癌旁组织进行全外显子测序,结果发现部分GGN 为同一克隆起源。另外PET-CT 可用于辨别MPLC 与IM,DIJKMAN 等[23]通过计算患者肿瘤的标准摄取值(SUV)差异值(difference between SUVs,ΔSUV)发现,sMPLC 患者的ΔSUV 明显高于转移患者。最近,SUH 等[24]提出一种结合临床及影像数据的算法模型,包括CT 上病灶类型〔2 个病灶是纯GGN 或以肺内磨玻璃密度影(ground glass opacity,GGO)为主的结节〕、病变形态(结节是否有毛刺或空气支气管征)、病灶的最大SUV(SUVmax)及是否存在N2/N3 淋巴结转移和远处转移,结果显示该模型可以区分出93.7%的病例,诊断准确性达到88.9%。综合影像学评估见图1。
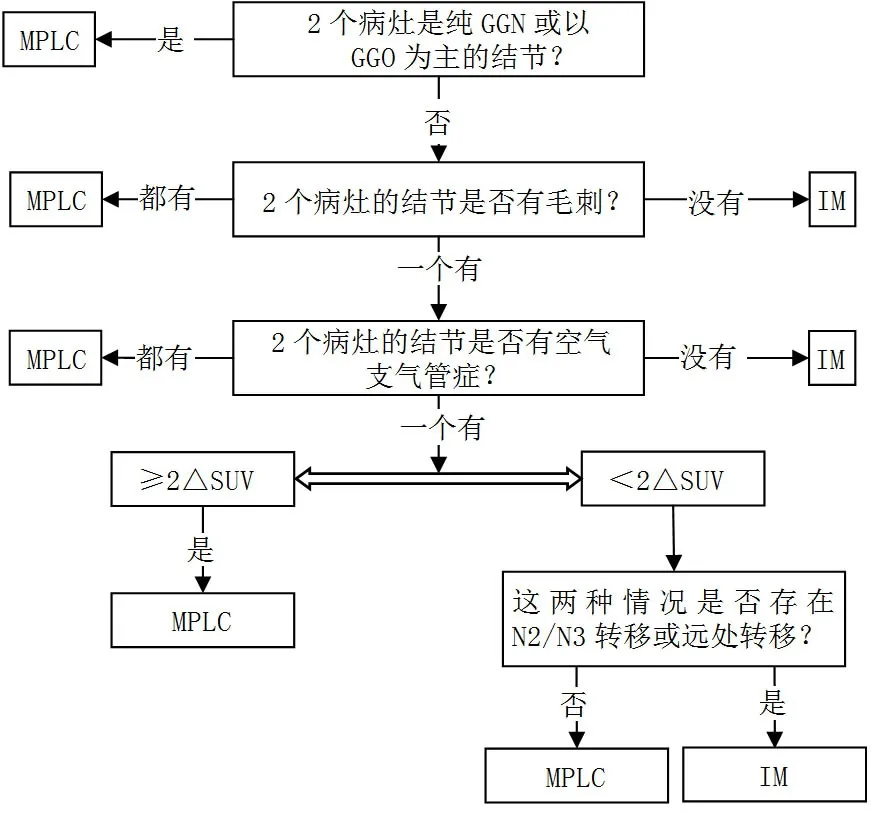
图1 综合影像学评估流程图Figure 1 Flow chart for comprehensive imaging assessment of multiple primary lung cancer
4 治疗
4.1 外科治疗
4.1.1 手术切除范围的选择 MPLC 的处理应基于多学科团队的配合,并完善检查以排除N2~3 或M1b 期疾病。治疗前应进行纵隔分期和影像学检查。ACCP 推荐手术作为MPLC 的首选治疗方式,但对MPLC 的最佳手术策略仍有争议[7]。在最近的十几年中,很多学者在努力探索MPLC 的最佳手术选择,见表2。
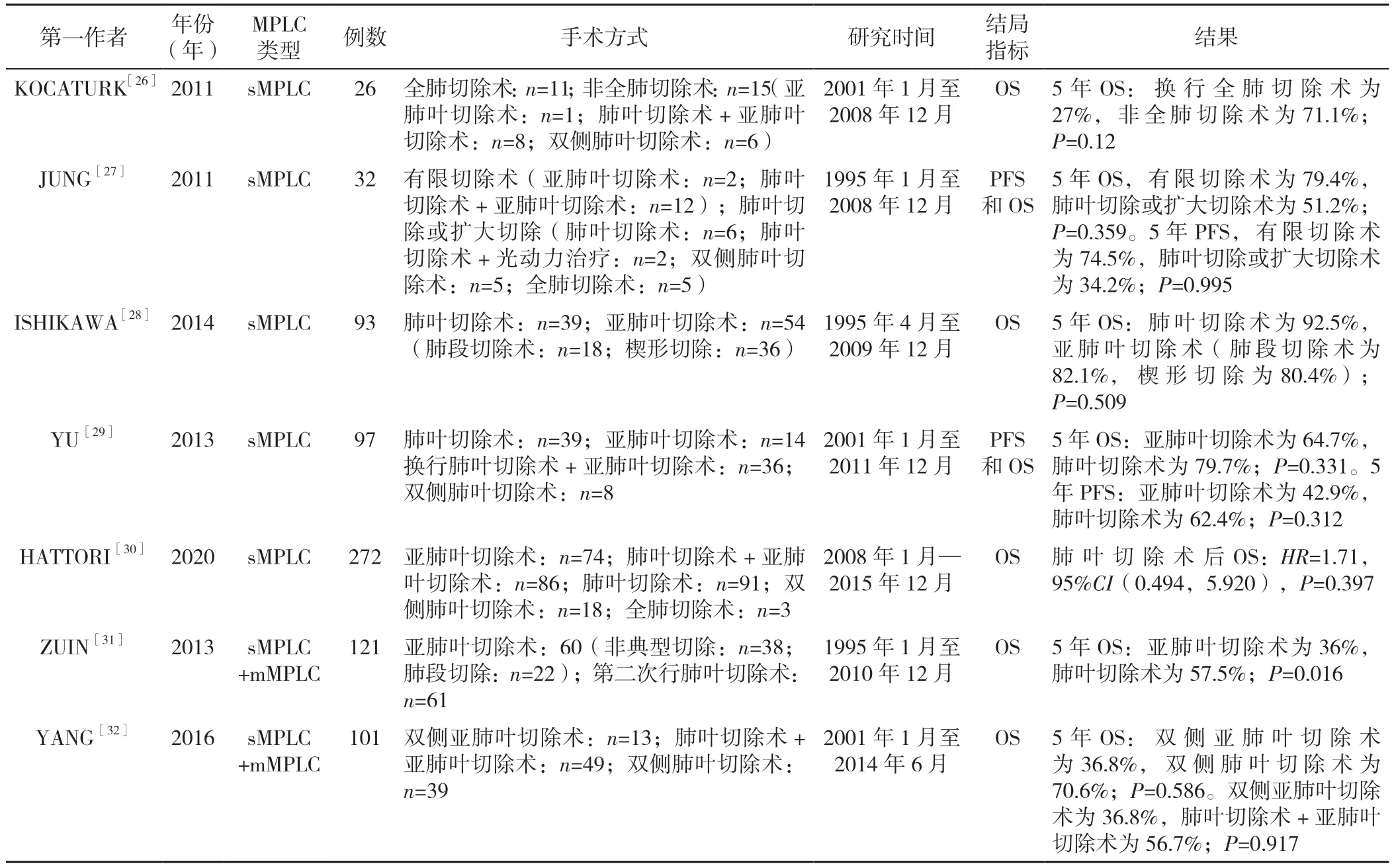
表2 MPLC 的切除方法及疗效研究Table 2 Studies on the resection methods and outcomes of multiple primary lung cancer
有研究对26例接受手术治疗的sMPLC 患者的生存情况进行分析发现,行全肺切除术的患者生存质量较差,行亚肺叶切除术的患者生存质量较好[25]。故要综合评估肿瘤的大小、肿瘤的实变直径、肿瘤的数目、患者的肺功能等来选择手术方式,在sMPLC 患者中,由于患者的心肺功能较差,常需要选择有限切除(亚肺叶切除术、肺段切除术)[26]。若患者不适合手术治疗,则应考虑放疗等其他治疗方式。对于高龄和有潜在并发症的患者,手术方式的选择很重要,不合理的手术方式可能导致生存率低或手术死亡率增加。ISHIKAWA 等[27]分析了93例sMPLC 患者,多因素Cox 回归分析发现,肿瘤的双侧分布(P=0.031)、淋巴结转移(P=0.004)和亚肺叶切除(P=0.042)是不良预后的重要独立预测因子。YU 等[28]回顾了97例sMPLC 患者的生存结局,接受亚肺叶切除术和肺叶切除术的患者在5 年生存率(64.7%和79.7%,P=0.331)及5 年无进展生存率(42.9%和62.4%,P=0.312)方面没有显著差异。有限切除并不是生存的一个重要预后因素,并且没有观察到扩大切除比肺叶切除术有更好的预后结果。虽然已有多篇文章表明,早期MPLC 患者可接受有限切除,但由于纳入的病例数有限,结果仍存在争议[3,29]。因此,为了进行更准确的手术评估,需要有经验的多学科团队对有限切除的疗效做出综合性分析。
4.1.2 sMPLC 与mMPLC的区别对于sMPLC 与mMPLC 的治疗,ZUIN 等[30]通过分析23例(19%)sMPLC 患者和98例(81%)mMPLC 患者的治疗效果发现,对于MPLC 的治疗,肺叶切除患者的5 年生存率优于亚肺叶切除者(分别为57.5%和36%,P=0.016),且全肺切除术只能在特定的患者中进行;此外,mMPLC 组的5 年生存率显著优于sMPLC 组(分别为83%和40%,P=0.02)。相比之下,一项针对101例Ⅰ期MPLC 患者的研究显示了有限切除手术的有效性[31](表2)。与mMPLC 患者相比,sMPLC 患者的生存率并没有降低,这与之前的Meta 分析结果一致[32]。KANG 等[33]研究表明,对sMPLC 和mMPLC 行多次肺叶切除是有效的。
4.1.3 术后残留病灶及监测 SHIMADA 等[34]研究了MPLC患者术后的生存结果发现,8%的患者有残余病变生长,23%的患者有新GGO 发展;然而,残余GGO 的生长和新GGO 的发展均不影响术后生存。之后SHIMADA 等[35]又进行了一项研究发现,190例多灶性GGO 患者与单发肺腺癌患者无复发,生存结局相似;且在116例有残留病灶的患者中,有38例患者在随访期间病变发生进展。因此,术后需要对未切除的病灶进行监测。目前,对于初次手术中未与主要肿瘤一同切除的残余病灶的处理仍然存在争议。
4.2 局部消融治疗 图像引导的经皮消融,包括射频消融、微波消融和冷冻消融已越来越多地用于不能手术的早期肺癌患者[36]。目前,这些技术也被应用于MPLC 的治疗,并取得了很好的疗效。HUANG 等[37]报道了用微波消融治疗多个同步GGO 的成功率为100%,且并发症发生率较低。QU 等[38]进一步采用电磁导航支气管镜(electromagnetic navigation bronchoscope,ENB)引导微波消融联合单孔胸腔镜治疗11例多发性GGO 患者,成功率为100%,随访未见复发。总之,局部消融可以作为治疗不可手术的MPLC 患者的一种替代方法。然而,需要进行较长时间的随访来评估生存结局。
4.3 放射治疗 立体定向消融放疗(stereotactic ablative radiotherapy,SABR)或立体定向放疗(stereotactic body radiotherapy,SBRT),包括图像引导和呼吸控制模式的整合,以向肿瘤提供适形的高剂量辐射,同时在1~2 周内限制周围器官的剂量。NYMAN 等[39]的一项随机对照试验显示,与剂量均匀的常规放疗相比,早期肺癌进行SABR 并发症较少,但在总生存期或局部控制方面没有差异。BALL 等[40]进行的一项随机对照试验表明,与传统放疗相比,SABR 总生存期和疾病控制率更高,且并发症更少。
目前,SABR 已成为拒绝手术治疗或无法手术治疗的肺癌患者的重要选择。CHANG 等[41]研究表明,与手术相比,接受SABR 治疗的肺癌患者的总生存率更高。对于MPLC 患者,为了尽可能保留正常肺组织,SABR 单独或联合手术均是治疗的合理选择[42]。MATTHIESE 等[43]研究发现SABR 治疗无法手术的MPLC 时安全可行;GRIFFIOEN 等[44]研究对56例患者的一对病灶均进行了SABR,另外6例患者仅对一个病灶进行了SABR,对另一个病灶进行了手术,术后随访发现患者的生存结局良好且并发症少;NISHIYAMA 等[45]研究发现单独使用SABR 治疗mMPLC 患者取得了良好的生存结局且安全性佳;NIKITAS 等[46]研究发现在接受单独SABR 治疗的患者和在术后进行SABR 治疗的MPLC 患者中,生存结局、局部控制情况和不良反应方面均表现良好。SABR 治疗sMPLC 和mMPLC 的效果见表3。
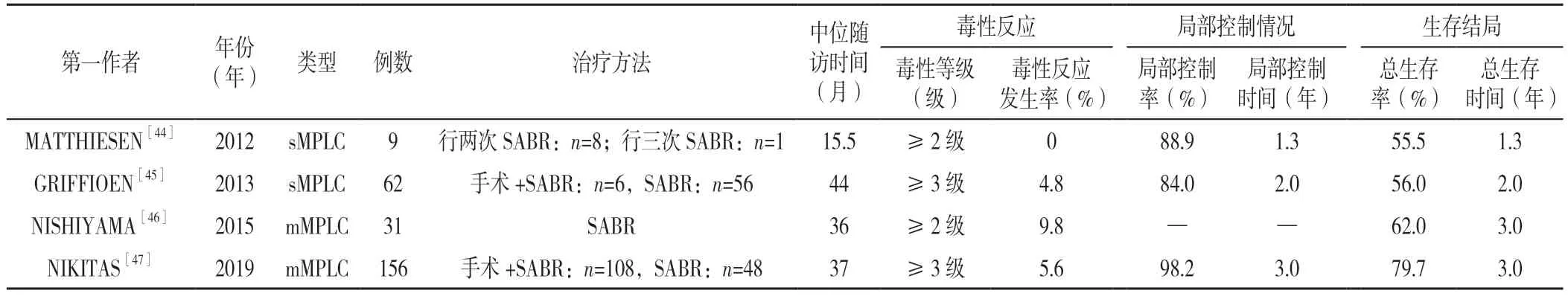
表3 SABR 治疗sMPLC 和mMPLC 的效果Table 3 Published studies on the effect of stereotactic ablative radiotherapy on synchronous and metachronous multiple primary lung cancer
2017 年美国放射肿瘤学会推荐使用SABR 治疗MPLC[42]。同时,众多专家强烈建议由多学科团队对MPLC进行评估,并对疑似MPLC 的患者进行PET-CT 和脑磁共振成像检查。
4.4 免疫治疗 免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)特别是程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)的治疗性抗体是目前无驱动基因突变的晚期NSCLC 患者一线治疗的主要选择[47]。肿瘤细胞中PD-L1 的表达是选择ICIs 治疗患者的最重要的生物标志物。然而,关于MPLC 患者中PD-L1 表达水平的研究很少。HARATAKE 等[48]回顾性分析了43例患者的112 个MPLC 病灶,发现只有13.4%的病灶PD-L1 阳性,MPLC 患者PD-L1表达不一致率为27.9%。WU 等[49]还对肿瘤微环境进行了研究,分析了两例MPLC 患者的4 个肿瘤的基因组和转录组图谱,发现这些图谱有很大的不同且同一患者的两个肿瘤中观察到不同的肿瘤微环境。
ICIs 对MPLC 患者术后的疗效仍有争议。WU 等[50]回顾了18例有37 个同步GGN 病灶的接受抗PD-1/PD-L1 治疗的肺腺癌患者。尽管原发病灶对治疗的反应率很高,但只有8.1%的混合型GGNs 对治疗有反应,67.6%的GGNs 在抗PD-1/PD-L1 治疗后没有明显变化。GGN 容易包含驱动癌基因,这是对ICIs 治疗反应率低的一个原因。但有报道显示ICIs 在治疗MPLC 患者时取得了显著疗效[51]。最近,抗PD-L1 药物阿替利珠单抗被证实可以延长PD-L1 阳性的早期NSCLC 患者手术切除和辅助化疗后的无病生存期[52]。目前研究ICIs 单独或与其他方法联合治疗MPLC 的试验仍在进行中(NCT04047186、NCT04026841、NCT04840758 和NCT05053802)[53-56]。总之,由于不同病变的基因组改变和免疫微环境存在差异,ICIs 在MPLC 治疗中的应用具有挑战性,需要进一步的研究来阐明免疫疗法的治疗优势。
4.5 靶向治疗 靶向治疗已成功应用于具有驱动基因突变的肺癌患者。有报道显示,MPLC 驱动基因突变的发生率较高,如在亚洲患者中EGFR 突变为45.8%~76.0%,这意味着靶向治疗可以成为MPLC 患者的治疗选择[57]。HARATAKE 等[58]研究表明,对主要病灶进行手术治疗,残余病灶用表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptortyrosine kinase inhibitor,EGFR-TKIs)治疗可能是实现疾病长期控制的合理方法。CHENG 等[59]也报道了用上述方法治疗MPLC,通过对侵入性最强的主要病灶进行手术切除,对无法切除的GGO 病灶继续使用吉非替尼治疗,避免了活检等侵入性检查,在吉非替尼治疗3 个月后,未切除的GGO 病灶(超过10 mm)获得完全缓解。这可能是治疗MPLC 患者残余GGO 病灶的一种有前途的方法。然而,也存在一些问题。首先,MPLC 中驱动基因突变的差异率较高,在80.0%~92.1%之间[57]。此外,挽救性靶向治疗的最佳治疗时间尚不清楚,且一些新靶向药物的长期毒副作用也不清楚,这些缺点使得靶向药物治疗MPLC 具有挑战性。
奥希替尼是一种第三代EGFR-TKI,与早期酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)相比,对常见的EGFR 突变具有良好的疗效和较少的不良反应[60]。除了可以用于治疗EGFR 突变的晚期NSCLC 患者,也可以在术后辅助治疗EGFR 突变的早期NSCLC 患者。此外,据报道,奥希替尼与新靶向药物阿来替尼的组合在具有独特分子特征的MPLC患者中是有效且可耐受的[47]。总之,EGFR-TKI 与手术相结合,是一种合理的治疗选择。对于无法手术且EGFR 突变的患者,应考虑靶向药物治疗。目前还需要进一步的研究以确定肿瘤的基因改变,使MPLC 患者个体化选用合适的靶向药物。
4.6 肿瘤的多学科(multidisciplinary team,MDT)治疗MDT 综合治疗是目前的发展方向,MDT 治疗模式使得恶性肿瘤患者的预后得到一定的提升,治疗方案的制订综合各个相关科室的专业意见,从而使患者获得更为合理的治疗[61]。MPLC 的MDT 治疗方案应由胸外科医生、放疗科医生、肿瘤科医生、病理科医生、介入科医生、影像科医生等共同讨论,综合分析诊断、基因检测、影像学表现、病理类型、外科治疗、辅助放化疗、新辅助放化疗、靶向治疗、新辅助靶向治疗、介入治疗等,对每位MPLC患者制订针对性的个体化治疗方案。
5 总结
由于新技术的发展,MPLC 的诊断和治疗取得了迅速的发展。广谱NGS 可以用于区分MPLC 和IM,在MPLC 的诊断和后续治疗(识别驱动癌基因)中起着重要的作用。NGS 与组织病理学及影像学的联合,将是未来鉴别诊断MPLC 的新趋势,且需要多学科团队进行讨论。在治疗方面,手术仍是MPLC 主要的治疗方法,且手术应由经验丰富的多学科团队进行评估。而SABR 和局部消融治疗对于不能手术的患者来说是安全可行的,但是需要更多的数据来评估这些患者的长期生存结果。此外,靶向治疗与手术相结合是新兴的治疗选择,特别是对于EGFR突变的患者。随着对肿瘤微环境的深入了解,免疫疗法如ICIs 在新辅助治疗或辅助治疗中也是可行的。虽然目前MPLC 的治疗方案很多,但仍需要进一步的研究来探索更具个体化的治疗方案。
作者贡献:洪子强负责论文的设计与构思、资料收集整理、撰写论文并对文章负责;金大成负责论文的审核和修改;白向豆、崔百强进行文献、资料整理;苟云久负责论文的质量控制和审校,对文章整体负责,监督管理。
本文无利益冲突。



