张军港 石英 黄东胜 张成武 洪德飞
[摘要] 目的 探讨miR-148b对肝癌SMMC7721细胞衰老的影响。 方法 分别使用50 nmol/L的miR-148b mimics(miR-148b)和negative control(miR-NC)转染肝癌SMMC7721细胞48 h后,采用实时荧光定量PCR(qRT-PCR)检测miR-148b表达的变化。通过β-半乳糖苷酶染色法检测细胞衰老的变化,应用western blot检测P21表达的影响。 结果 与对照组相比,miR-148b能明显增加肝癌SMMC7721细胞中miR-148b的表达。50 nmol/L的 miR-148b转染SMMC7721细胞48 h后,细胞形态变得大而扁平,衰老细胞比例明显增加[(9.67±2.08)% vs (43.67±3.51)%,P<0.01]。miR-148b使肝癌细胞P21蛋白的表达也明显增加。 结论 miR-148b可能通过影响P21的表达促进肝癌SMMC7721细胞的衰老,miR-148b有可能成为肝癌SMMC7721细胞生物治疗的新靶点。
[关键词] 肝癌;miR-148b;衰老;P21
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2016)05-0025-04
microRNAs是一类长度为20~24 bp、具有基因调控功能的非编码小分子RNA,主要通过影响mRNA的稳定及翻译调控基因表达功能[1]。大量研究发现,microRNAs在细胞增殖、分化、凋亡、衰老等多种生物学过程中发挥重要的作用[2-4]。miR-148b在多种肿瘤中异常表达,与肿瘤的生物学功能及预后密切相关。前期研究结果发现miR-148b在肝癌组织和细胞中低表达,与肝癌的增殖侵袭密切相关[5,6],目前miR-148b对肝癌细胞衰老的影响机制尚不清楚。本研究在2013年10~12月将50 nmol/L的miR-148b的类似物转染肝癌SMMC7721细胞48 h后,观察对细胞衰老特性及衰老相关蛋白P21的影响,为探讨miR-148b作为肝癌治疗靶点提供基础依据。现报道如下。
1 材料与方法
1.1 一般材料
RPMI1640培养基和胎牛血清购自美国Gibco BRL公司, 肝癌细胞系SMMC7721购自中国科学院上海细胞库。衰老相关β-半乳糖苷酶染色试剂盒购自碧云天生物有限公司。miR-148b mimics(miR-148b)和negative control(miR-NC)转染试剂盒购自广州锐博生物技术有限公司。LipofectmanineTM2000及Trizol试剂均购自美国Invitrogen公司。兔抗人P21和GAPDH一抗购自美国 Santa Cruz公司,辣根过氧化物酶结合的二抗购自武汉博士德公司。
1.2 方法
1.2.1 常规细胞培养 肝癌SMMC7721细胞用含10%胎牛血清的RPMI1640培养基,在37℃、含5%CO2培育箱下常规培养。
1.2.2 实时荧光定量逆转录聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,qRT-PCR) 采用TaKaRa公司的试剂盒,miR-148b和内参U6的引物探针由广州瑞博公司设计合成。miR-148b:5-AAGTTCTGTTATACACTCAGGC-3,内参基因U6:5-CTCGCTTCGGCA-GCACA-3。反应体系为 SYBRR Green qRT-PCR Mix(2×)10 μL,PCR Forward Primer和Reverse Primer各0.4 μL,ROX 0.4 μL,ddH2O 7.8 μL,cDNA 1 μL。其反应条件:95 ℃ 30 s,95℃ 5 s, 60℃ 30 s×40循环,仪器为ABI公司7500型Real-time PCR仪。ABI step-one附带qRT-PCR分析软件分析CT(cycle threshold)值。目的基因RNA的相对表达量=2-Δ Δ CT, Δ Δ CT=待测样本(CT目的基因-CT内参)-对照组(CT目的基因-CT内参)。
1.2.3 β-半乳糖苷酶染色法检测细胞衰老 转染组和对照组细胞培养48 h后离心后重悬,以1×105个/孔接种于12孔培养板中,贴壁 24 h 后用细胞衰老检测试剂盒染色,在37℃孵育过夜,细胞质内出现均匀一致蓝色细颗粒表示β-半乳糖苷酶染色阳性,即细胞出现衰老改变。
1.2.4 Western blot检测P21蛋白的变化 各组细胞转染培养48 h后, 提取细胞蛋白。总蛋白提取方法参照Beyotime公司操作说明进行。分别将相同适量蛋白含量的样品和2×蛋白上样缓冲液等体积混合,沸水中煮5 min使蛋白变性,10% SDS-PAGE电泳后电转移至硝酸纤维素膜上,然后 5 g/L脱脂奶粉封闭,加入1:1000稀释的一抗,4℃过夜,加入1∶2000稀释的二抗,室温1 h,TBS漂洗膜,ECL增强发光,X线曝光。以GAPDH蛋白作为内参照,BANDSCAN图像分析软件光密度积分值分析。
1.3 统计学处理
使用统计学软件SPSS 13.0进行分析,经方差齐性检验,数据符合正态分布,所有数据以(x±s)表示,组间差异比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 miR-148b对肝癌SMMC7721细胞中miR-148b表达的影响
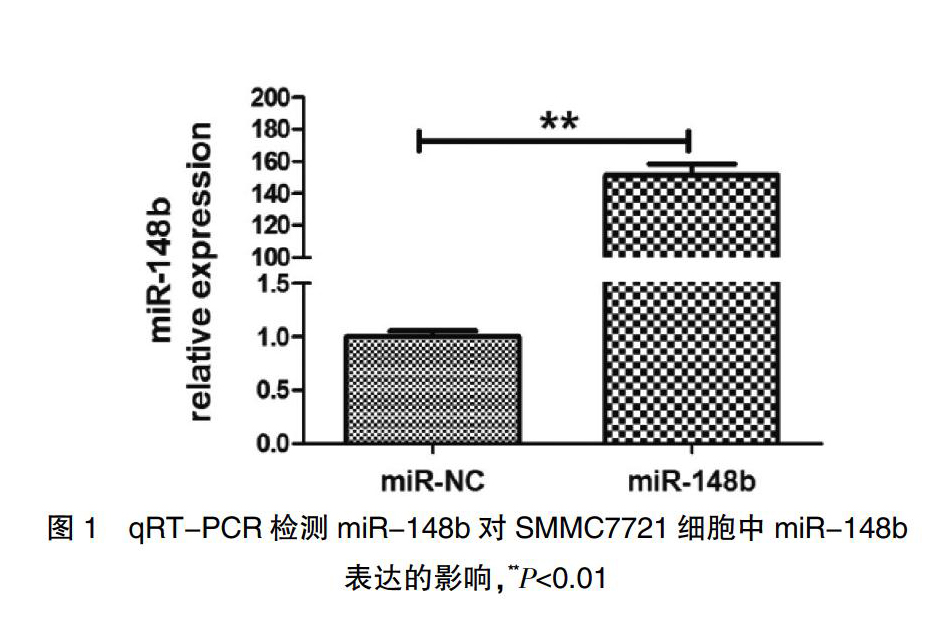
将50 nmol/L miR-148b或miR-NC作用SMMC 7721细胞48 h,采用qRT-PCR的方法,检测miR-148b表达的影响,结果发现与对照组相比(1.00±0.08),miR-148b明显增加了肝癌细胞miR-148b的表达(151.22±9.77),差异具有高度统计学意义(t=21.73,P<0.01)(图1)。
2.2 miR-148b对肝癌SMMC7721细胞衰老的影响
将50 nmol/L miR-148b 或miR-NC作用SMMC7721细胞48 h,采用倒置显微镜观察细胞形态的变化。结果显示,与对照组相比,miR-148b处理组的部分细胞形态变得更加大而扁平(封三图1A)。进一步采用β-半乳糖苷酶染色检测细胞衰老变化。结果显示,与对照组(9.67±2.08)%相比,miR-148b引起的衰老细胞比率明显增加(43.67±3.51)%,差异具有高度统计学意义(t=14.42,P<0.01)(封三图1B)。
2.3 miR-148b对肝癌SMMC7721细胞衰老相关p21蛋白的影响
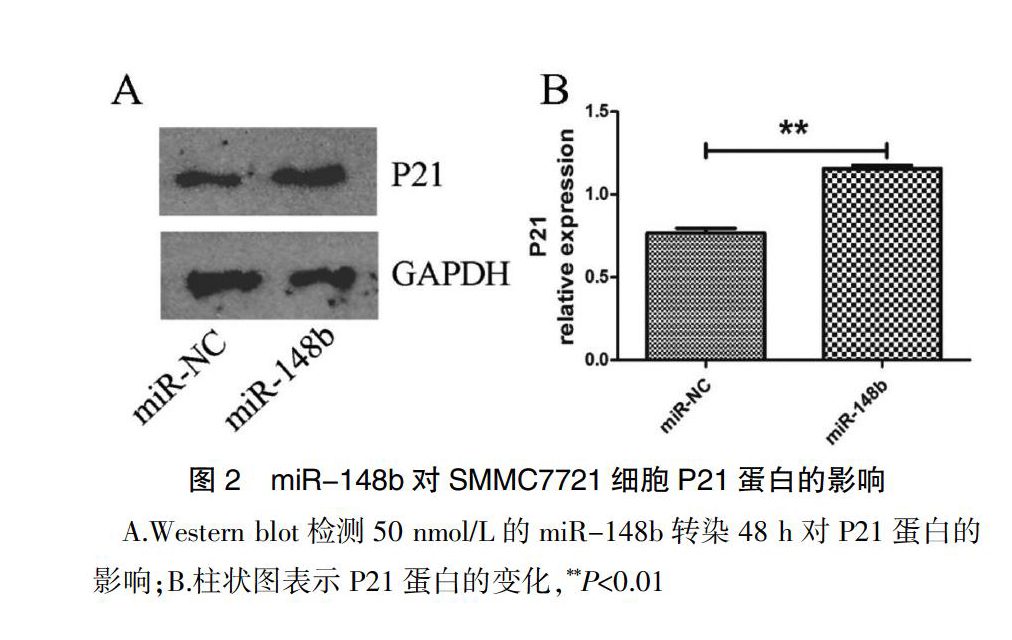
采用Western blot方法检测P21蛋白变化,结果发现,与对照组相比,50 nmol/L的miR-148b作用SMMC 7721细胞48 h后,P21蛋白的表达明显增加(图2A)。具体灰度值变化见图2B(灰度值:1.16±0.02 vs 0.77±0.03),差异具有高度统计学意义(t=15.89,P<0.01)(图2B)。
3 讨论
肝癌是世界上死亡率最高的恶性肿瘤之一。由于肝癌的发病隐匿,早期无特异性的临床症状,且病程进展迅速,当患者出现明显的自觉症状时,往往已到了中晚期[7]。目前肝癌的治疗仍以手术为主,而不能手术的患者则以化疗为主。手术的效果受限于手术时机,而化疗药物易产生耐药性、肿瘤杀伤效率不高。因此迫切需要寻找有效地早期生物标志物机开发新的有效药物治疗肝癌。
肝癌的发生发展是一个多因素多步骤多阶段的病理过程, 涉及到很多相关癌基因和抑癌基因的变化。研究结果显示,microRNA可能通过类似于抑癌基因、癌基因或其它方式来调控肿瘤发生、发展和转归过程,表现为同抑癌基因或癌基因相似的生物学效应[8]。microRNA主要通过与特定靶基因mRNA 的 3-非翻译区(3-UTR)完全或不完全配对,导致靶基因mRNA降解或翻译抑制,从而参与个体发育、细胞增殖、凋亡、分化、衰老和代谢等生命活动的调控[2,9,10]。
近年来研究发现miR-148b参与多种肿瘤的发生发展过程。Ghasemkhani N等[11]研究发现miR-148b在肺癌中低表达,同肺癌的TNM分期和淋巴结转移及不良预后密切相关。Zhao等[12]研究发现miR-148b在胰腺癌低表达,通过影响AMPKα1信号通路影响肿瘤的生物学行为。我们前期已经发现miR-148b在肝癌中低表达,通关过调控WNT1/β-catenin通路抑制肝癌的增殖和侵袭行为[5]。然而miR-148b同肝癌细胞衰老的关系未做进一步研究。细胞衰老是指细胞不可逆地离开细胞周期、发生形态及细胞学改变的现象。细胞衰老作为细胞潜在的抗肿瘤机制,在肿瘤的发生发展过程中起着重要屏障作用,能够有效防止肿瘤发生[13,14]。
本研究结果显示miR-148b能够使SMMC7721中的miR-148b表达明显增加,miR-148b使SMMC 7721细胞的形态变得大而扁平,呈现出衰老状态。同时我们发现miR-148b使β-半乳糖苷酶染色阳性的细胞数目明显增加,进一步验证了miR-148b能够诱导肝癌细胞衰老,使肝恶性肿瘤细胞恶性生物学行为发生一定程度逆转。
P21是细胞周期调控家族的重要成员之一,是依赖于细胞周期蛋白激酶(CDK)的抑制物,它能够通过调控细胞周期过程,参与细胞的增殖、分化、衰老及死亡过程[15-17]。已知P21是通过依赖p53和不赖p53的途径调节的。既往研究发现,P21能增加肿瘤细胞内的ROS水平,而ROS的抑制剂N-乙酰半胱氨酸能够明显阻止P21诱导的细胞衰老,表明P21可能通过ROS积聚机制诱导衰老[18]。Hu B等[19]研究发现女贞果实提取物通过正调控P21诱导肝癌细胞的衰老和凋亡。既往研究发现阿霉素能够诱导结肠癌野生型HCT-116细胞发生衰老样生长停滞,而这种作用对敲除P21的HCT-116细胞株作用大大降低,表明P21在结肠癌的衰老过程中起重要作用[20]。我们的研究结果发现miR-148b能够使P21蛋白的表达量明显增加,表明miR-148b可能通过调通P21的表达诱导肝癌细胞的衰老过程。
综上所述,本研究结果显示,miR-148b能够通过调控P21来诱导肝癌SMMC7721细胞衰老,我们将进一步深入研究miR-148b在肝癌中的功能和调控分子机制,系统阐明miR-148b参与肝癌发生发展可能的机制,为肝癌的治疗提供新的靶点。
[参考文献]
[1] Lundmark M,K?觊rner CJ,Nielsen TH. Global analysis of microRNA in Arabidopsis in response to phosphate starvation as studied by locked nucleic acid-based microarrays[J]. Physiol Plant,2010,140(1):57-68.
[2] Hata A,Lieberman J. Dysregulation of microRNA biogenesis and gene silencing in cancer[J]. Sci Signal,2015,8(368):re3.
[3] Zhu X,Wu L,Yao J,et al. MicroRNA let-7c inhibits cell proliferation and induces cell cycle arrest by targeting CDC25A in Human hepatocellular carcinoma[J]. PLoS One,2015,10(4):e0124266.
[4] Ramalinga M,Roy A,Srivastava A,et al. MicroRNA-212 negatively regulates starvation induced autophagy in prostate cancer cells by inhibiting SIRT1 and is a modulator of angiogenesis and cellular senescence[J]. Oncotarget,2015,6(33):34446-34457.
[5] Zhang JG,Shi Y,Hong DF,et al. MiR-148b suppresses cell proliferation and invasion in hepatocellular carcinoma by targeting WNT1/β-catenin pathway[J]. Sci Rep,2015, 5:8087.
[6] Sadeghian Y,Kamyabi-Moghaddam Z,Nodushan SM,et al. Profiles of tissue microRNAs,miR-148b and miR-25 serve as potential prognostic biomarkers for hepatocellular carcinoma[J]. Tumour Biol,2015. [Epub ahead of print]
[7] Parkin DM,Bray F,Ferlay J,et al. Global cancer statistics,2002[J]. CA Cancer J Clin,2005,55(2):74-108.
[8] Valeri N,Braconi C,Gasparini P,et al. MicroRNA-135b promotes cancer progression by acting as a downstream effector of oncogenic pathways in colon cancer[J]. Cancer Cell,2014,25(4):469-483.
[9] Liu C,Lou CH,Shah V,et al. Identification of microRNAs and microRNA Targets in Xenopus gastrulae:The role of miR-26 in the regulation of Smad1[J]. Dev Biol,2015. pii:S0012-1606(15)30277-3.
[10] Li J,Wan X,Qiang W,et al. MiR-29a suppresses prostate cell proliferation and induces apoptosis via KDM5B protein regulation[J]. Int J Clin Exp Med,2015,8(4):5329-5339.
[11] Ghasemkhani N,Shadvar S,Masoudi Y,et al. Down-regulated MicroRNA 148b expression as predictive biomarker and its prognostic significance associated with clinicopathological features in non-small-cell lung cancer patients[J]. Diagn Pathol,2015,10(1):164.
[12] Zhao G,Zhang JG,Liu Y,et al. MiR-148b functions as a tumor suppressor in pancreatic cancer by targeting AMPKα1[J]. Mol Cancer Ther,2013,12(1):83-93.
[13] Qi H,Zuo DY,Bai ZS,et al. COH-203,a novel microtubule inhibitor,exhibits potent anti-tumor activity via p53-dependentsenescence in hepatocellular carcinoma[J].Biochem Biophys Res Commun,2014,455(3-4):262-268.
[14] Gewirtz DA,Holt SE,Elmore LW. Accelerated senescence:an emerging role in tumor cell response to chemotherapy and radiation[J]. Biochem Pharmacol,2008, 76(8):947-957.
[15] Wang C,Chen Z,Ge Q,et al. Up-regulation of p21(WAF1/CIP1) by miRNAs and its implications in bladder cancer cells[J]. FEBS Lett,2014,588(24):4654-4664.
[16] Romanov VS,Pospelov VA,Pospelova TV. Cyclin-dependent kinase inhibitor p21(Waf1):Contemporary view on its role in senescence and oncogenesis[J]. Biochemistry(Mosc),2012,77(6):575-584.
[17] Chen TC,Wadsten P,Su S,et al. The type Ⅳ phosphodiesterase inhibitor rolipram induces expression of the cell cycle inhibitors p21(Cip1) and p27(Kip1),resulting in growth inhibition,increased differentiation,and subsequent apoptosis of malignant A-172 glioma cells[J]. Cancer Biol Ther,2002,1(3):268-276.
[18] Macip S,Igarashi M,Fang L,et al. Inhibition of p21-mediated ROS accumulation can rescue p21-induced senescence[J]. EMBO J,2002,21(9):2180-2188.
[19] Hu B,Du Q,Deng S,et al. Ligustrum lucidum Ait. fruit extract induces apoptosis and cell senescence in human hepatocellular carcinoma cells through upregulation of p21[J]. Oncol Rep,2014,32(3):1037-1042.
[20] Chang BD,Xuan Y,Broude EV,et al. Role of p53 and p21waf1/cip1 in senescence-like terminal proliferation arrest induced in human tumor cells by chemotherapeutic drugs[J]. Oncogene,1999,18(34):4808-4818.
(收稿日期:2015-11-05)



