王兵 黄灵 倪海滨
1.浙江省肿瘤医院腹部肿瘤外科,浙江杭州310022;2.浙江省人民医院胃肠外科,浙江杭州310015
胃癌患者呼出气冷凝液及肿瘤组织中P53蛋白的检测
王兵1黄灵1倪海滨2
1.浙江省肿瘤医院腹部肿瘤外科,浙江杭州310022;2.浙江省人民医院胃肠外科,浙江杭州310015
目的研究胃癌患者呼出气冷凝液(exhaled breath condensate,EBC)中及肿瘤标本切片P53蛋白的表达及其临床意义。方法收集2010年1月~2015年12月胃癌手术后肿瘤标本切片和EBC,采用免疫组化(SP)法检测肿瘤标本切片和对照正常胃标本切片中的P53蛋白表达水平,采用免疫酶法检测胃癌呼出气体P53蛋白的水平,采用SPSS19.0统计软件分析P53蛋白检测阳性率。结果胃癌手术后肿瘤标本切片中P53阳性率为60.6%,肿瘤标本切片阳性高于对照组(P<0.01);胃癌患者呼出气体中P53蛋白浓度为(50.81±14.25)ng/L,胃癌患者比正常对照组高(P<0.01);Ⅱ+Ⅲ+Ⅳ期胃癌患者EBC中P53蛋白浓度较Ⅰ期高;胃癌组织中P53蛋白检测的敏感性和特异性为60.7%和90.0%,EBC中为42.4%和93.4%,两种检测途径无显著性差异(P>0.05)。结论胃癌组织及EBC中P53蛋白检测可用于胃癌的辅助诊断及病情监测。
胃癌;P53蛋白;呼出气冷凝液;肿瘤组织
胃癌是最常见的人类恶性肿瘤之一[1-2],我国胃癌的发病率为23.96/10万,目前胃癌的发病率呈上升趋势。由于胃癌早期诊断较为困难,存活率一直较低。胃癌患者标本切片检测在胃癌的早期诊断、病情程度判断、胃癌治疗疗效评价、胃癌转移和复发的治疗以及预后估计等方面起重要作用。胃癌患者呼出气冷凝液(exhaled breath condensate,EBC)检测方法[3-4]是一种新的无痛无创呼吸道呼出气体的方法,具有无痛收集容易、患者易接受、可重复进行等优点。检测EBC中胃癌肿瘤标志物,或许是找到胃癌早期筛查的一种新途径。肿瘤抑癌基因p53在肿瘤的发生机制中起重要作用,通过对66例胃癌患者肿瘤切片及患者呼出气冷凝液(EBC)中P53蛋白表达水平研究,现报道如下。
1 资料与方法
1.1 临床资料
采用回顾性分析,根据有无胃癌疾病分类[5]将研究对象分为胃癌组66例和健康对照组60例。胃癌组66例均选自2010年1月~2015年12月浙江省肿瘤医院住院患者,胃癌患者均经手术方式,临床免疫组化结果诊断为胃癌,其中男52例,女14例,年龄40~80岁,平均60岁。
1.2 病理分型
腺癌44例,鳞癌22例。66例胃癌患者按照全球抗癌联盟2009年制定的TNM分期标准进行分期[6],Ⅰ期44例,Ⅱ期12例,Ⅲ期8例,Ⅳ期2例。选取本科门诊体检健康者60例作为对照组。其中男42例,女18例,年龄30~80岁,平均60岁。胃癌组和对照组排除严重心肝肺功能疾病、心脑血管等慢性疾病。胃癌标本切片和健康正常对照组性别、年龄对比无统计差异[7]。
1.3 标本收集和处理
研究胃癌患者呼出气冷凝液收集采用EcoScreen冷凝器采集,测试者漱口,单鼻子平静呼吸气体,呼出气在-25℃收集管中,可冷凝变为霜状物,35 min后,拔出收集管融化后可收集到3 mL左右呼出气冷凝液,装入真空无菌试管内,置于-80℃冰箱内保存,检验时解冻。呼出气冷凝液收集前2 h,不做肺活量检查和运动,收集保证测试一次完成,以避免影响检测结果。收集我院病理科胃癌患者的石蜡切片,病理明确胃癌的为测定组,取肿瘤远端4 cm以外经病理,显微镜检查没有癌细胞的胃组织作为正常对照组。
1.4 检测方法
1.4.1 采用免疫组化(SP)法检测肿瘤蛋白胃癌切片和肿瘤远端4 cm以上无癌组织中P53蛋白的检测[8-9]结果判定:颜色为棕黄和棕褐色,P53蛋白表达为阳性。位于细胞中分析;P53蛋白表达阳性细胞的计算数:每个标本随机选取15个高倍显微镜,计算数2000个细胞,阳性细胞百分率,阳性细胞百分率≥30%为阳性,<30%为阴性,是按照国际病理阴阳性计数标准计分[10-11]。
1.4.2 采用免疫酶法检测呼出气冷凝液中P53蛋白采用免疫酶法,正常组检测平均值加2.5倍的标准差为正常参考值水平,EBC中P53<60.03 ng/L。
1.5 统计学分析
采用SPSS19.0统计软件分析。胃癌切片组和健康对照组P53蛋白检测阳性表达比较,使用χ2检验;胃癌切片组和对照组EBC中P53蛋白水平,几种类型胃癌P53蛋白水平比较,采用t检验;四种分期胃癌EBC中P53蛋白表达量比较,采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 胃癌肿瘤标本切片中P53蛋白表达
P53蛋白免疫组化染色阳性信号为棕黄色颗粒,主要定位于细胞核。见封三图2。
2.2 胃癌组肿瘤切片及EBC中P53蛋白表达水平
见表1、2。本组研究结果显示,P53蛋白在胃癌患者肿瘤切片中的表达阳性率为60.6%(40/66),胃癌组比对照组高(P<0.01),在Ⅰ期和Ⅱ+Ⅲ+Ⅳ期的阳性表达率分别为63.6%和54.5%,P53蛋白在胃癌不同病理类型及不同病理分期表达差异均无统计学意义。胃癌组EBC中P53蛋白的含量为(50.81±14.25)ng/L,对照组为(33.69±12.17)ng/L,胃癌组较对照组高(P<0.01);在鳞癌和腺癌EBC中P53蛋白的水平分别为(50.31± 14.25)ng/L、(51.63±13.97)ng/L,两者比较无统计学差异(P>0.05);Ⅰ期和Ⅱ+Ⅲ+Ⅳ期胃癌EBC的P53蛋白的水平分别为(47.06±7.11)ng/L、(58.33±21.38)ng/L,差异有统计学意义(P<0.05)。
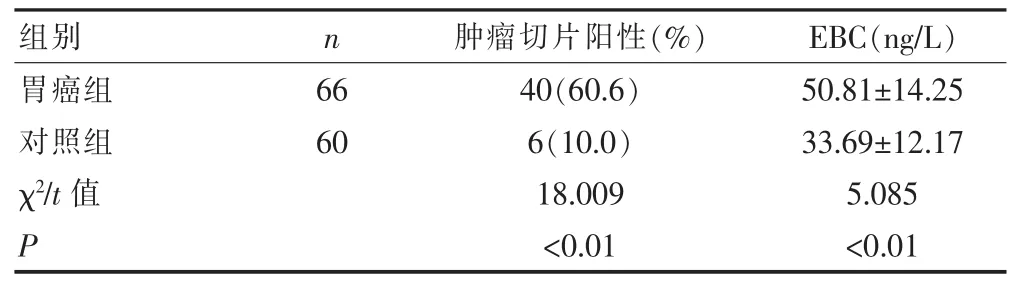
表1 胃癌组和对照组肿瘤标本切片阳性表达率比较及EBC含量的比较
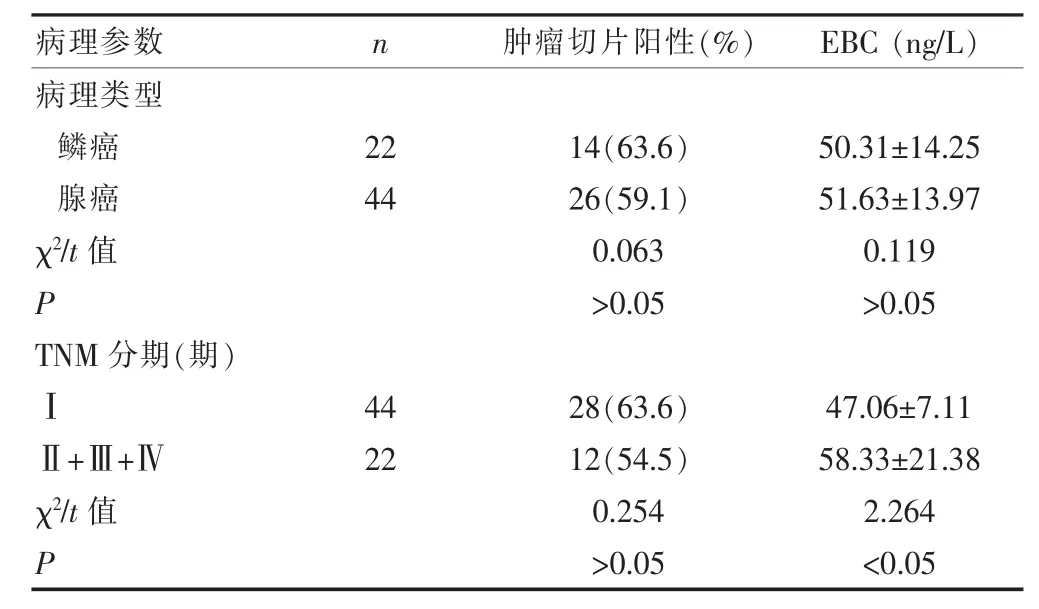
表2 胃癌组肿瘤切片阳性及EBC中P53蛋白含量与临床病理关系
2.3 肿瘤组织与EBC中P53蛋白检测的敏感性、特异性
见表3。胃癌组肿瘤组织中P53蛋白检测的敏感性和特异性为60.7%和90.0%,EBC中为42.4%和93.4%,两种检测途径无显著性差异(P>0.05)。

表3 肿瘤组织P53蛋白蛋白阳性率和阴性率比较
3 讨论
生物体内一种抑制细胞转变癌细胞的基因,p53是主要抑癌基因。细胞中癌基因可分为致癌基因(oncogene)和抑癌基因,只要一方突变转变,癌变可能会发生。人类p53基因在17号染色体p13,全长16~20 kb,由11个外显子组成,合成转录2.8 kb的mRNA,转录成蛋白质为P53,为细胞核内磷酸化蛋白。截止目前研究人类肿瘤相关性最高的基因是p53基因,过去一直认为p53是一种癌基因,1989年几位学者研究起癌基因作用的是突变的p53,后来证实抑癌基因是野生型的p53[12-14]。P53蛋白由393个氨基酸残基构成,在细胞内以四聚体的形式存在,凋亡期为20~30min。正常情况下,细胞中P53蛋白的含量很低,因其半衰期短,所以很难检出来,但在生长增值的细胞中,可升高10~100倍以上。维持细胞正常生长发育和抑制恶性增殖中野生型P53蛋白起着重要作用,因而被称为“基因卫士”的称号。p53基因控制细胞染色体DNA的完整性,如果细胞中染色体DNA遭到损害,P53蛋白和基因的DNA的相应结合部位结合,起特殊转录因子的作用,激活p21基因合成转录,细胞转录停滞于G1期;解链酶的活性被抑制;并与复制因子A相互作用,控制DNA的复制和修复。如果修复重组失败,P53蛋白开动程序性凋亡过程诱导细胞自杀,癌变倾向的突变细胞生成被阻止,细胞恶变得到控制。p53基因突变后,细胞构象影响到转录编译功能和P53蛋白的磷酸化过程,野生型p53抑制肿瘤增殖的作用将失去,此时突变基因具备癌基因的功能。突变的和野生的P53蛋白相结合,合成的这种异类蛋白不能结合DNA,致癌基因转录失控导致肿瘤发生。目前主要通过胃癌组织、血液和痰标本等检测p53基因的变异,而通过EBC检测p53基因突变是最近的研究报道,有研究报告EBC中检测p53基因变异率为35.4%[15-16]。
P53蛋白在胃癌切片中表达和临床病理研究关系,大部分人认为P53蛋白可作为胃癌预后的一项指标[17-18]。有研究发现P53蛋白在胃癌患者的肿瘤组织中表达阳性率为55%[19],胃癌患者没有采取放化疗,P53蛋白表达为阳性,存活期阴性比阳性长,两者有统计学差异,表明胃癌肿瘤组织中P53蛋白的表达与患者的预后相关[20]。本研究显示,P53蛋白在胃癌患者肿瘤切片中表达阳性率为60.6%(40/66),胃癌切片组高于对照组(P<0.01),Ⅰ期和Ⅱ+Ⅲ+Ⅳ期的阳性表达率分别为63.6%和54.5%,不同病理类型及不同病理分期P53蛋白表达无显著性差异。目前对于EBC中P53蛋白的检测报道较少,我们研究显示胃癌组EBC中P53蛋白的水平显著高于正常对照组(P<0.05),在不同病理类型EBC中P53蛋白的水平无显著性差异,Ⅱ+Ⅲ+Ⅳ期EBC中P53蛋白的表达水平高于Ⅰ期(P<0.05)。通过肿瘤组织及EBC两种检测途径对P53蛋白的表达进行检测,敏感性及特异性无显著性差异,提示肿瘤组织及EBC中P53蛋白检测可作为胃癌诊断,病情判断和评价预后的指标。
有研究表明胃癌患者突变型p53蛋白高表达,DNA修复能力减弱[21]。胃癌的发生和转移与突变型p53蛋白密切相关。胃癌肿瘤标本及EBC中P53蛋白检测对胃癌的诊断有临床研究意义,对于胃癌分期、治疗效果评价和预后估计也是值得今后进一步研究的课题。
[1]Gessner C,Kuhn H,Toepfer K,etal.Detection of p53 gene mutations in exhaled breath condensate of non-small cell gastric cancer patients[J].Gastric cancer,2015,(4):215-222.
[2]Porebska I,Sobańska E,Kosacka M,et al.Apoptotic regulators:P53 and survivin expression in non-small cell gastric cancer[J].Cancer Genomics Proteomics,2014,7(6):331-335.
[3]Tsao MS,Aviel-Ronen S,Ding K,et al.Prognostic and predictive importance of p53 and RAS for adjuvant chemotherapy in non small-cell gastric cance[J].Clin Oncol,2015,25(33):5240-5247.
[4]Bello IO,Vered M,Dayan D,et al.Cancer-associated fibroblasts,a parameter of the tumor microenvironment,overcomes carcinoma-associated parameters in the prognosis of patientswithmobile tongue cancer[J].Oral Oncol,2015,8(4):33-38.
[5]Kalluri R,Zeisberg M.Fibroblasts in cancer[J].Nat Rev Cancer,2015,6(6):392-401.
[6]Bissell MJ,Radisky D.Putting tumours in context[J].Nat Rev Cancer,2012,3(7):46-54.
[7]Chan HP,Lewis C,Thomas PS,et al.Exhaled breath analysis:Novelapproach for early detection of gastric cancer[J]. Gastric C ancer,2012,63(2):164-168.
[8]Lane DP.Cancer,P53,guardian of the genome[J].Nature,2012,358(6):815-816.
[9]Lowe SW,Svhmitt EM,Smith JW,et al.P53 is required for radiation-induced apoptosis in mouse thymocytes[J]. Nature,2014,362(4):847-849.
[10]Mathieu V,De Lassalle EM,Toelen J,etal.Galectin-1 in melanoma biology and related neo-angiogenesis processes[J].J Invest Dermatol,2015,27(12):2245-2254.
[11]Thijssen VL,Postel R,Brandwijk RJ,et al.Galectin-1 is essential in tumor angiogenesis and is a target for antiangiogenesis therapy[J].Proc Natl Acad Sci USA,2015,29(6):15975-15980.
[12]Ito K,Scott SA,Cutler S,et al.Thiodigalactoside inhibits murine cancers by concurrently blocking effects of Galectin-1 on immune dysregulation,angiogenesis and protection against oxidative stress[J].Angiogenesis,2014,13(11):293-307.
[13]Le Mercier M,Fortin S,Mathieu V,et al.Galectin 1 proangiogenic and promigratory effects in the Hs683 oligodendrogliomamodel are partlymediated through the control of BEX2 expression[J].Neoplasia,2014,23(11):485-496.
[14]Hsieh SH,Ying NW,Wu MH,et al.Galectin-1,a novel ligand of neuropilin-1,activates VEGFR-2 signaling and modulates the migration of vascular endothelial cells[J]. Oncogene,2014,39(3):3746-3753.
[15]Marsich E,Mozetic P,Ortolani F,et al.Galectin-1 in cartilage:expression,influence on chondrocyte growth and interaction with ECM components[J].Matrix Biol,2008,7(6):513-525.
[16]van den Brule F,Califice S,Garnier F,et al.Galectin-1 accumulation in the ovary carcinoma peritumoral stroma is induced by ovary carcinoma cells and affects both cancer cell proliferation and adhesion to laminin-1 and fibronectin[J].Lab Invest,2014,8(3):377-386.
[17]Hsu YL,Wu CY,Hung JY,et al.Galectin-1 promotes lung cancer tumormetastasis by potentiating integrin alpha6beta4 and Notch1/Jagged2 signaling pathway[J]. Carcinogenesis,2015,34(6):1370-1381.
[18]Sanchez-Ruderisch H,Detjen KM,Welzel M,et al. Galectin-1 sensitizes carcinoma cells to anoikis via the fibronectin receptor alpha5beta1-integrin[J].Cell Death Differ,2015,13(5):806-816.
[19]Kim HJ,Jeon HK,Cho YJ,et al.High Galectin-1 expression correlateswith poor prognosis and is involved in epithelial ovarian cancer proliferation and invasion[J]. Eur JCancer,2013,19(2):1914-1921.
[20]Xue X,Lu Z,Tang D,et al.Galectin-1 secreted by activated stellate cells in pancreatic ductal adenocarcinoma stroma promotes proliferation and invasion of pancreatic cancer cells:an in vitro study on the microenvironment of pancreatic ductal adenocarcinoma[J].Pancreas,2015,21(3):832-839.
[21]Wu MH,Hong TM,Cheng HW,et al.Galectin-1-mediated tumor invasion and metastasis,up-regulated matrix metalloproteinase expression,and reorganized actin cytoskeletons[J].Mol Cancer Res,2014,35(7):311-318.
Determ ination of P53 protein in EBC and tumor tissues in the patients w ith gastric cancer
WANG Bing1HUANG Ling1NIHaibin2
1.Department of Abdominal Tumor Surgery,Zhejiang Tumor Hospital,Hangzhou 310022,China;2.Gastrointestinal Surgery,Zhejiang Province People's Hospital,Hangzhou 310015,China
Objective To study the expression and clinical significance of P53 proteins in tumor specimen slices and exhaled breath condensate(EBC)in the patientswith gastric cancer.M ethods Tumor specimen slices and EBC after the surgery of gastric cancer from January 2010 to December 2015 were collected.SPwas applied to determine the expression level of P53 protein in tumor specimen slices and controlled normal gastric specimen slices.Immunoenzyme technique was applied to determine the level of P53 protein in the exhaled breath of gastric cancer.SPSS19.0 statistical software was applied to analyze the positive expression rate of P53 protein determination.Results Statistical analysis rate of P53 positive expression in tumor specimen slices after the surgery of gastric cancer was 60.6%,and the positive rate in tumor specimen sliceswas higher than that in the control group(P<0.01);the concentration of P53 protein in the exhaled breath in the patients with gastric cancer was(50.81±14.25)ng/L,which was higher than that in the control group(P<0.01);P53 protein concentration in EBC in the patients with gastric cancer phaseⅡ+Ⅲ+Ⅳwas higher than phaseⅠgastric cancer;the sensitivity and specificity of P53 protein determination in tumor tissue in the gastric cancer group were 60.7%and 90.0%,and 42.4%and 93.4%in EBC.There was no significant difference in the two determination ways(P>0.05).Conclusion P53 protein determination in tumor tissue and EBC in the patients with gastric cancer can be applied in the adjuvant diagnosis and diseasemonitoring of gastric cancer.
Gastric cancer;P53 protein;Exhaled breath condensate(EBC);Tumor tissues
R735.2
A
1673-9701(2016)18-0009-03
2016-02-20)
浙江省医药卫生科技计划项目(2015KYA012)



