应 樱
浙江省嘉兴市第一医院呼吸科,浙江嘉兴 314000
目前,抗生素耐药已经成为一个重大的公共卫生问题,临床治疗感染性疾病的新方向变为将内源性天然抗生素抗菌肽LL-37表达增加,促进宿主免疫防御功能的提升[1-3]。为了将有效的理论依据提供给临床对抗生素的科学合理应用,对感染性疾病进行积极有效的治疗,从而对患者预后进行切实有效的改善,本文研究SIRT1对肺炎链球菌感染肺上皮细胞诱导LL-37表达的调控机制进行了研究,现报道如下。
1 材料与方法
1.1 材料来源
实验设计时间为2016年11月~2017年10月,采用中国科学院上海细胞生物研究所细胞库提供的人肺腺癌细胞系A549(A549细胞)、人支气管上皮细胞(BEAS-2B细胞),美国模式肺炎链球菌(SP)作为细胞菌株,培养物集存库 (ATCC)为6303。美国GIBCO公司生产的RPMI1640培养基、杭州四季青生物工程材料有限公司生产的胎牛血清、美国OXOID公司生产的哥伦比亚血琼脂基础等,美国Forma公司生产的二级生物安全柜,美国Thermo公司生产的超净工作台、CO2培养箱等。
1.2 方法
对细胞进行重悬,在此过程中将不含双抗RPMI1640培养液充分利用起来,以(3~4)×105/mL密度在6孔板中接种A549细胞,待细胞向30%~50%满皿底面积生长时分为对照组、si-SIRT1序列①组、si-SIRT1序列②组、阴性对照 siRNA(siRNA-NC)组、lipo组五组。其中对照组不将其他试剂加入培养基;si-SIRT1序列①组将转染si-SIRT1序列①加入培养基;si-SIRT1序列②组将转染si-SIRT1序列②加入培养基;阴性对照siRNA(siRNA-NC)组将转染不匹配人的任何基因的siRNA(转染无意义siRNA)加入培养基,将其作为对照,以将本实验受到siRNA及转染操作的影响排除;lipo组将lipofectaminTM2000试剂加入培养基,以将本实验受到脂质体的影响排除。上海吉马公司设计合成SIRT1 siRNA序列,具体见表1。由于细胞转染siRNA中涉及RNA,因此去酶处理实验中应用EP管及枪头等实验器材,从而有效避免Rnase降解的现象。采用qRT-PCR对A549细胞的SIRT1沉默效果进行检测,并采用Western Blot对A549细胞的SIRT1沉默效果进行检测[4-10]。

表1 SIRT1 siRNA序列[4]
1.3 观察指标
培养瓶或6孔板中的BEAS-2B及A549细胞向30%~50%左右满皿底面积生长时分别进行3 d的细胞转染处理,在此过程中严格依据组别,SIRT1激动剂(SRT1720)对细胞进行干预后,将新鲜无双抗培养液加入其中孵育。将MOI:20的SP菌悬液加入到各孔中,对照组除外,进行6 h的感染后将感染终止。将PBS预处理细胞设定为对照组,将SPS感染设定为SP组,将SP感染+75 nmol/L si-SIRT1序列②转染3 d设定为si-SIRT1+SP组,将SP感染+25 μmol/L的SRT1720预赋予1 d设定为SRT1720+SP组,将SP感染+25 μmol/L DMSO预孵育 1 d设定为 DMSO+SP组,各组均进行3次重复。采用LDH细胞毒性试验对各组细胞活力进行检测,采用qRT-PCR对BEAS-2B及A549细胞SIRT1及LL-37 mRNA表达进行检测,采用ELISA对BEAS-2B及A549细胞上清液LL-37浓度进行检测[11-18]。
1.4 统计学分析
采用SPSS21.0统计学软件,qRT-PCR检测A549细胞的SIRT1沉默效果、Western Blot检测A549细胞的SIRT1沉默效果、五组对BEAS-2B及A549细胞毒性活力的影响、SIRT1对 SP诱导 BEAS-2B及A549细胞表达LL-37 mRNA的影响等计量资料用(±s)表示,采用 t检验,检验水准 α=0.05。
2 结果
2.1 qRT-PCR检测A549细胞的SIRT1沉默效果
si-SIRT1序列①组、si-SIRT1序列②组的SIRT1 mRNA均显著低于对照组(P<0.05),而si-SIRT1序列②组的SIRT1 mRNA又显著低于si-SIRT1序列①组(P<0.05),见表 2。
表2 qRT-PCR检测A549细胞的SIRT1沉默效果(±s)

表2 qRT-PCR检测A549细胞的SIRT1沉默效果(±s)
注:与si-SIRT1序列①组比较,#P<0.05;与对照组比较,*P<0.05
组别 独立试验次数 SIRT1 mRNA对照组si-SIRT1序列①组si-SIRT1序列②组siRNA-NC组lipo组F值P 33333 1.05±0.11 0.70±0.12*0.15±0.04#*0.93±0.10 1.12±0.10 42.660<0.05
2.2 Western Blot检测A549细胞的SIRT1沉默效果
si-SIRT1序列①组、si-SIRT1序列②组的SIRT1/β-actin均显著低于对照组(P<0.05),lipo组的SIRT1/β-actin显著高于对照组(P<0.05),但 siRNA-NC组和对照组的SIRT1/β-actin之间的差异不显著 (P>0.05),si-SIRT1 序 列 ① 组 、si-SIRT1 序 列 ② 组 的SIRT1/β-actin 之间的差异也不显著(P>0.05),见表3。
2.3 五组对BEAS-2B及A549细胞毒性活力的影响比较
SP组、si-SIRT1+SP组的BEAS-2B及A549细胞毒性均显著高于对照组(P<0.05),而si-SIRT1+SP组的BEAS-2B及A549细胞毒性又均显著高于SP组(P<0.05),见表 4。
表3 Western Blot检测A549细胞的SIRT1沉默效果(±s)

表3 Western Blot检测A549细胞的SIRT1沉默效果(±s)
注:与对照组比较,*P<0.05
组别 独立试验次数 SIRT1/β-actin对照组si-SIRT1序列①组si-SIRT1序列②组siRNA-NC组lipo组F值P 33333 0.23±0.01 0.14±0.01*0.11±0.01*0.20±0.01 0.40±0.03*72.530<0.05
表4 五组对BEAS-2B及A549细胞毒性活力的影响比较(±s,%)
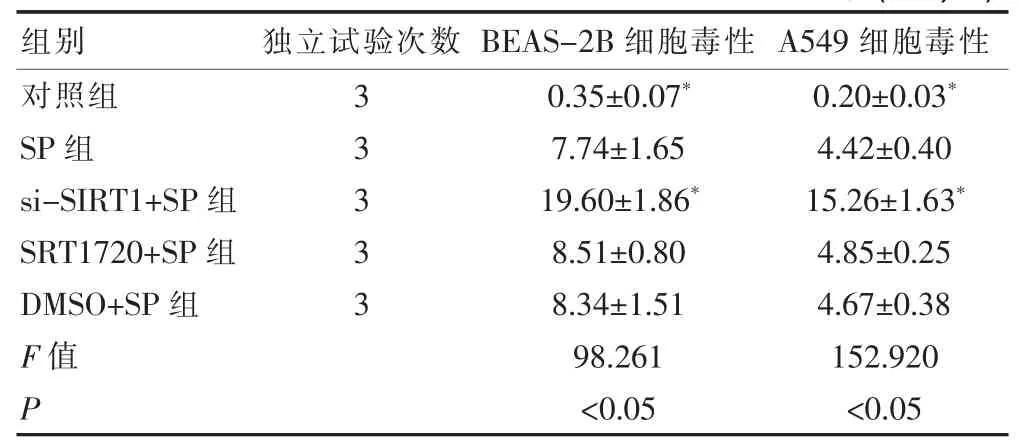
表4 五组对BEAS-2B及A549细胞毒性活力的影响比较(±s,%)
注:与SP组比较,*P<0.05
组别 独立试验次数 BEAS-2B细胞毒性 A549细胞毒性对照组SP组si-SIRT1+SP组SRT1720+SP组DMSO+SP组F值P 33333 0.35±0.07*7.74±1.65 19.60±1.86*8.51±0.80 8.34±1.51 98.261<0.05 0.20±0.03*4.42±0.40 15.26±1.63*4.85±0.25 4.67±0.38 152.920<0.05
2.4 SIRT1对SP诱导BEAS-2B及A549细胞表达LL-37 mRNA的影响
2.4.1 SIRT1对SP诱导BEAS-2B细胞表达LL-37mRNA的影响 BEAS-2B细胞方面,si-SIRT1+SP组的SIRT1 mRNA 显著低于 SP 组(P<0.05),LL-37 mRNA显著高于SP组(P<0.05);SRT1720+SP组的SIRT1 mRNA显著高于SP组(P<0.05),LL-37 mRNA显著低于SP 组(P<0.05)。 SP 组、SRT1720+SP 组、DMSO+SP 组的 SIRT1 mRNA均显著高于对照组 (P<0.05),si-SIRT1+SP组的SIRT1 mRNA显著低于对照组 (P<0.05);SP 组、si-SIRT1+SP 组的 LL-37 mRNA均显著高于对照组 (P<0.05),SRT1720+SP组的LL-37 mRNA显著低于对照组(P<0.05),但DMSO+SP组和对照组的LL-37 mRNA之间的差异不显著(P>0.05),见表5。
表5 SIRT1对SP诱导BEAS-2B细胞表达LL-37mRNA的影响(±s)
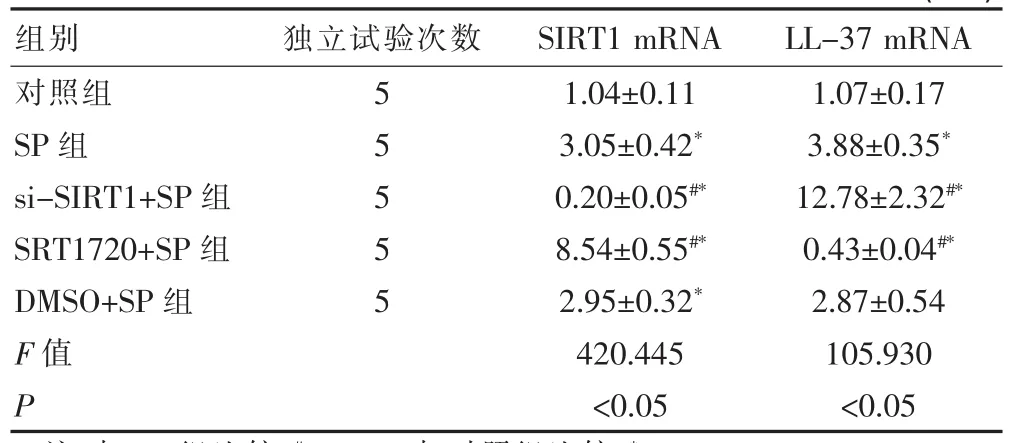
表5 SIRT1对SP诱导BEAS-2B细胞表达LL-37mRNA的影响(±s)
注:与SP组比较,#P<0.05;与对照组比较,*P<0.05
组别 独立试验次数 SIRT1 mRNA LL-37 mRNA对照组SP组si-SIRT1+SP组SRT1720+SP组DMSO+SP组F值P 55555 1.04±0.11 3.05±0.42*0.20±0.05#*8.54±0.55#*2.95±0.32*420.445<0.05 1.07±0.17 3.88±0.35*12.78±2.32#*0.43±0.04#*2.87±0.54 105.930<0.05
2.4.2 SIRT1对SP诱导A549细胞表达LL-37 mR-
NA的影响 A549细胞方面,si-SIRT1+SP组的SIRT1mRNA显著低于SP组(P<0.05),LL-37 mRNA显著高于SP 组(P<0.05);SRT1720+SP 组的SIRT1 mRNA 显著高于 SP组(P<0.05),LL-37 mRNA 显著低于 SP组(P<0.05)。SP组、SRT1720+SP组、DMSO+SP组的 SIRT1 mRNA均显著高于对照组 (P<0.05),si-SIRT1+SP组的 SIRT1 mRNA 显著低于对照组(P<0.05);SP组、si-SIRT1+SP组的LL-37 mRNA均显著高于对照组 (P<0.05),SRT1720+SP组的LL-37 mRNA显著低于对照组(P<0.05),但DMSO+SP组和对照组的LL-37 mRNA之间差异不显著(P>0.05),见表6。
表6 SIRT1对SP诱导A549细胞表达LL-37 mRNA的影响(±s)
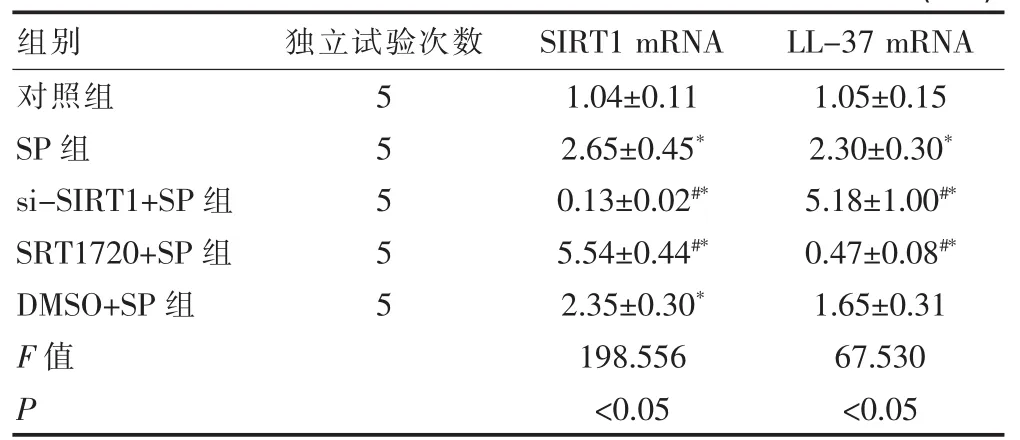
表6 SIRT1对SP诱导A549细胞表达LL-37 mRNA的影响(±s)
注:与SP组比较,#P<0.05;与对照组比较,*P<0.05
组别 独立试验次数 SIRT1 mRNA LL-37 mRNA对照组SP组si-SIRT1+SP组SRT1720+SP组DMSO+SP组F值P 55555 1.04±0.11 2.65±0.45*0.13±0.02#*5.54±0.44#*2.35±0.30*198.556<0.05 1.05±0.15 2.30±0.30*5.18±1.00#*0.47±0.08#*1.65±0.31 67.530<0.05
3 讨论
SIRT1的生物学作用广泛,能够对NAD+依赖性蛋白进行催化,促进其乙酰化的发生,在转录、代谢过程中作为调节因子发挥极为重要的作用[19-21]。LL-37受外源性微生物成分和内源性信号分子刺激诱导产生,其表达调控机制复杂多样,彼此存在交叉对话,且存在细胞种类和微环境刺激特异性。在细胞非应激状态时,l,25-二羟基维生素 D3[1,25-dihydroxyvitamin D3,l,25(OH)2D3],在多种调控 LL-37 表达因子中起枢纽作用,多种物质可经维生素D3依赖机制放大其诱导效应。细胞因子可通过维生素D3介导或其他作用机制放大其诱导LL-37表达效应。在外界干扰触发内质网应激时,NF-κB.C/EBPa通路在表达调控中起关键作用。细胞分化状态亦参与LL-37的表达调控。最近应用无标记质谱定量分析的生物信息学软件又发现TR/RXR激活、类花生酸信号和类固醇生物合成这三种新型信号通路参与LL-37的表达调节。相关医学研究表明[22-25],SP对BEAS-2B细胞活性造成损伤的方式为MOI与感染时间依赖性,SP感染BEAS-2B及A549细胞能够对LL-37表达进行诱导,在机体免疫防御反应中参与。与A549细胞相比,BEAS-2B细胞SP(MOI20)感染6 h及未感染状态下均具有显著较高的LL-37蛋白表达,以此认为LL-37表达可能具有细胞特异性。SP感染时,在BEAS-2B及A549细胞LL-37表达中,SIRT1均发挥着负性调节作用。
本研究结果表明,si-SIRT1序列①组、si-SIRT1序列②组的SIRT1 mRNA均显著低于对照组 (P<0.05),而si-SIRT1序列②组的SIRT1 mRNA又显著低于si-SIRT1序列①组 (P<0.05);si-SIRT1序列①组、si-SIRT1序列②组的SIRT1/β-actin均显著低于对照组(P<0.05),lipo 组的 SIRT1/β-actin 显著高于对照组(P<0.05),但 siRNA-NC 组和对照组的 SIRT1/βactin之间的差异不显著 (P>0.05),si-SIRT1序列①组、si-SIRT1序列②组的SIRT1/β-actin之间的差异也不显著 (P>0.05);SP组、si-SIRT1+SP组的 BEAS-2B及A549细胞毒性均显著高于对照组(P<0.05),而si-SIRT1+SP组的BEAS-2B及A549细胞毒性又均显著高于SP组 (P<0.05);BEAS-2B细胞及A549细胞方面,si-SIRT1+SP组的SIRT1 mRNA显著低于SP组(P<0.05),LL-37 mRNA 显著高于 SP 组(P<0.05);SRT1720+SP组的SIRT1 mRNA显著高于SP组 (P<0.05),LL-37 mRNA 显著低于 SP 组(P<0.05)。SP 组、SRT1720+SP组、DMSO+SP组的SIRT1 mRNA均显著高于对照组(P<0.05),si-SIRT1+SP组的SIRT1 mRNA显著低于对照组 (P<0.05);SP组、si-SIRT1+SP组的LL-37 mRNA均显著高于对照组(P<0.05),SRT1720+SP组的LL-37 mRNA显著低于对照组 (P<0.05),但DMSO+SP组和对照组的LL-37 mRNA之间的差异不显著(P>0.05),和上述相关医学研究结果一致。
总之,SIRT1对肺炎链球菌感染肺上皮细胞诱导LL-37表达起负性调节作用,值得临床充分重视。
[参考文献]
[1]中华医学会儿科分会呼吸学组.儿童社区获得性肺炎管理指南(2013 修订)(上)[J].中华儿科杂志,2013,51(10):745-752.
[2]景春梅,王偲.2009-2014年重庆地区儿童感染肺炎链球菌的耐药性及血清分型研究[J].中国抗生素杂志,2016,41(1):64-69.
[3]黄燕颖,张新蔚,楼永良,等.肺炎链球菌StkP激酶与β-内酰胺类抗生素结合能力及耐药相关性分析[J].中华微生物学和免疫学杂志,2017,37(6):424-430.
[4]胡付品,朱德妹,汪复,等.2015年 CHINET细菌耐药性监测[J].中国感染与化疗杂志,2016,16(6):685-694.
[5]马绍磊,王宇杰,曹权,等.肺炎链球菌尿抗原检测对成人社区获得性肺炎链球菌肺炎诊断效能的Meta分析[J].中华危重病急救医学,2016,28(6):528-533.
[6]郭映辉,何宝花,王颖童,等.182株儿童患者肺炎链球菌的分子生物学鉴定及分型[J].中国感染控制杂志,2017,16(4):326-329.
[7]陈长会,史伟,彭拥军,等.中国西部单中心二级医院呼吸道感染住院患儿鼻咽部肺炎链球菌携带及其血清型和耐药性的横断面调查[J].中国循证儿科杂志,2016,11(4):241-246.
[8]文德年,刘莹,史伟,等.中国西部某二级医院呼吸道感染住院患儿鼻咽部肺炎链球菌中常见非PCV13血清型菌株的横断面调查[J].中国循证儿科杂志,2017,12(3):180-184.
[9]姚开虎,史伟.儿童肺炎链球菌耐药现状[J].中华实用儿科临床杂志,2016,(4):252-256.
[10]郝丽丽,王智楠,张振,等.儿童急性中耳炎肺炎链球菌分离株的临床分布特点和药物敏感性分析[J].中国感染与化疗杂志,2016,16(5):597-601.
[11]李津金,王毅军,芮庆林,等.上感颗粒对肺炎链球菌感染性肺炎小鼠白细胞、C反应蛋白和肺指数的影响[J].中国中医急症,2017,26(8):1368-1371.
[12]陈文标,朱焱,黄东红,等.临床分离的肺炎链球菌耐药性分析及多位点序列分型[J].中国抗生素杂志,2016,41(1):60-63.
[13]陈涛.肺炎链球菌血清型分布及耐药性研究[J].中国医药导报,2017,14(23):134-136.
[14]张新蔚,黄燕颖,楼永良,等.肺炎链球菌CiaR调控pbps和csRNAs基因表达作用及其与耐药相关性[J].中华微生物学和免疫学杂志,2017,37(1):48-56.
[15]潘庭荣,黄梅,陈远平,等.肺炎链球菌血清学、PFGE型别与流行和耐药的关联性分析[J].检验医学与临床,2017,14(11):1547-1549.
[16]王荃,武洁,刘珺,等.儿童重症监护病房中侵袭性肺炎链球菌病的临床特点和预后分析[J].中华实用儿科临床杂志,2016,31(18):1400-1404.
[17]王卫中,田静,李艳微,等.美洛西林联合阿奇霉素治疗小儿肺炎链球菌肺炎疗效及影像学特征观察[J].河北医药,2017,39(19):2947-2949.
[18]周杰,罗红,杨光,等.肺炎链球菌自溶素蛋白LytA对社区获得性肺炎的血清学诊断意义[J].中华检验医学杂志,2017,40(3):217-220.
[19]高薇,史伟,陈长会,等.临床肺炎链球菌常见序列型青霉素耐药性的流行病学研究[J].遗传,2016,38(10):940-947.
[20]唐玫琴,田发青,李举亨,等.肺炎链球菌疫苗抗原促进CRTH2(CD4+CD294+Th2)细胞增殖的实验研究[J].中国感染控制杂志,2017,16(10):916-919,930.
[21]余维丽,鹿中华,杨翔,等.肺炎链球菌Spr0982的表达纯化及保守性分析[J].生物加工过程,2017,15(4):64-69.
[22]薛辉,朱艳芳.高海拔地区藏族儿童急性下呼吸道感染病原菌分布与药敏分析[J].中国现代医生,2015,53(26):76-78.
[23]古奕文,张煜华,马远平,等.梅州地区婴幼儿社区获得性肺炎病原学分析[J].中国现代医生,2015,53(1):52-54.
[24]Burgos J,Lujan M,Larrosa MN,et al.The problem of early mortality in pneumococcal pneumonia:A study of risk factors[J].Eur Respir J,2015,46(2):561-564.
[25]Vematter J,Pirofski LA.Current concepts in host-microbe interaction leading to pneumococcal pneumonia[J].Curr Opin Infect Dis,2013,26(3):277-283.



