杨春勇 曲大鹏 金若天
[摘要] 目的 观察非甾体类抗炎药物(NSAIDs)塞来昔布(celecoxib)对结肠癌细胞Wnt信号通路的影响,探讨塞来昔布抑制结肠癌细胞生长的机制。方法 MTT法测定塞来昔布(0、20、40、60、80和100 μmol/L)对人结肠癌SW480细胞生长的影响;应用免疫细胞化学方法分析塞来昔布(0、20、40和80 μmol/L)处理48 h后细胞中β-catenin蛋白的分布表达情况;应用RT-PCR法分析塞来昔布(0、20、40和80 μmol/L)处理48 h后细胞中C-myc mRNA的表达水平。结果 MTT结果显示,塞来昔布能够抑制结肠癌细胞的生长增殖,且有剂量依赖性(P<0.05)和时间依赖性(P<0.05);免疫细胞化学法检测结果显示,细胞浆及细胞核内β-catenin蛋白随着塞来昔布浓度的增加表达显著下降(P<0.05); RT-PCR法检测结果显示,随着塞来昔布浓度的增加,C-myc mRNA表达下降,且呈剂量依赖性(P<0.05)。结论 塞来昔布可以通过调控Wnt/β-catenin信号通路抑制结肠癌细胞增殖。
[关键词] 塞来昔布;结肠癌;Wnt信号通路;β-catenin蛋白
[中图分类号] R735.3 [文献标识码] A [文章编号] 1673-9701(2022)05-0026-04
[Abstract] Objective To observe the effect of non-steroidal anti-inflammatory drugs (NSAIDs) celecoxib on Wnt/β-catenin signaling pathway in colon cancer SW480 cells and explore the molecular mechanism of celecoxib inhibiting the growth of colon tumors. Methods The effects of different concentrations of celecoxib (0, 20, 40, 60, 80, and 100 μmol/L) on the proliferation of SW480 cells were determined by MTT assay. Immunocytochemistry was used to analyze the distribution and expression of the β-catenin protein in the cells treated with different concentrations of celecoxib (0, 20, 40, and 80 μmol/L) for 48 hours. RT-PCR was used to analyze the expression levels of C-myc mRNA in the cells treated with different concentrations of celecoxib (0, 20, 40, and 80 μmol/L) for 48 hours. Results MTT assay showed that celecoxib could inhibit the proliferation of colon cancer cells in a concentration-dependent (P<0.05) and time-dependent (P<0.05) manner. Immunocytochemistry showed that the expression of the β-catenin protein in plasma and nucleus decreased significantly with the increase of celecoxib concentration (P<0.05). RT-PCR showed that the expression of C-myc mRNA decreased with the increase of celecoxib concentration in a dose-dependent manner (P<0.05). Conclusion Celecoxib can inhibit the proliferation of colon cancer cells by regulating the Wnt/β-catenin signaling pathway.
[Key words] Celecoxib; Colon cancer; Wnt signaling pathway; β-catenin protein
随着人们物质生活水平的提高,导致生活方式的改变和生活环境的恶化,结肠癌的发病率逐年增加,成为世界上第三大最常见的癌症,也是癌症死亡的第二大主要原因。Globbocan的统计数据显示,2018年全球共有180万结直肠癌病例和88.1万人死亡,占所有癌症发病率的10.2%,占所有癌症相关死亡率的9.2%[1]。手术和化疗仍是最迫切的治疗方法,然而化疗的长期毒副作用和耐药性的发展构成了一个重大挑战。前期研究表明,非甾体类抗炎药物(NSAIDs)塞来昔布能够抑制结肠癌细胞生长及促进凋亡[2],但其具体机制尚不明确,而Wnt/β-catenin通路在人类多种肿瘤的发生发展过程中起着决定性的作用,尤其是结直肠癌。本文通过研究塞来昔布对人结肠癌细胞(SW480细胞)Wnt/β-catenin信号通路的关键蛋白β-catenin及其下游的靶基因C-myc mRNA的影响,进一步探讨塞来昔布作用于Wnt/ β-catenin信号通路的机制,为塞来昔布用于结直肠肿瘤的治疗提供临床试验基础和理论基础,现报道如下。
1 材料与方法
1.1 材料来源
1.1.1 主要药物、试剂和材料 人结肠癌细胞(SW480)株购自中科院肿瘤研究所,塞来昔布胶囊(美国辉瑞制药公司,USA,每粒0.2 g,国药准字J20120063),羊抗鼠IgG和羊抗兔IgG(康为世纪公司,北京),PCR逆转录试剂盒和鼠抗人β-actin单抗(Bioworlde Tecnology Inc,USA),PVDF膜(Millipore公司,USA),RPMI1640、胰蛋白酶、BCA Protein Assay Reagent 、DMSO、MTT、兔抗人β-catenin多抗(Amresco公司,USA), ECL、 Trizol和TBE(碧云天生物技术研究所公司,江苏),Marker(Multisciences,USA)。
1.2 细胞培养
SW480细胞培养基为10%的新生牛血清RPMI-1640,培养环境为37℃、5%CO2饱和湿度。
1.3 MTT法检测细胞生长抑制情况
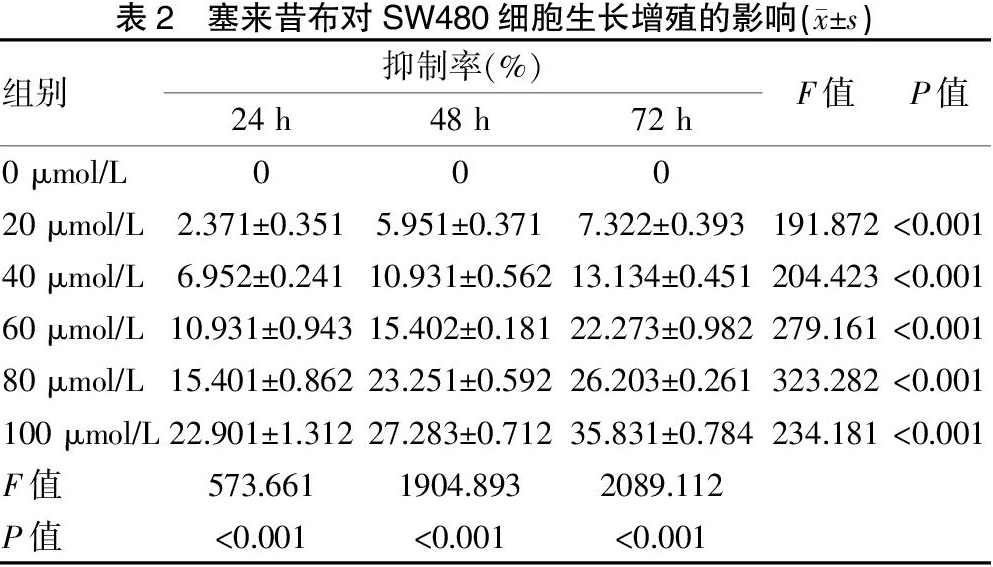
取SW480细胞,将对数生长期的细胞以2×108/L 的密度,每瓶1 ml接种于100 ml培养瓶中,再加培养基至5 ml,同步化24 h,每瓶分别加入终浓度分别为0、20、40、60、80和100 μmol/L的含有塞来昔布培养液。每个浓度设4个复孔。处理24、48和72 h后,分别避光下加入MTT(5 mg/ml)20 μl,再次培养4 h,弃去培养液,然后加入DMSO(二甲基亚砜),静置10 min,将孔板置于490 nm酶标仪,检测吸光度值(A),然后分别计算不同浓度塞来昔布处理组的细胞生长抑制率(IR)。计算公式为:IR(%)=(对照组A值-实验组A值)/对照组A值×100%。重复3次。
1.4 免疫细胞化学法测定SW480细胞经不同浓度塞来昔布处理后β-catenin蛋白情况
1.4.1 实验分组 实验设4个组别,分别为对照组(0 μmol/L塞来昔布)和实验组(20、40和80 μmol/L塞来昔布)。
1.4.2 细胞处理 将对数生长期SW480细胞,接种于6孔培养板(每孔5×105个细胞)。培养时间为24 h,然后去除培养液,PBS洗2~3遍,再次加入不含小牛血清培养液2 ml,同步化24 h,按组加入塞来昔布,继续培养48 h。至48 h,弃去培养板内培养液,PBS冲洗2~3次;应用95%的酒精固定,时间为15 min,PBS冲洗2遍;加入适量去离子水(3%H2O2),室温孵育,时间20 min,再次冲洗;滴加动物血清,再次孵育,时间为15 min;丢弃动物血清;滴加β-catenin一抗,浓度为1∶50,4℃孵育过夜,再次PBS冲洗,2~3次;然后滴加β-catenin二抗,孵育,时间10 min,反复应用PBS冲洗3次;然后滴加辣根酶标记链霉卵白素,再次孵育,时间为15 min,然后冲洗3次;滴加DAB溶液,然后显色10 min;应用流动清水冲洗,再次应用苏木素复染,时间为5 s,再次冲洗,显微镜观察,应用盐酸酒精,分化浓度为1%,再次应用自来水冲洗,再次应用酒精脱水,浓度梯度由低到高,分别为75%,时间2 min、80%,时间2 min、90%,时间2 min、95%,时间2 min、100%,时间2 min,然后应用二甲苯Ⅰ和二甲苯Ⅱ处理,时间为5 min,再用中性树胶,封片。颜色为棕褐色、棕黄色、黄色和淡黄色,表明阳性由强到弱。利用图像分析系统(Video Pro32),选取440倍4个随机视野,测量光密度,然后计算并记录平均光密度值(AOD),然后统计分析。
1.5 RT-PCR检测C-myc mRNA表达
1.5.1 mRNA提取 将各组细胞分别加入100 ml的无菌培养瓶中,再次加入Trizol裂解液2 ml,置于冰上,时间为5 min,将裂解后的细胞组织吸入1.5 ml的离心管;再次加入氯仿200 μl,混匀,放置冰上5 min;然后于4℃离心机(12 000 转/min)离心,时间为15 min,将上清液加入1.5 ml 的EP管(无菌无酶)中,加入等量异丙醇(1∶1),混匀,常温放置,时间为10 min;再次离心机离心,时间10 min,吸去上清液;然后加入适量酒精∶无酶水(3∶1)的酒精(75%)适量,反复清洗3次;再次置于4℃离心机,7500 转/min,离心5 min,倒掉上清液,干燥5 min;加入无酶水20 ml, 至RNA沉淀彻底溶解。取5 μl样品进行RNA的质量检测。实验重复3遍。
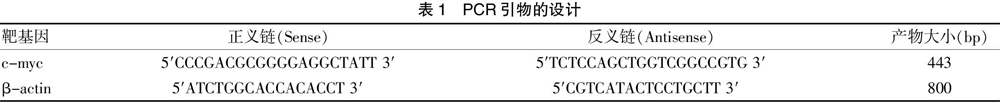
1.5.2 mRNA扩增 利用Premier软件,分别设计C-myc和β-actin引物,交由生物公司合成。取各组5 μl反应产物,按试剂盒说明书进行基因扩增。见表1。
1.6 统计学处理
采用SPSS 24.0统计学软件进行数据分析。计量资料以均数±标准差(x±s)表示,组间比较应用单因素方差分析,组内比较应用LSD-t检验, P<0.05为差异有统计学意义。
2 结果
2.1 塞来昔布对人结肠癌SW480细胞生长的影响
MTT方法结果显示,应用不同浓度的塞来昔布分别处理SW480细胞,生长抑制率随药物浓度的增加而增高(P<0.001),随作用时间(24、48和72 h)的延长而增高(P<0.001)。见表2、封三图2。表明塞来昔布抑制结肠癌SW480细胞的生长增殖具有时间及剂量依赖性[3]。
2.2 免疫细胞化学法测定不同浓度塞来昔布对SW480细胞中β-catenin 蛋白分布和表达的影响
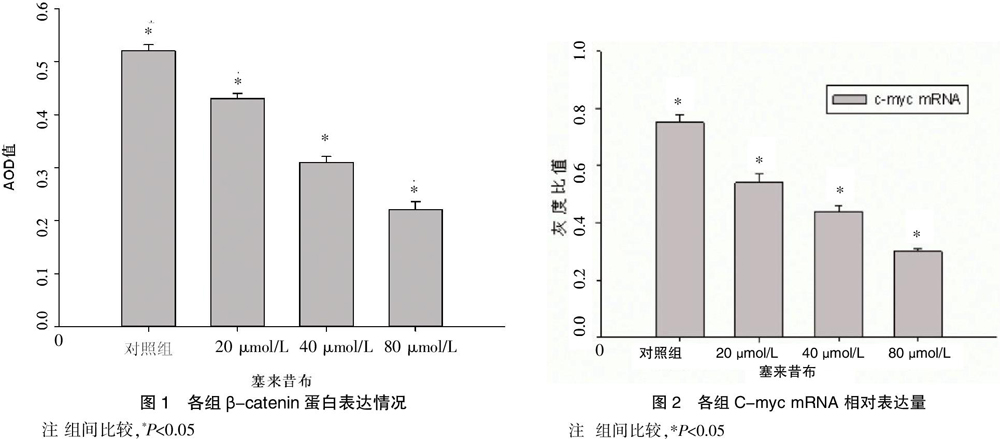
免疫细胞化学结果阳性细胞由强到弱分别表现为棕褐色、棕色、黄色、淡黄色。封三图3结果显示,对照组阳性颗粒(β-catenin)大部分位于细胞胞浆,为强阳性棕褐色;塞来昔布处理组阳性颗粒主要位于胞浆,随着给药药物浓度增加细胞胞浆内阳性颗粒明显减少,为弱阳性。图1结果显示,各浓度塞来昔布药物组与对照组比较及组间比较,差异有统计学意义(P<0.05),提示随塞来昔布浓度增加,SW480细胞胞浆和胞核内β-catenin蛋白的表达逐渐减弱。
2.3 塞来昔布对SW480细胞中C-myc mRNA表达的影响
RT-PCR结果显示,塞来昔布(20、40和80 μmol/L)处理结肠癌细胞48 h后,C-myc mRNA 的表达随其浓度的增加而逐渐减少,差异有统计学意义(P<0.05),提示塞来昔布可以减少结肠癌SW480细胞C-myc mRNA 的表达。见封三图4、图2。
3 讨论
结直肠癌是最常见的消化道恶性肿瘤之一,2020年发布的中国癌症统计报告显示,截至2018年,我国的结直肠癌发病率位居所有肿瘤的第3位,死亡率位居第5位,其中新发病例37.6万,死亡病例19.1万[3]。结直肠癌的治疗是以手术为主、放化疗为辅助的综合治疗,而各种化疗药物均具有一定的毒副作用,靶向治疗及免疫治疗药物比较昂贵,因此患者往往不能耐受其副作用或者承担其高昂的费用,这就需要一种具有肿瘤抑制作用而毒副作用低、价格优惠的抗肿瘤药物。本文前期研究表明,NSAIDs塞来昔布具有抑制结肠癌细胞增殖、促进其凋亡的作用[2],与Gurpinar等[4]和Arico等[5]的研究一致。而大量研究也表明,塞来昔布对胃癌[6]、肺癌[7]、乳腺癌[8]、口腔癌[9]等肿瘤有抑制作用。但其具体抗肿瘤机制不详。本文前期研究表明,塞来昔布对Wnt信号通路有一定抑制作用,但其具体作用尚不明确。
Wnt信号通路的异常激活与人体多种肿瘤的形成和进展关系密切[10-11],研究表明其异常激活与结肠癌形成及发展也具有密切关系[12-14]。Wnt信号通路发生机制如下:①无异常信号刺激时,细胞胞浆内APC蛋白、β-catenin蛋白、Axin蛋白和GSK3β蛋白结合,形成 “降解复合体”,进而被E3泛素联接酶识别,最终被降解。②有异常信号刺激时,Wnt信号通路被激活,Wnt蛋白与Frizzled蛋白和LRP5/6蛋白结合,导致Dvl蛋白与Axin蛋白结合,导致“降解复合体”形成受阻,使得β-catenin蛋白因不能被降解而在细胞浆内累积并最终进入细胞核内,与细胞核内TCF/LEF因子结合,进而激活其下游的靶基因,如C-myc、MMP-7、CD 44、Cyclin D等[15-17]。本文前期试验表明,塞来昔布能够增加磷酸化β-catenin蛋白的表达,并减少β-catenin蛋白表达[3],本研究从细胞层面再次验证了塞来昔布可以减少细胞内β-catenin蛋白的累积,促进其降解,表明其对Wnt信号通路具有抑制作用。
C-myc基因定位于染色体8q24[18],C-myc易位启动C-myc的转录,使C-myc过度表达,从而引起细胞癌变,最终导致肿瘤的发生。研究表明,c-myc基因与多种肿瘤发生发展密切有关[18-20],且大量研究表明,c-myc为Wnt信号通路的靶基因[21-23],Wnt信号通路激活可促进C-myc的表达,从而促进肿瘤发生发展,抑制Wnt信号通路可以减少其表达。本次试验表明,塞来昔布可以减少C-myc的表达,进一步证明塞来昔布对Wnt信号通路下游靶基因表达也有抑制作用。
综上所述,塞来昔布通过抑制Wnt/β-catenin信号通路而抑制结肠癌细胞生长增殖的机制。但是塞来昔布对Wnt信号通路其他相关蛋白(如Axin蛋白、APC蛋白、GSK3β蛋白和CK1蛋白等)作用及其下游其他靶基因(Cyclin D、MMP-7、CD44和Claudin-1等)的影响,以及体外实验结果如何将需要进一步研究验证。
[参考文献]
[1] Bray F,Ferlay J,Soerjomataram I,et al. Globalcancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwidefor 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[2] 杨春勇,金若天,梁庆模.塞来昔布通过Wnt/β-catenin信号通路对人结肠癌细胞SW480的影响[J].中国医药导报,2016,13(21):54-57.
[3] 中华人民共和国国家卫生健康委员会.中国结直肠癌诊疗规范(2020版)[J].中华消化外科杂志,2020,19(6):563-594.
[4] Gurpinar E,Grizzle WE,Piazza GA.COX-independent mechanisms of cancer chemoprevention by antiinflam-matory drugs[J].Front Oncol,2013,3:181.
[5] Arico S,Pattingre S,Bauvy C,et al.Celecoxib induces apoptosis by inhibiting 3-phosphoinositide-dependent protein kinase-1 activity in the human colon cancer HT-29 cell line[J].J Biol Chem,2002,277(31):27613-27 621.
[6] 王云峰,李建,葛成华,等.塞来昔布对不表达环氧合酶-2的胃癌细胞生长的影响[J].世界华人消化杂志,2009,17(35):3583-3589.
[7] Gharghabi M,Rezaei F,Mir Mohammadrezaei F,et al.Celecoxib treatment alters p53 and MDM2 expression via COX-2 crosstalk in A549 cells[J].Iran J Pharm Res,2016, 15(2):483-489.
[8] Chiang SL,Velmurugan BK,Chung CM.Preventive effect of celecoxib use against cancer progression and occur- rence of oral squamous cell carcinoma[J].Sci Rep,2017, 7(1):6235.
[9] Wang G,Li J,Zhang L,et al.Celecoxib induced apoptosis against different breast cancer cell lines by down-regulated NF-kappaB pathway[J].Biochem Biophys Res Commun,2017,490(3):969-976.
[10] 杨春勇,梁庆模. Wnt与MAPK信号通路在肿瘤发生中的串话[J].医学分子生物学杂志,2010,7(5):441-447.
[11] Nusse R,Clevers H.Wnt/β-catenin signaling,disease,and emerging therapeutic modalities[J].Cell,2017,169:985-999.
[12] Flores-Hernández E,Velázquez DM,Casta?觡eda-Patlán MC,et al.Canonical and non-canonical Wnt signaling are simultaneously activated by Wnts in colon cancer cells[J]. Cell Signal,2020,72:109 636.
[13] Kim H, Yu Y, Choi S,et al. Evodiamine eliminates colon cancer stem cells via suppressing notch and Wnt signaling[J]. Molecules,2019,24(24):4520.
[14] Tran TQ,Hanse EA,Habowski AN,et al. α-Ketoglutarate attenuates Wnt signaling and drives differentiation in colorectal cancer[J]. Nat Cancer,2020,1(3):345-358.
[15] Zeng X,Huang H,Tamai K,et al.Initiation of Wnt signaling:Control of Wnt coreceptor Lrp6 phosphory- lation/activation via frizzled,dishevelled and axin functions[J].Development,2008,135(2):367-375.
[16] Gordon MD, Nusse R. Wnt signaling:Multiple pathways, multiple receptors,and multiple transcription factors[J].J Biol Chem,2006,281(32):22 429-22 433.
[17] Krishnan V,Bryant HU,Macdougald OA. Regulation of bone mass by Wnt signaling[J].J Clin Invest,2006,116(5):1202-1209.
[18] Yoshida GJ. Emerging roles of Myc in stem cell biology and novel tumortherapies[J].J Exp Clin Cancer Res,2018, 37(1):173.
[19] Farrell AS,Sears RC. MYC degradation[J].Cold Spring Harb Perspect Med,2014,4(3):a014 365.
[20] Dang CV. MYC on the path to cancer[J]. Cell,2012,149(1):22-35.
[21] Wang Q,Zhou Y,Rychahou P,et al. Deptor is a novel target of Wnt/β-Catenin/c-Myc and contributes to colorectal cancer cell growth[J].Cancer Res,2018,78(12):3163-3175.
[22] Guinney J, Dienstmann R, Wang X,et al. The consensus molecular subtypes of colorectal cancer[J].Nat Med,2015, 21(11):1350-1356.
[23] Vallée A,Guillevin R,Vallée JN. Vasculogenesis and ang- iogenesis initiation under normoxic conditions through Wnt/β-catenin pathway in gliomas[J].Rev Neurosci,2018, 29(1):71-91.
(收稿日期:2021-09-22)



