黄正杰 张 楠
(浙江大学建筑设计研究院,浙江杭州 310028)
0 引言
活化硅酸作为助凝剂在给水处理中应用已有几十年的历史,在强化低温水的混凝、提高除浊效率、降低混凝剂的用量等方面效果显著,在给水处理领域具有很好的应用空间。但由于配制时易凝胶化、保存期短等缺点,限制了它的广泛使用。本研究的目的即在于寻求活化硅酸制备合适条件及长时间保存的方法,以期为广泛应用活化硅酸助凝提供有益的参考。
1 活化硅酸活化及助凝机理
通常采用水玻璃为原料经加酸活化制取活化硅酸,水玻璃的主要成分是硅酸钠。在水玻璃原液中,硅酸钠能水解,其反应如下:
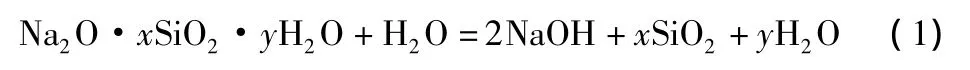
平衡时,溶液中存在三种物质:1)硅酸钠,保持原状;2)氢氧化钠;3)游离的二氧化硅(以硅酸的形式存在)。此时溶液pH值较高,一般在12~13之间,而游离的二氧化硅不多。加酸活化后,部分硅酸钠与酸发生如下反应(以硫酸为例):
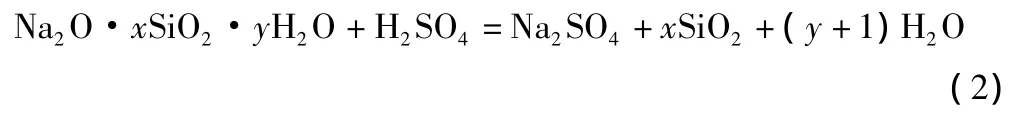
而其余的硅酸钠仍处于水解平衡状态。综合考虑式(1)、式(2),活化硅酸溶液中除了中性的Na2SO4外,仍有硅酸钠水溶液中的三种物质。但其中的 NaOH因部分被 H2SO4中和,所余NaOH仅是部分硅酸钠水解产生的。故溶液pH值比硅酸钠溶液有所降低。同时,游离出来的SiO2(以硅酸的形式存在)会发生聚合作用,从而形成硅酸高分子。
戴安邦[1]教授认为,在中性、碱性介质中,活化硅酸的聚合作用主要发生在硅酸中性分子和负一价硅酸离子之间,反应生成的二聚硅酸属于中性分子,其中一部分可与OH-继续反应生成的负一价二聚硅酸离子,而负一价二聚硅酸离子又可进一步与二聚硅酸分子或硅酸分子继续聚合,如此进行下去直至溶液全部形成凝胶。哈尔滨工业大学的于水利[2]对此进行研究,证实了戴安邦教授的结论。
2 活化硅酸的制取
实验采用水玻璃:SiO2含量28.8%,模数 3.26,密度 1.4 kg/L,pH=12.78,溶液澄清。实验混凝剂采用液态聚合氯化铝(PAC),Al2O3含量 9.5%。
活化硅酸的制取需控制合适的酸化剂的量和活化时间,即控制合适的中和度和活化度。
2.1 中和度的控制
酸化剂的量用中和度来表示,当采用硫酸作为活化剂,其中和度的表达式为:

对于一定SiO2浓度和体积的水玻璃而言,中和度表征了加硫酸的量,同时也对应一定的溶液pH值和形成凝胶的时间。
表1为三种不同二氧化硅浓度的水玻璃溶液在凝胶时间基本相同的情况下,中和度的区别。
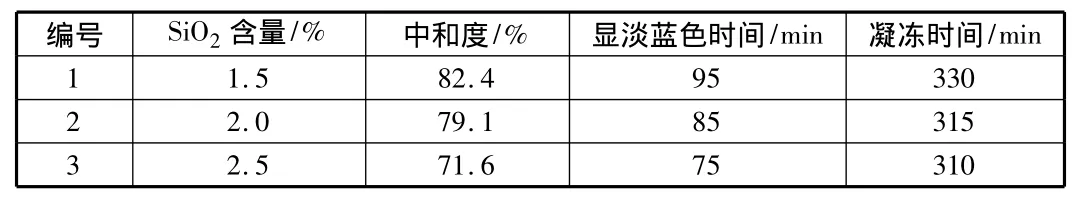
表1 不同SiO2含量的活化硅酸的中和度
对于表1中的3种活化硅酸,在活化过程中测定它们的剩余碱度,结果如图1所示。
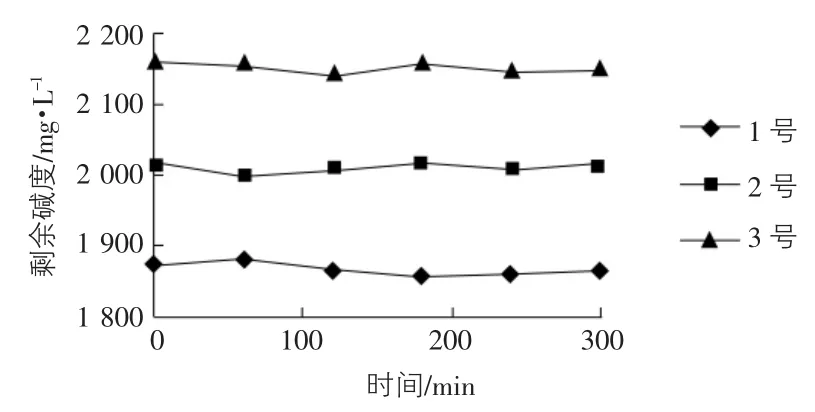
图1 活化过程中的碱度变化
由图1可以看出,在水玻璃活化过程中,剩余碱度基本恒定不变,但对于不同SiO2浓度的水玻璃溶液,在它们凝胶时间差不多的情况下,它们的剩余碱度有一定差别,对应的中和度也不同。SiO2浓度高的水玻璃溶液在活化时,若要取得与SiO2浓度低的水玻璃相同的凝胶时间,则它的剩余碱度应控制得相对高一些。
根据本试验的结果,用SiO2浓度为1.5%~2.0%的水玻璃溶液制取活化硅酸时,其中和度可控制在80%~85%,剩余碱度为1 500 mg/L~2 000 mg/L(CaCO3计)。
2.2 活化度的控制
水玻璃加酸活化至达到良好的聚合状态的时间称为活化时间,活化时间与凝胶时间的比值称为活化度。对于一定中和度的活化硅酸,选择合适的活化度能得到最优的助凝效果。
对于表1中的3种活化硅酸,其不同活化时间的助凝效果见图2。试验原水:34.6 NTU;水温:18℃;絮凝剂:聚合氯化铝铁(PAFC)投加15 mg/L;活化硅酸投加量:1.5 mg/L。
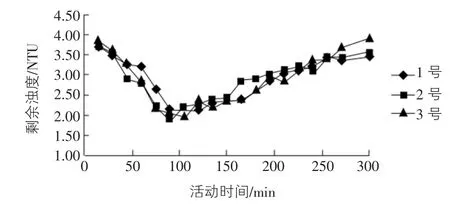
图2 活化时间对活化硅酸助凝效果的影响
由图2可以看出,活化初期的活化硅酸的助凝效果并不好,降低浊度的效果不明显,随着活化的进行,助凝效果慢慢体现出来,在活化时间为75 min~120 min(即活化度为0.25~0.35)时助凝效果较好,之后助凝效果开始衰减。
出现这种现象的原因是:水玻璃加酸活化后,活化初期溶液中硅酸的主要存在形态为单硅酸分子和负一价离子,分子尺寸小,此时吸附能力强,但架桥作用很小,助凝效果不好;活化后期直至成冻时,虽然聚硅酸分子聚合成长,尺寸变大,有利于架桥,但吸附能力较小,助凝效果也较差;而活化中期,活化硅酸聚合已有适当的尺寸,而吸附能力却没有过多减少,此时活化硅酸的性状正好具备助凝所要求的强吸附能力和架桥能力,故其助凝效果较好。
对于活化硅酸活化度的控制,本试验的结果为活化度在0.25~0.40之间较为合适,其具体数值需要在实际的运用中经过试验来确定。
水玻璃在活化的过程中,溶液在一定时间后会呈现淡蓝色,并且随着反应的进行,颜色会逐渐加深。由表1中可以看出,溶液开始显淡蓝色的时间约为凝胶时间的1/4,即活化度为0.25左右。有资料显示,当溶液开始显淡蓝色时助凝效果较好。因此,可通过观察溶液颜色的变化来确定活化时间。但这个方法存在的问题在于:溶液的变色行为是一个缓慢持续的过程,不易判断溶液显蓝色的初始点,而根据活化过程中溶液颜色渐变的特点,可以通过测定溶液透光率的方法来确定合适的活化度。本实验研究了活化硅酸活化过程中在波长为420 nm的可见光下的透光率的变化。结果表明,烧杯实验剩余浊度最低的活化时间(75 min~120 min)所对应的活化硅酸溶液透光度为33.7~38.5,表1中三种不同的活化硅酸之间基本一致,说明活化硅酸的最佳活化状态与活化硅酸的透光率具有一定的相关性,如果给定水玻璃溶液的二氧化硅含量和中和度,可通过事先绘制透光率—沉后余浊曲线,快速简便地控制活化硅酸溶液的活化度。
需要注意的是,由于工业生产的水玻璃本身差别较大,有的水玻璃溶液较清澈,有的很浑浊,因此相应的水玻璃溶液的透光性能差别也很大,不同水玻璃的透光率—沉后余浊曲线肯定会有所不同,需根据现场测得,而不能沿用经验数据。
3 活化硅酸的保存
活化硅酸经过一定时间会形成凝胶而失去助凝效果,因此,如何延长活化硅酸的正常使用时间是活化硅酸应用的一个重要课题。
3.1 调节pH值的保存方法
根据活化硅酸聚合的理论,硅酸的聚合反应在低pH值时聚合反应速度较慢,凝胶时间大大延长。
对于表1中的3种活化硅酸,在活化90 min的时候,加酸快速调节溶液 pH 值到 1.0,1.5,2.0,2.5,3.0,观察它们的凝胶时间。结果如表2所示。
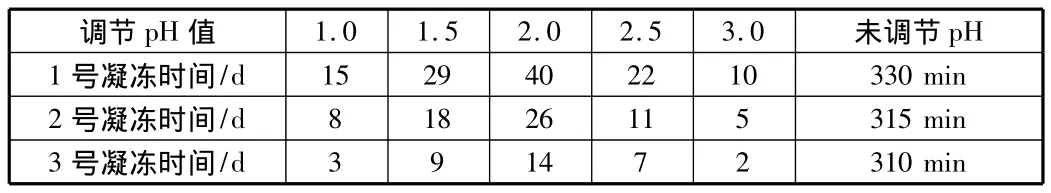
表2 加酸稳定后活化硅酸的保存时间
由表2可以看出,调节pH值后大大延长了活化硅酸的凝胶时间。其中pH=2时,活化硅酸的保存时间最长,二氧化硅浓度为1.5%的活化硅酸的保存时间达到了40 d,二氧化硅浓度为2.0%的活化硅酸的保存时间也将近有一个月。保存温度为15℃左右。
对于活化硅酸,在活化90 min时,加酸调节pH值到2.0,研究保存过程中活化硅酸的助凝效果的变化,三组样品每3 d采样一次做烧杯试验,得到结果如表3所示。
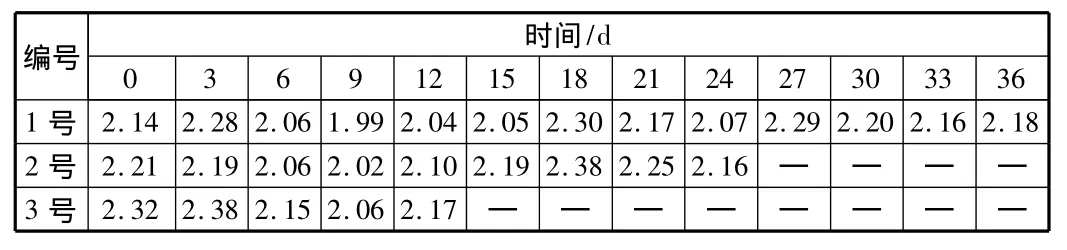
表3 活化硅酸保存过程中助凝效果的变化
由表3可以看出,对于在保存过程中的活化硅酸,在相同条件下做烧杯试验测得的剩余浊度变化最多只有0.5 NTU,鉴于烧杯试验本身可能引起的误差,可以认为活化硅酸的助凝效果基本稳定,与不调节pH值的活化硅酸的效果相当。
综上,在水玻璃加酸达到合适的活化度后,迅速调节其pH值至2.0左右,可延长活化硅酸的保存时间,而助凝效果基本不变。需要注意的是,活化硅酸在pH=6~8时容易凝胶,加酸时要一次性过量而越过这个范围快速达到pH=2左右。
3.2 稀释溶液的保存方法
二氧化硅浓度对凝胶时间有重要影响,降低二氧化硅浓度将大大延长活化硅酸的保存时间。本研究表明,用水将二氧化硅原液稀释一倍,保存时间可延长到3 d;稀释3倍,保存时间达到近20 d;稀释4倍时,保存时间可达一个月以上。考虑采用稀释溶液降低二氧化硅浓度的办法来延长活化硅酸的保存时间,同时考察其助凝效果的变化。
对稀释后的各组溶液,每2天取样进行烧杯试验,原水浊度在25.3 NTU~28.1 NTU之间。其结果见表4。
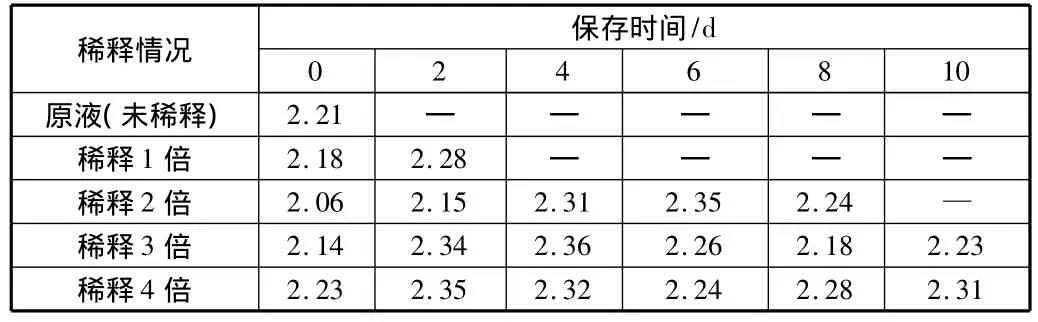
表4 稀释后活化硅酸在保存过程中助凝效果的变化
由表4可以看出,当原液稀释3倍以上时,稀释液的存放时间对助凝效果几乎没有影响。采用稀释溶液的方法延长活化硅酸的保存时间,其操作简单方便,效果也可以保证,其缺点是稀释后体积成倍增加,需要考虑存放的空间问题。
3.3 其他保存方法
引入金属阳离子或引入特殊阻聚剂也可延长活化硅酸的保存时间,但金属阳离子对活化硅酸具体影响的反应机理尚有争论[4],阻聚剂则在安全性和经济性上有疑问。
4 结语
1)由水玻璃制取活化硅酸,活化初期与活化末期得到的活化硅酸的助凝效果均不是很理想,而在活化中间的某个时间,得到的活化硅酸具有适当的聚合度,助凝效果较好。
2)水玻璃活化过程中溶液pH值会随着反应的进行而变化,而溶液的碱度则在活化过程中基本不变,可通过控制合适的碱度来得到需要的中和度。对于SiO2浓度为1.5%~2.0%的水玻璃活化,中和度可控制在80%左右,此时碱度约为1 800 mg/L(以CaCO3计),活化时间为75 min~120 min较为适宜。
3)水玻璃活化一段时间后,溶液会显淡蓝色,开始显淡蓝色的时间约为凝胶时间的1/4,即活化度约为0.25。溶液显蓝色后的一段时间内活化硅酸的助凝效果较好。另外,还可先绘制溶液透光率和沉后浊度的曲线,再通过测定溶液透光率来确定合适的活化度。
4)对于SiO2浓度为1.5%~2.0%的水玻璃活化到合适程度后,立即加酸调节pH值至2左右,可使活化硅酸保存20 d以上(15℃),在此期间活化硅酸的助凝效果稳定。
[1] 戴安邦,陈荣三.硅酸及其盐的研究(Ⅵ)——硅酸的聚合和溶液酸度的变化[J].南京大学学报(化学版),1963,2(1):9-19.
[2] 于水利,刘 立,刘馨远.活化硅酸聚合机理探讨[J].哈尔滨建筑大学学报,1996,29(5):111-114.
[3] 上海市政工程设计院.给水排水设计手册(第3册)[M].第2版.北京:中国建筑工业出版社,2004:441-450.
[4] 邵 俊.聚硅酸金属盐的絮凝性、稳定性和絮凝机理的研究[D].武汉:武汉科技大学资源与环境工程学院硕士学位论文,2006:24-25.



