卢林娜 高政南 朱珠 罗兰 刘羽晗 王冰 李欣宇 牛敏侯桂梅
艾塞那肽对2型糖尿病患者疗效、体重及体质成分的影响
卢林娜①高政南①朱珠①罗兰①刘羽晗①王冰①李欣宇①牛敏①侯桂梅①
目的:应用艾塞那肽治疗口服药物血糖控制不佳的2型糖尿病患者,评价其降糖疗效、对体重及全身各部位体质成分的影响。方法:选取2011年2月-2012年6月本收治的15例口服药物血糖控制不佳的2型糖尿病患者,在原有口服降糖药基础上,联用艾塞那肽皮下注射3个月,用药前后分别通过人体成分分析仪测定体重、体重指数、体脂百分数、腰臀脂肪比率及内脏脂肪区域,通过双能X线骨密度仪测定上肢、下肢、躯干及全身脂肪量及脂肪百分比、肌肉及骨矿物盐含量,并进行统计。结果:经过3个月的治疗,患者HbA1c有所下降,与治疗前比较差异有统计学意义(t=3.472,P<0.01);腰围、臀围及腰臀比有所下降,但差异无统计学意义(P>0.05);治疗后体重、体重指数、体脂百分比及内脏脂肪区域均明显下降,与治疗前比较差异均有统计学意义(t体重=4.424,P<0.01;t体重指数=4.337,P<0.01;t体脂百分比=4.426,P<0.01;t内脏脂肪区域=4.025,P<0.01);腰臀脂肪比率有所下降,但差异无统计学意义(P>0.05);治疗后下肢、躯干、全身脂肪量较治疗前均明显下降,差异有统计学意义(t下肢脂肪量=4.008,P<0.01;t躯干脂肪量=2.914,P<0.05;t全身脂肪量=3.474,P<0.01);下肢、躯干、全身脂肪百分比较治疗前明显下降,差异有统计学意义(t下肢脂肪百分比=2.405,P<0.05;t躯干脂肪百分比=2.756,P<0.05;t全身脂肪百分比=2.281,P<0.05);上肢脂肪量及脂肪百分比有所下降,但差异无统计学意义(P>0.05);治疗前后上肢、下肢、躯干、全身肌肉及骨矿物盐含量无明显改变;治疗后体重下降幅度与躯干和全身脂肪量下降幅度高度相关(r=0.860、0.819,P<0.01);治疗后全身脂肪量下降幅度与下肢和躯干脂肪量下降幅度高度相关(r=0.834、0.955,P<0.01)。结论:口服药控制不佳的2型糖尿病加用艾塞那肽治疗,在有效地控制血糖的同时,可减轻体重,减重以脂肪量减少为主,主要减少下肢、躯干脂肪,对肌肉和骨矿物盐含量无影响。
艾塞那肽; 2型糖尿病; 双能X线; 电阻抗; 体质成分

近年来有关胰高糖素样肽-1(GLP-1)及相关药物受到众多研究者的关注,其独特的药代学、药效学及血糖调节机理,为2型糖尿病(T2DM)的治疗开辟新的图径。其中艾塞那肽降糖同时减轻体重的作用使其成为治疗糖尿病最有前途的药物之一,但其针对全身各部位体质成分,特别是脂肪的含量和分布有何影响,体重减轻为人体何种成分及哪个部位所致的研究报道较少见,本研究选择二甲双胍及磺脲类药物血糖控制不佳的T2DM患者加用艾塞那肽治疗,评价其对2型糖尿病患者疗效、体重及全身各部位体质成分的影响。
1 资料与方法
1.1 一般资料 选取2011年2月-2012年6月本院收治的使用二甲双胍及磺脲类药物仍血糖控制不佳的T2DM患者15例,均符合WHO1999年糖尿病诊断标准,年龄≥18岁;经严格饮食、运动控制及联合使用二甲双胍、磺脲类药物至少3个月,当每种口服药物的剂量达最大剂量的一半,而HbA1c仍>7.0%;其中男8例,女7例,平均年龄(51.10±10.87)岁,平均病程(6.00±5.58)年;所有患者均无严重心、肝、肺、肾及胃肠道疾患;既往无急慢性胰腺炎病史;无感染、酮症、酸碱失衡及水电解质紊乱等急性并发症;患者了解试验全过程,自愿参加并签署知情同意书。
1.2 研究方法
1.2.1 临床资料的收集 测定患者基线的身高、腰围、臀围,应用高效液相色谱仪(美国,BIO-RAD公司)测定HbA1c。
1.2.2 治疗方法 在原有口服降糖药基础上,联用艾塞那肽(美国,礼来公司)5 μg,2次/d,餐前1 h内皮下注射1个月,之后改10 μg,2次/d,皮下注射,治疗周期为3个月。
1.2.3 测量方法 (1)治疗前后分别应用韩国Biospace公司生产的Inbody 720人体成分分析仪进行人体成分的分析。Inbody 720人体成分分析仪,为一种生物电阻抗分析仪,8点可触式电机。按仪器测试要求进行测试:测前2 h禁食、停止剧烈活动,脱去衣帽外衣。测试结果可直接得到人体基本成分:体重、体重指数(BMI)、体脂百分比、腰臀脂肪比率、内脏脂肪区域,并对患者体脂情况进行总体评价。(2)治疗前后分别应用美国CG公司生产的Prodlgy型窄角扇形束扫描双能X线骨密度仪进行全身扫描,获得人体不同部位包括上肢、下肢、躯干、全身脂肪量及脂肪百分比,肌肉及骨矿物盐含量。扫描时要求被检者除去金属物品或其他高密度饰物及厚重衣物,平卧于检查扫描床中央,用DEXA标准模式,扫描机架从头侧向足侧方向移动扫描,扫描时间大约6 min。
1.3 观察指标 比较治疗前后患者HbA1c(糖化血红蛋白)、体重、BMI(体重指数)、腰围、臀围、腰臀比(WHR)、体脂百分数、腰臀脂肪比率、内脏脂肪区域、上肢、下肢、躯干和全身脂肪量(FAT)及脂肪百分比(FAT%)、肌肉及骨矿物盐含量。
1.4 统计学处理 采用SPSS 17.0统计学软件对数据进行处理。计量资料以(±s)表示,比较采用t检验,变量间相关性采用Pearson直线相关分析,r≥0.5为高度相关,以P<0.05为差异有统计学意义。
2 结果
2.1 血糖控制及腰臀围的比较 治疗后患者HbA1c较治疗前明显下降,差异有统计学意义(P<0.05);治疗后HbA1c≤7%和HbA1c≤6.5%的达标率分别为55.6%和44.4%;治疗前后腰围、臀围、WHR有所下降,但差异无统计学意义(P>0.05),见表1。
表1 治疗前后HbA1c、腰围、臀围及腰臀比的比较()
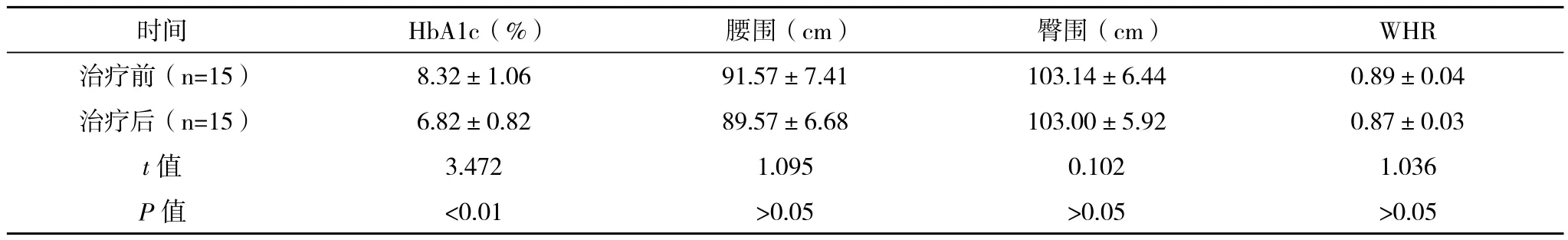
表1 治疗前后HbA1c、腰围、臀围及腰臀比的比较()
时间 HbA1c(%) 腰围(cm) 臀围(cm) WHR治疗前(n=15) 8.32±1.06 91.57±7.41 103.14±6.44 0.89±0.04治疗后(n=15) 6.82±0.82 89.57±6.68 103.00±5.92 0.87±0.03 t值 3.472 1.095 0.102 1.036 P值 <0.01 >0.05 >0.05 >0.05
2.2 体脂的生物电阻抗测定结果比较 治疗前后通过人体成分分析仪(生物电阻抗分析法)比较患者体重、BMI、体脂百分数、内脏脂肪区域,结果较治疗前均明显下降,差异有统计学意义(P<0.05);腰臀脂肪比有所下降,但差异无统计学意义(P>0.05),见表2。
2.3 不同部位体质成分的双能X线测定结果比较 治疗前后通过双能X线骨密度仪比较患者下肢、躯干、全身FAT及FAT%,结果较治疗前明显下降,差异有统计学意义(P<0.05);上肢FAT及FAT%有所下降,但差异无统计学意义(P>0.05);治疗前后比较患者上肢、下肢、躯干及全身肌肉和骨矿物盐含量无明显改变,差异无统计学意义(P>0.05),见表3。
2.4 相关性分析 治疗后体重下降幅度与躯干、全身FAT下降幅度高度相关(r=0.860、0.819,P<0.01);治疗后全身FAT下降幅度与下肢、躯干FAT下降幅度高度相关(r=0.834、0.955,P<0.01)。
表2 治疗前后体脂的生物电阻抗测定结果的比较()
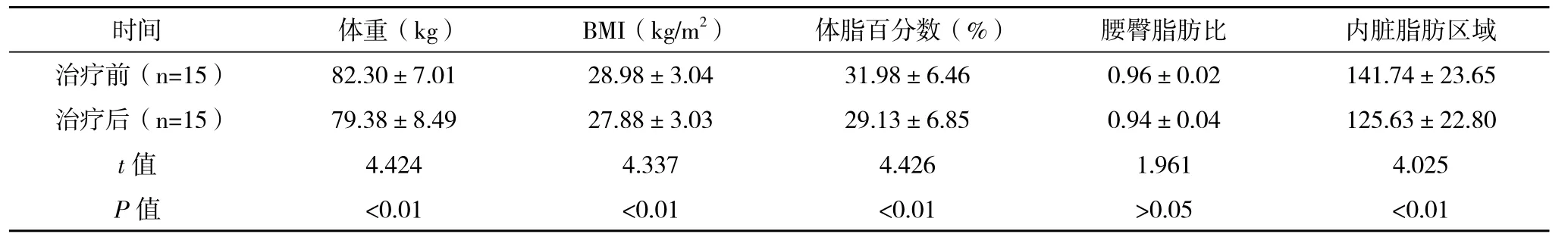
表2 治疗前后体脂的生物电阻抗测定结果的比较()
时间 体重(kg) BMI(kg/m2) 体脂百分数(%) 腰臀脂肪比 内脏脂肪区域治疗前(n=15) 82.30±7.01 28.98±3.04 31.98±6.46 0.96±0.02 141.74±23.65治疗后(n=15) 79.38±8.49 27.88±3.03 29.13±6.85 0.94±0.04 125.63±22.80 t值 4.424 4.337 4.426 1.961 4.025 P值 <0.01 <0.01 <0.01 >0.05 <0.01
表3 治疗前后体质成分的双能X线测定结果的比较()
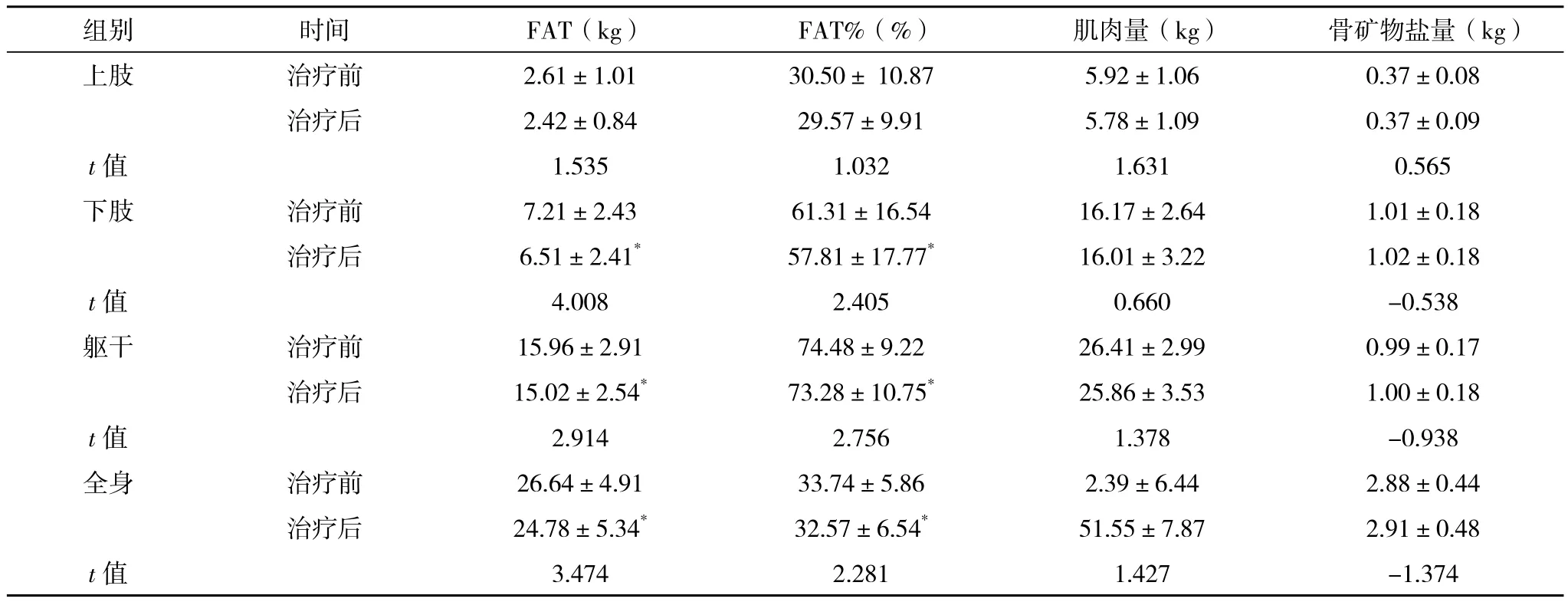
表3 治疗前后体质成分的双能X线测定结果的比较()
*与治疗前比较,P<0.05
组别 时间 FAT(kg) FAT%(%) 肌肉量(kg) 骨矿物盐量(kg)上肢 治疗前 2.61±1.01 30.50± 10.87 5.92±1.06 0.37±0.08治疗后 2.42±0.84 29.57±9.91 5.78±1.09 0.37±0.09 t值 1.535 1.032 1.631 0.565下肢 治疗前 7.21±2.43 61.31±16.54 16.17±2.64 1.01±0.18治疗后 6.51±2.41* 57.81±17.77* 16.01±3.22 1.02±0.18 t值 4.008 2.405 0.660 -0.538躯干 治疗前 15.96±2.91 74.48±9.22 26.41±2.99 0.99±0.17治疗后 15.02±2.54* 73.28±10.75* 25.86±3.53 1.00±0.18 t值 2.914 2.756 1.378 -0.938全身 治疗前 26.64±4.91 33.74±5.86 2.39±6.44 2.88±0.44治疗后 24.78±5.34* 32.57±6.54* 51.55±7.87 2.91±0.48 t值 3.474 2.281 1.427 -1.374
3 讨论
艾塞那肽由Amylin公司和Elililly公司联合开发,是首个上市的GLP-l受体激动剂[1]。其主要的生理功能为促进葡萄糖依赖的胰岛素的分泌和释放,抑制餐后胰高糖素的分泌,增强胰岛素的敏感性,抑制胰岛B细胞凋亡、促进增殖和再生,抑制食欲,减缓胃的排空,亦可减少脂肪生成和促进脂肪分解。另外GLP-1具有舒张血管、降压及内皮保护功能等。艾塞那肽主要适用于单用或合用二甲双胍和/或磺脲类药物时病情仍不能得到控制的2型糖尿病患者的辅助治疗。
本研究的数据证明,二甲双胍及磺脲类药物治疗失败的2型糖尿病患者,加用艾塞纳肽固定剂量5 μg或10 μg,2次/d皮下注射,HbA1c下降(1.5±1.3)%,降幅明显。评价某种治疗的降糖作用时,确定HbA1c的达标率可能更为重要,艾塞纳肽治疗3个月,HbA1c≤7%和HbA1c≤6.5%的达标率分别为55.6%和44.4%,提示艾塞那肽良好的降糖疗效。Kendall等[2]的研究显示HbA1c的降幅为0.8%,达标率30%,另一项由Gao等[3]针对亚洲后裔2型糖尿病患者相似研究中HbA1c的降幅为1.2%,达标率48%,较非亚洲后裔更明显,与本研究相似,是否存在不同人种差异需要进一步研究观察。
无论是1型糖尿病,还是2型糖尿病,传统各种治疗大多随着患者血糖控制的改善,伴有体重增加的问题。本研究应用生物电阻抗法检查结果提示应用艾塞纳肽治疗3个月后,患者体重、BMI,体脂百分比、内脏脂肪区域均明显下降,差异具有统计学意义(P<0.05),无恶心的受试者体重也有减轻。其中体重平均减少2.72 kg,提示艾塞那肽不仅可以降低HbA1c,亦可减轻体重,国外多项研究显示体重有明显减轻1.2~3.1 kg(16~30周),本研究结果与其相符[4-7]。
双能X线吸收法起初是检测骨质疏松的诊断金标准,近年来扩展和延伸为测定身体脂肪组织及进行全身成分分析。应用DEXA技术得到的脂肪含量做定量分析,在临床诊断和研究领域逐渐被认为是测量体脂含量的“金标准”。本研究应用双能X线骨密度仪比较患者下肢、躯干、全身脂肪量及脂肪百分比明显下降,肌肉和骨矿物盐含量无明显改变,提示患者体重减轻为脂肪减少,而且脂肪量的减少主要来自下肢及躯干,无肌肉和骨矿物盐参与影响。基础研究提示其机制可能为GLP-1可减少脂肪生成和促进脂肪分解[8];研究者比较了GLP-1、Exendin 4、胰岛素、胰高血糖素等对正常和肥胖人群脂肪细胞脂代谢影响,发现GLP-1可促进肥胖人群脂肪细胞的脂肪分解,当其作用削弱时脂肪合成则增加;因此可应用于肥胖的治疗,这种在促进葡萄糖摄取的同时又促进脂肪分解的作用,可能正是GLP-1在控制血糖的同时又能降低体重的原因。
总之,本研究应用生物电阻抗法及双能X线吸收法在小样本的研究中,初步提示口服药控制不佳的2型糖尿病患者加用艾塞那肽治疗,在有效地控制血糖的同时,尚能减轻体重,减重以脂肪量减少为主,特别可减少下肢及躯干脂肪,对肌肉和骨矿物盐含量无影响。因有关此方面的临床研究较少,本研究亦未设立治疗对照组及病例数较少,所以有待于扩大样本例数及延长治疗及随访时间进一步证实。
[1] Nielsen L L,Young A A,Parkes D G.Pharmacology of exenatide(synthetic exendin-4): a potential therapeutic for improved glycemic control of type 2 diabetes[J].Regulatory Peptides,2004,15,117(2):77-88.
[2] Kendall D M,Riddle M C,Rosenstock J, et al.Effects of exenatide(exendin - 4) on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea[J].Diabetes Care,2005,28(5):1083-1091.
[3] Gao Y,Yoon K H,Chuang L M,et al.Efficacy and safety of exenatide in patients of Asian descent with type 2 diabetes inadequately controlled with metformin or metformin and a sulphonylurea[J].Diabetes Research and Clinical Practice,2009,83(1):69-76.
[4] Buse J B,Henry R R,Han J,et al.Effects of exenatide (exendin - 4)on glycemic control over 30 weeks in sulfonylurea-treated patients with type 2 diabetes[J].Diabetes Care,2004,27(11):2628-2635.
[5] De Fronzo R A,Ratner R E,Han J,et al.Effects of exenatide (exendin- 4) on glycemic control and weight over 30 weeks in metformin -treated patients with type 2 diabetes[J].Diabetes Care,2005,28(5):1092-1100.
[6] Klonoff D C,Buse J B,Nielsen L L,et al.Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years[J].Current Medical Research and Opinion,2008,24(1):275-286.
[7] Sancho V,Trigo M V,Martin-Duce A,et al.Effect of GLP-1 on D-glucose transport, lipolysis and lipogenesis in adipocytes of obese subjects[J].International Journal of Molecular Medicine,2006,17(6):1133-1137.
[8] Gromada J,Bokvist K,Ding W G,et al.Glucagon-like peptide 1(7 - 36) amide stimulates exocytosis in human pancreatic beta - cells by both proximal and distal regulatory steps in stimulus-secretion coupling[J].Diabetes,1998,47(1):57-65.
Objective:To evaluate the effect of exenatide on plasma glucose, weight and body fat in poorly controlled type 2 diabetes patients using oral antidiabetic drug.Method:15 cases of poorly controlled type 2 diabetes who used oral antidiabetic drug in our hospital were selected. Exenatide was injected subcutaneously together with the original basis of oral hypoglycemic agents for three months, and the body weight, body mass index (BMI), the percentage of body fat tissue,the percentage of fat tissue of waist to hip and visceral fat range were analyzed by body composition analyzer before and after treatment. In the mean time, Dual-energy X-ray absorptiometry was used to determine the fat mass and percentage, muscle and bone mineral salts mass of upper limb, Lower limb, trunk, and whole body. Result: After 3 months’ treatment, HbA1c were significantly decreased than before, had statistical differences (t=3.472, P<0.01). The waistline, the hip circumference and the waist-hip ratio (WHR) were decreased than before, but no statistical difference (P>0.05). The body weight, BMI,the percentage of body fat and visceral fat range were significantly decreased before and after treatment(t=4.424, P<0.01;t=4.337, P<0.01; t=4.426, P<0.01; t=4.025, P<0.01). The fat tissue of waist-hip ratio was decreased than before, but no statistical difference (P>0.05). After 3 months’ treatment, the fat tissue mass of lower limb, trunk, and whole body were significantly decreased than before, had statistical differences (t=4.008, P<0.01; t= 2.914,P<0.05; t= 3.474, P<0.01).After 3 months’ treatment, the fat tissue mass percentage of lower limb, trunk, and whole body were significantly decreased,had statistical differences (t=2.405, P<0.05; t=2.756, P<0.05; t=2.281, P<0.05). The fat tissue mass and percentage of upper limb was decreased than before, but no statistical difference (P>0.05). The muscle and bone mineral salts mass were not altered (P>0.05). After 3 months’ treatment, the decrease of body weight was highly correlated with the decrease oftrunk fat and whole body fat(r= 0.860, 0.819, P<0.01). The decrease of whole body fat was highly correlated with lower limb fat and trunk fat(r=0.834, 0.955, P<0.01).Conclusion:Exenatide can effectively control the level of plasma glucose of patients which being poorly controlled by oral antidiabetic drug, decrease the body weight which depends on fat mass decrease, especially lower limb, trunk fat. Exenatide don’t affected on muscle and bone mineral salts mass.
Exenatide; Type 2 diabetes; Dual-energy X-ray; Electronic resistance; Body element
10.3969/j.issn.1674-4985.2014.10.033
①辽宁省大连市中心医院 辽宁 大连 116033
高政南First-author’s address:Dalian Municipal Central Hospital,Dalian 116033,China
2013-12-27) (本文编辑:蔡元元)



