王建红李红赵龙凤
慢性乙型肝炎患者肠源性内毒素血症中免疫调节细胞因子表达变化的研究*
王建红①李红②赵龙凤②
目的:研究慢性乙型肝炎(chronic hepatitis B,CHB)患者肠源性内毒素血症(intestinal endotoxemia,IETM)中与调节性T细胞(regulatory T cells,Treg)、Th17细胞相关免疫调节细胞因子的表达变化。方法:应用ELISA法分别对80例CHB患者和20例健康对照者的血浆IL-10、TGF-β、IL-6、IL-17、IL-23及内毒素水平进行检测。根据测定的内毒素水平,将CHB患者分为内毒素阳性组和内毒素阴性组。结果:CHB患者血浆IL-10、TGF-β、IL-6、IL-17、IL-23水平均明显高于健康对照组(Z值分别为5.265、6.859、6.894、5.028、6.877,均P<0.01)。内毒素阳性组患者明显高于内毒素阴性组和健康对照组(H值分别为45.833、48.423、48.984、75.184、75.814,均P<0.01)。结论:CHB患者IETM时血浆中与Treg、Th17细胞相关细胞因子水平进一步增高。
乙型肝炎; 慢性; 肠源性内毒素血症; 细胞因子
乙型肝炎病毒(HBV)是一种在世界范围广泛流行、严重危害人类健康的传染病[1]。HBV感染后致肝脏损害主要由机体对HBV免疫应答介导[2]。目前,HBV感染后慢性化进程中免疫应答的确切机制还不清楚,但可以肯定的是细胞免疫在其中起重要作用。调节性T细胞(regulatory T cells,Treg)、Th17细胞是近年来新发现的两类免疫调节细胞,两者密切相关,来源与同一初始CD4+T淋巴细胞群,在分化和功能上既相互联系,又相互制约[3]。Treg/Th17细胞失衡可导致多种慢性感染性疾病、自身免疫疾病及肿瘤等的发生、发展。已有研究报道,慢性乙型肝炎(CHB)患者体内亦存在Treg/Th17失衡,参与HBV感染慢性化的进程[4-5]。笔者前期研究发现,CHB患者体内长期持续患有肠源性内毒素血症(intestinal endotoxemia,IETM)时可以导致机体的免疫功能低下,造成HBV难以清除[6]。那IETM与Treg/Th17平衡关系如何呢?本研究通过检测内毒素水平,将CHB患者分为内毒素阳性组和内毒素阴性组,通过比较两组患者外周血Treg、Th17细胞相关细胞因子的的水平,间接探讨IETM中CHB患者外周血Treg/Th17平衡的改变。
1 资料与方法
1.1 一般资料 选取2013年2月-2013年11月在本院住院的80例CHB患者,其中男58例,女22例,年龄18~69岁,平均(30±6)岁。CHB患者诊断均符合《慢性乙型肝炎防治指南》(2010年版)[7],近半年均未服用过抗病毒及免疫调节剂药物,排除其他肝炎病毒感染及其他原因引起的肝损害。同时选取20例健康对照者,男14例,女6例,年龄20~55岁,平均(25±9)岁,肝功能正常,HBV血清学标志物阴性。本研究经本院医学伦理委员会同意,所有患者均签署知情同意书。两组研究对象一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法 抽取受试对象晨间空腹静脉血1 mL,离心分离血清,-20 ℃保存。待所有样本收集完全后,取冻存血清,ELISA双抗体夹心法检测血浆IL-10、TGF-β、IL-6、IL-17、IL-23及内毒素水平。根据检测的内毒素水平,将CHB患者分为内毒素阳性组和阴性组,内毒素阳性的标准为健康者内毒素水平95%可信区间的上限值36.68 pg/mL,>36.68 pg/mL为内毒素阳性组,≤36.68 pg/mL为内毒素阴性组。
1.3 统计学处理 采用SPSS 13.0软件对所得数据进行统计分析,计量资料用(±s)表示;采用两个样本比较的Mann-Whitney U检验或多个独立样本比较的Kruskal-Wallis H检验;以P<0.05为差异有统计学意义。
2 结果
2.1 健康者与CHB患者内毒素、IL-10、TGF-β水平的比较 80例CHB患者中,45例发生IETM,占56.25%。内毒素阳性组与阴性组的年龄、性别比较差异均无统计学意义(P>0.05)。与健康者比较,CHB患者内毒素水平明显升高(P<0.01),且IL-10、TGF-β水平均明显升高(Z值分别为5.265、6.859)。内毒素阳性组IL-10、TGF-β水平均较阴性组升高,差异均有统计学意义(P<0.01),见表1。
2.2 健康者与CHB患者IL-6、IL-17、IL-23水平的比较 与健康者比较,CHB患者IL-6、IL-17、IL-23水平均明显升高(Z值分别为6.894、5.028、6.877)。内毒素阳性组IL-6、IL-17、 IL-23水平均较阴性组升高,差异有统计学意义(P<0.01),见表2。
表1 健康者与CHB患者内毒素、IL-10、TGF-β水平的比较(±s)
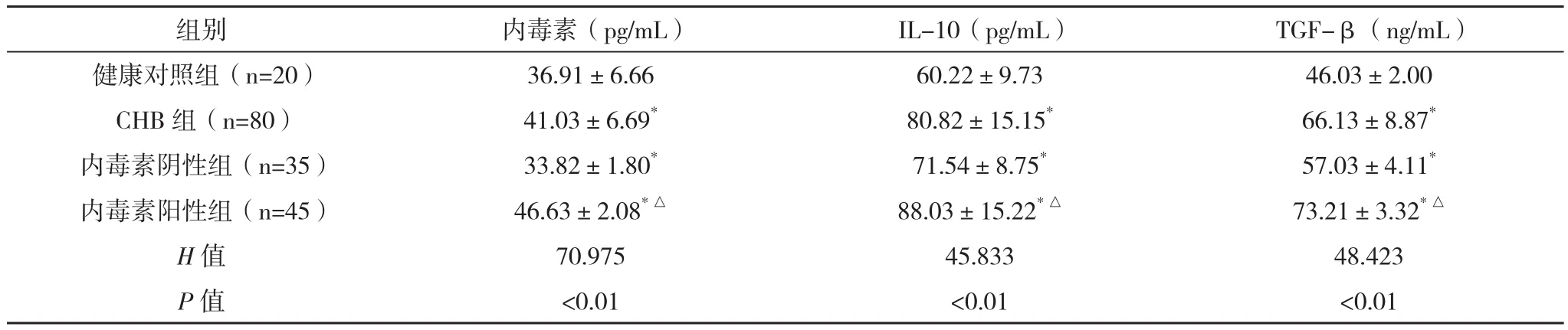
表1 健康者与CHB患者内毒素、IL-10、TGF-β水平的比较(±s)
*与健康对照组比较,P<0.01;△与内毒素阴性组比较,P<0.01
组别 内毒素(pg/mL) IL-10(pg/mL) TGF-β(ng/mL)健康对照组(n=20) 36.91±6.66 60.22±9.73 46.03±2.00 CHB组(n=80) 41.03±6.69* 80.82±15.15* 66.13±8.87*内毒素阴性组(n=35) 33.82±1.80* 71.54±8.75* 57.03±4.11*内毒素阳性组(n=45) 46.63±2.08*△ 88.03±15.22*△ 73.21±3.32*△H值 70.975 45.833 48.423 P值 <0.01 <0.01 <0.01
表2 健康者与CHB患者IL-6、IL-17、IL-23水平的比较(±s) g/mL
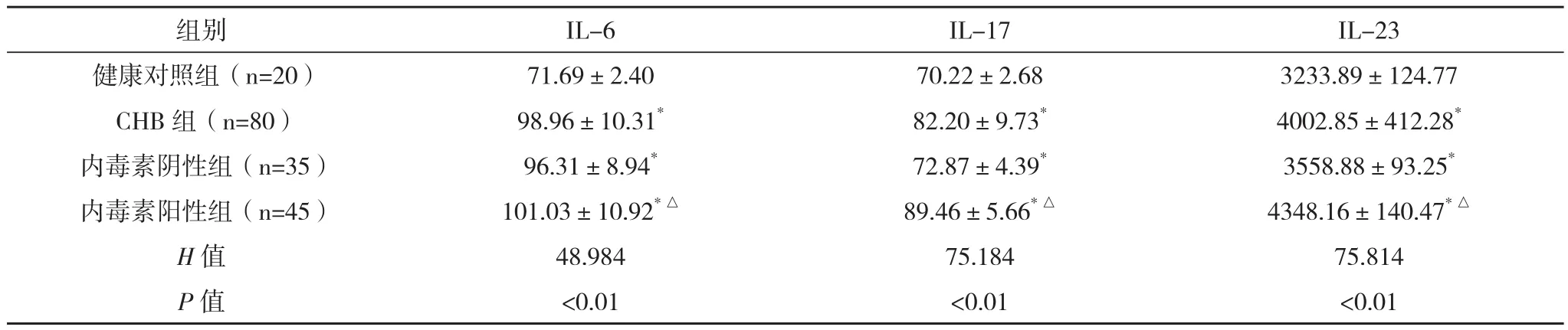
表2 健康者与CHB患者IL-6、IL-17、IL-23水平的比较(±s) g/mL
*与健康对照组比较,P<0.01;△与内毒素阴性组比较,P<0.01
组别 IL-6 IL-17 IL-23健康对照组(n=20) 71.69±2.40 70.22±2.68 3233.89±124.77 CHB组(n=80) 98.96±10.31* 82.20±9.73* 4002.85±412.28*内毒素阴性组(n=35) 96.31±8.94* 72.87±4.39* 3558.88±93.25*内毒素阳性组(n=45) 101.03±10.92*△ 89.46±5.66*△ 4348.16±140.47*△H值 48.984 75.184 75.814 P值 <0.01 <0.01 <0.01
3 讨论
TGF-β不仅是Treg分泌的发挥抑制作用的主要细胞因子,体外研究还表明相对较低浓度的TGF-β主要促进Th17细胞的分化,而高浓度的TGF-β则主要促进Treg的分化而抑制Th17细胞的分化[8]。IL-10是Treg分泌的另一主要细胞因子,它可调控IL-12的产生,进而抑制Th1型细胞免疫反应[3]。有研究表明,CHB患者血浆TGF-β、IL-10水平明显升高,且与病情严重程度密切相关[3]。本研究发现与健康对照组比较,CHB患者TGF-β、IL-10水平亦均明显升高,按内毒素水平分组后,内毒素阳性组二者均明显高于内毒素阴性组,初步提示内毒素可影响CHB患者TGF-β、IL-10的表达水平,二者可能参与了IETM的病变过程。
IL-6联合TGF-β可促进转录因子RORɣt的表达和STA-T3通路的活化,从而可诱导Th17细胞的分化与增殖[9]。在关于糖尿病的研究中发现,IL-6不仅可诱导Th17细胞的分化与增值,且可以抑制Treg的分化,使Treg/Th17平衡向Th17方向偏移[10]。IL-23属于IL-12家族,主要由mDC细胞分泌,是维持Th17细胞分化及功能发挥的细胞因子,IL-23缺乏使其存活及增殖受限[11]。IL-17是Th7细胞分泌的主要致炎性细胞因子,可诱导内皮细胞、上皮细胞等分泌IL-6、IL-8、前列腺素E2,增强TNF-α的功能及细胞间黏附分子的表达,在炎症性疾病的发生发展中起重要作用[12]。IL-23/IL-17信号通路参与多种炎性疾病,有研究发现慢性乙型肝炎的病变中亦有IL-23/IL-17信号通路的参与[13]。本发现与健康对照组比较,CHB患者血浆IL-6、IL-23、IL-17水平均明显升高,按内毒素水平分组后,内毒素阳性组三者均明显高于内毒素阴性组,初步提示CHB患者IETM时IL-6、IL-23、IL-17的表达水平亦发生了变化,它们亦可能参与了IETM的病理生理过程。
综上所述,本研究发现,CHB患者IETM时与Treg、Th17细胞密切相关的细胞因子表达均升高,初步提示Treg、Th17细胞可能都参与了IETM的病变过程,下一步笔者将直接研究CHB患者IETM时外周血Treg、Th17细胞表达的变化,为通过降低内毒素水平来改善CHB患者病情提供免疫治疗方面的新视角。
[1]林格.核苷类抗乙肝病毒药物的研究进展[J].中国医学创新,2011,8(26):186-188.
[2]钟大妮,李国坚,吴继周,等.广西地区乙肝病毒基因分型与临床表现及机体免疫功能关系的研究[J].中国医学创新,2013,10 (2):1-3.
[3] Weaver C T,Hatton R D.Interplay between the Th17 and Treg cell lineages:a (co-) evolutionary perspective[J].Nat Rev Immunol,2009,9(12):883-889.
[4] Xue-Song L,Cheng-Zhong L,Ying Z,et al.Changes of Treg and Th17 cells balance in the development of acute and chronic hepatitis B virus infection[J].BMC Gastroenterol,2012,12(1):43.
[5] Su Z J,Yu X P,Guo R Y,et al.Changes in the balance between Treg and Th17 cells in patients with chronic hepatitis B[J].Diagn Microbiol Infect Dis,2013,76(4):437-444.
[6]赵龙凤,李红,王勤英,等.慢性肝炎患者内毒素血症与免疫功能的关系[J].中华传染病杂志,2004,22(1):45-47.
[7]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华临床感染病杂志,2011,4(1):1-13.
[8] Zhou L,Lopes J E,Chong M M,et al.TGF-β-induced Foxp3 inhibits Th17 cell differentiation by antagonizing RORγ function[J]. Nature,2008,453(7192):236-240.
[9] Mangan P R,Harrington L E,O’Quinn D B,et al.Transforming growth factor-β induces development of the TH17 lineage[J].Nature,2006,441(7090):231-234.
[10] Monika R S,Skrzypkowska M,Mymliwska J,et al.The serum IL-6 profile and Treg/Th17 peripheral cell populations in patients with type 1 diabetes[J].Mediators Inflamm,2013,20(13):20 524.
[11] Volpe E,Servant N,Zollinger R,et al.A critical function for transforming growth factor-β,interleukin 23 and proinflammatory cytokines in driving and modulating human TH-17 responses[J]. Nature Immunol,2008,9(6):650-657.
[12] Qu N,Xu M,Mizoguchi I,et al.Pivotal roles of T-Helper 17-Related cytokines,IL-17,IL-22,and IL-23,in inflammatory diseases[J].Clin Dev Immuno,2013,25(13):968 549.
[13] Wang Q,Zhou J,Zhang B,et al.Hepatitis B virus induces IL-23 production in antigen presenting cells and causes liver damage via the IL-23/IL-17 axis[J].Plos Pathog,2013,9(6):e1003410.
Change of Immunological Cytokines Expression in Chronic Hepatitis B Patients with Intestinal Endotoxemia/
WANG Jian-hong,LI Hong,ZHAO Long-feng.//Medical Innovation of China,2014,11(12):020-022
Objective:To investigate the change of the Treg/Th17-related cytokines in chronic hepatitis B patients with intestinal endotoxemia.Method:The serum levels of Treg/Th17-related cytokines and endotoxin(ET)in 80 patients with chronic hepatitis B(CHB) and 20 healthy controls(NC) were measured by enzyme-linked immunosorbent assay (ELISA). According to serum ET levels,all CHB patients were divided into two groups: ET positive and ET negative.Result:Compared to NC,the serum concentration of IL-10,TGF-β,IL-6,IL-17,IL-23 were all significantly increased in CHB patient groups(Z=5.265,6.859,6.894,5.028,6.877,all P<0.01).The levels of IL-10,TGF-β,IL-6,IL-17,IL-23 in ET positive group were significantly higher than ET negative group and NC(H=45.833,48.423,48.984,75.184,75.814,all P<0.01).Conclusion:The Treg/Th17-related cytokines were increased in CHB patients with intestinal endotoxemia.
Hepatitis B; Chronic; Intestinal endotoxemia; Cytokines
10.3969/j.issn.1674-4985.2014.12.007
2014-01-16) (本文编辑:欧丽)
山西省高等学校科技项目(20121123);省部共建教育部重点实验室主任基金项目(3);山西省基础研究计划(自然科学基金)项目(2013011054-3)
①山西医科大学 山西 太原 030001
②山西医科大学第一医院
李红
First-author’s address:Shanxi Medical University,Taiyuan 030001,China



