巫金娜黄莉文
姜黄素对HIV-1 gp120多肽诱导的大鼠神经元HSP70 mRNA表达的影响*
巫金娜①黄莉文①
【摘要】目的:初步阐明姜黄素对HIV-1 gp120多肽诱导的大鼠神经元HSP70 mRNA表达的影响。方法:采用流式细胞术检测HIV-1 gp120多肽诱导大鼠神经元凋亡情况;采用实时定量PCR(Realtime PCR)检测热休克蛋白70(HSP70)的表达情况,分析姜黄素对大鼠神经元HSP70 mRNA的影响。结果:HIV-1 gp120多肽可诱导大鼠神经元凋亡。姜黄素可缓解HIV-1 gp120 V3区多肽诱导神经元凋亡。HIV-1 gp120多肽可降低大鼠大脑皮质神经元HSP70 mRNA的表达。姜黄素能提高大鼠皮质神经元HSP70 mRNA表达,减轻HIV-1 gp120多肽诱导的神经元凋亡。结论:姜黄素可调节HSP70 mRNA表达,减轻HIV-1 gp120多肽诱导神经元凋亡。
【关键词】姜黄素; 人类免疫缺陷病毒1型; 糖蛋白120; 热休克蛋白70; 细胞凋亡
①广州医科大学附属口腔医院 广东 广州 510140
20世纪80年代,首例获得性免疫缺陷综合症(AIDS)病例被报道。AIDS由人类免疫缺陷病毒1型(HIV-1)所致,病毒可通过其包膜糖蛋白gp120,引发中枢神经系统细胞功能障碍[1-2],进而导致神经退行性病变或神经认知障碍。但HIV-1导致中枢神经系统损伤的具体机制仍不清楚。虽然高效抗逆转录病毒疗法(HAART)有效地降低了艾滋病患者的死亡率和全身性机会性感染的发生率,但由于血脑屏障的存在,抗病毒药物很难进入中枢神经系统。因此迫切需要开发新的抗HIV-1脑病的药物。热休克蛋白70(HSP70)是一个分子量为70kDa的热休克蛋白应激诱导分子,研究发现,HSP70对神经变性疾病具有神经保护功能[4]。姜黄素是从草本植物姜黄根茎中提取的疏水多酚,能改善HIV-1 gp120引起的记忆障碍[5]。在本研究中,我们旨在阐明姜黄素对HIV-1 gp120多肽诱导的大鼠神经元HSP70 mRNA表达的影响。
1 材料与方法
1.1实验动物 SD大鼠30只用于取大鼠大脑皮质神经元[License No.SCXK(yue)(2006-0015)]购自广东省医学实验动物中心。其中正常组5只、对照组5只、模型组5只、0.5 μg/mL多肽组5只、1 μg/mL多肽组5只、0.5 μg/mL姜黄素处理组5只、1 μg/mL姜黄素处理组5只,所有动物实验进行协议均通过本院伦理委员会批准。
1.2细胞培养方法 原代大鼠皮质神经元均参照早前的报道研究[6],并做了轻微的调整。具体为:处死大鼠,将新鲜皮质组织分为约1 mm的切片,放置在15 mL离心管(D-Hanks 溶液与0.25%胰蛋白酶体积比为2∶1)中,37 ℃消化10 min,离心5 min,悬浮沉淀,过筛,将神经元接种在6孔培养板(含聚-L-赖氨酸)上,37 ℃,5% CO2培养4 h,更换含2% B27的neurobasal培养基(Life Technologies-Gibco,Grand Island,NY,USA)培养,以确保神经元构成大于95%。
1.3多肽序列及合成 多肽序列:Asn-Asn-Thr-Arg-Lys-Ser-Ile-Arg-Ile-Gln-Arg-Gly-Pro-Gly-Arg-Ala-Phe-Val-Thr-Ile-Gly-Lys-Ile-Gly(分子式:C114H199N41O31;分子量:2,640.06),由上海生工合成。
1.4细胞凋亡分析 采用FITC标记的膜联蛋白V 和PI法分析细胞凋亡情况。HIV-1 gp120 V3区多肽成功诱导大鼠大脑皮质神经元凋亡后,将大鼠大脑皮质神经元与终浓度为0.5 μg/mL及1 μg/mL的姜黄素分别共同孵育。首先将大鼠皮质神经元接种在6孔板,5 d后加入HIV-1 gp120多肽(0.5μg/mL、1μg/mL)处理48 h,用预冷PBS洗涤细胞,用1X结合缓冲液悬浮细胞。将悬浮液转移到含有FITC膜联蛋白V和PI的培养管中,轻轻涡旋并孵育15 min;加入1X结合缓冲液。利用流式细胞仪分析细胞凋亡情况。随后,分别沉默及过表达大鼠大脑皮质神经元HSP70基因,观察姜黄素对HIV-1 gp120多肽所致大鼠大脑皮质神经元凋亡率的影响。
1.5构建腺病毒载体 按照以往方法进行[7]。利用Adeasy系统,将HSP70连接到pShuttle载体上,用T4连接酶连接;感受态细胞转化,涂平板(卡拉霉素),37 ℃过夜。挑取30个克隆,提取DNA并用PacI筛选,琼脂糖电泳(0.8%),并测序鉴定。
1.6实时定量PCR 提取细胞RNA,并逆转录至cDNA。所有试剂均自ABI(Applied Biosystems)。所得产物保存于4 ℃。利用使用说明书优化Realtime PCR反应条件。采用ABI 7500 Real-time PCR仪进行反应。数值由2Ct(calibrator)-Ct (test)计算得出。利用Real-time PCR检测gp120多肽处理的大鼠皮层神经元中HSP70 mRNA的表达情况,分析姜黄素对大鼠皮层神经元HSP70的影响。
1.7统计学处理 采用PEMS 3.1统计学软件进行数据分析,计量资料以(±s)表示,比较采用t检验或方差分析,计数资料以百分比表示,比较采用 X2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1HIV-1 gp120多肽对大鼠皮层神经元的作用 采用流式细胞术检测HIV-1 gp120多肽所致的神经元凋亡率可发现,经(0.5 μg/mL及1 μg/mL)多肽处理后,神经元凋亡比例为17.4%(图1),HIV-1 gp120多肽可诱导大鼠皮层神经元凋亡。
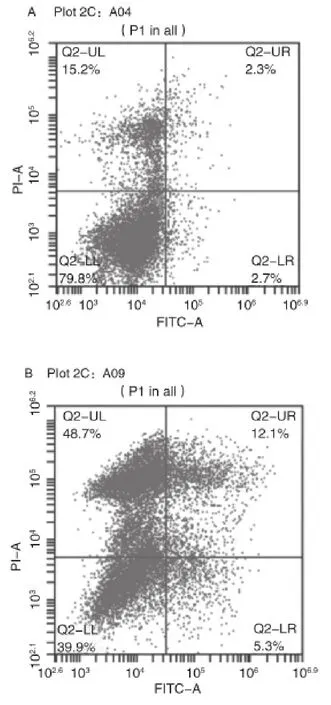
图1 HIV-1 gp120多肽诱导大鼠皮层神经元凋亡
2.2HIV-1 gp120多肽对大鼠大脑皮质神经元HSP70 mRNA表达的影响 采用Real-time PCR检测HIV-1 gp120多肽处理的大鼠皮层神经元中HSP70 mRNA的表达情况发现,与对照组相比,0.5 μg/mL多肽组的HSP70 mRNA表达水平为(0.56±0.06),而1 μg/mL多肽组HSP70 mRNA表达水平为(0.38±0.03),多肽处理可下调大鼠大脑皮质神经元HSP70 mRNA表达。
2.3姜黄素对大鼠皮质神经元HSP70 mRNA表达的影响 采用Real-time PCR分析姜黄素对大鼠皮层神经元HSP70 mRNA的影响发现,与对照组相比,大鼠皮质神经元经不同浓度的姜黄素(0.5 μg/mL及1 μg/mL)处理后,HSP70 mRNA表达显着提高,分别为(1.59±0.16)、(2.38±0.23),姜黄素可以增加HSP70 mRNA表达。
2.4姜黄素对HIV-1 gp120多肽诱导的大鼠皮层神经元的影响 与模型组相比,0.5 μg/mL姜黄素处理组HSP70 mRNA的表达为(1.18±0.13),1 μg/mL 姜黄素处理组HSP70 mRNA的表达为(1.22±0.15);姜黄素可以增加大鼠大脑皮质神经元中HSP70 mRNA的表达。与HIV-1 gp120多肽处理组对比,沉默HSP70基因后,0.5 μg/mL姜黄素处理组cleaved caspase-3 mRNA表达为(1.16±0.15),1 μg/mL姜黄素处理组表达为(1.23±0.13);姜黄素处理组中凋亡特异性蛋白cleaved caspase-3 mRNA表达更高。
3 讨论
研究表明,HIV-1可致神经系统功能障碍,其重要特征是神经元凋亡[8]。HIV-1包膜糖蛋白HIV-1 gp120能够在小鼠体内诱导出类似HIV-1相关性痴呆患者的神经病理变化[9]。此外,HIV-1 gp120可通过caspase-3途径,产生神经毒性[10]。HSP70是分子量为70kDa的具有较高的神经保护能力热休克蛋白[11]。研究结果表明,在神经退行性疾病帕金森综合症中,HSP70可作为分子伴侣产生神经保护作用[12]。并且,HSP70能调节Apaf-1和AIF信号通路,减轻并抑制原代皮质神经元和SH-SY5Y细胞凋亡[13]。姜黄素是从姜科、天南星科的植物根茎中提取的一种能够穿过血脑屏障化学物质[14]。以往的研究发现,姜黄素与HIV-1核苷酸序列的长末端重复序列(LTR)结合,抑制后者活性。姜黄素还可抑制HIV-1复制所需的蛋白酶、整合酶以及与HAD相关的一些细胞因子(TNF-α,IL-1β等)以及一氧化氮、自由基等[15]。
本研究表明,HIV-1 gp120多肽可降低HSP70 mRNA表达。姜黄素可调节HSP70 mRNA表达,降低HIV-1 gp120多肽所致的大鼠大脑皮质神经元凋亡。这些结果表明,姜黄素可通过调节HSP70 mRNA表达情况,降低大脑皮质神经元凋亡率。这使姜黄素有望开发成为新的治疗HIV相关性痴呆的药物。但由于HIV-1相关性脑病的复杂性,姜黄素对HIV-1相关性脑病的干预作用仍需进行大规模的实验来证实。
参考文献
[1]Chen L,Liu J,Xu C,et al.HIV-1gp120 induces neuronal apoptosis through enhancement of 4-aminopyridine-senstive outward K+currents[J].PLoS One,2011,6(10):e25 994.
[2]Louboutin J P,Agrawal L,Reyes B A,et al.HIV-1 gp120-induced injury to the blood-brain barrier:role of metalloproteinases 2 and 9 and relationship to oxidative stress[J].Neuropathol Exp Neurol,2010,69(8):801-816.
[3]Xia C,Luo D,Yu X,et al.HIV-associated dementia in the era of highly active antiretroviral therapy (HAART)[J].Microbes Infect,2011,13(3):419-425.
[4]Shukla A K,Pragya P,Chaouhan H S,et al.Heat shock protein-70 (Hsp-70) suppresses paraquat-induced neurodegeneration by inhibiting jnk and caspase-3 activation in drosophila model of Parkinson’s disease[J].PLoS One,2014,9(6):e98 886.
[5]Norris L,Karmokar A,Howells L,et al.The role of cancer stem cells in the anti-carcinogenicity of curcumin[J].Mol Nutr Food Res,2013,57(9):1630-1637.
[6]Shafer T J,Hughes M F.Accumulation of pyrethroid compounds in primary cultures from rat cortex[J].Toxicol In Vitro,2010,24 (7):2053-2057.
[7]Xia C L,Zhu P,Cai Y T,et al.HIV-infection resistance in PMBC-derived dendritic cells modified with recombinant virus[J].Arch Virol,2012,157(3):413-421.
[8]Alirezaei M,Kiosses W B,Fox H S.Decreased neuronal autophagy in HIV dementia: a mechanism of indirect neurotoxicity[J].Autophagy,2008,4(7):963-966.
[9]Silverstein P S,Shah A,Weemhoff J,et al.HIV-1 gp120 and drugs of abuse:interactions in the central nervous system[J].Curr HIV Res,2012,10(5):369-383.
[10]Bari M,Rapino C,Mozetic P,et al.The endocannabinoid system in gp120-mediated insults and HIV-associated dementia[J].Exp Neurol,2010,224(1):74-84.
[11]Aldebasi Y H,Aly S M,Rahmani A H.Therapeutic implications of curcumin in the prevention of diabetic retinopathy via modulation of anti-oxidant activity and genetic pathways[J].Int J Physiol Pathophysiol Pharmacol,2013,5(4):194-202.
[12]Thakur P,Nehru B.Long-term heat shock proteins (HSPs)induction by carbenoxolone improves hallmark features of Parkinson’s disease in a rotenone-based model[J].Neuropharmacology,2014,79(4):190-200.
[13]Sabirzhanov B,Bogdan A,Hanscom M,et al.Overexpression of HSP70 attenuates caspase-dependent and caspaseindependent pathways and inhibits neuronal apoptosis[J].J Neurochem,2012,123(4):542-554.
[14]Derochette S,Franck T,Mouithys-Mickalad A,et al.Curcumin and resveratrol act by different ways on NADPH oxidase activity and reactive oxygen species produced by equine neutrophils[J].Chem Biol Interact,2013,206(2):186-193.
[15]Guo L,Xing Y,Pan R.et al.Curcumin protects microglia and primary rat cortical neurons against HIV-1 gp120-mediated inflammation and apoptosis[J].PLoS One,2013,8(8):e70 565.
doi:10.3969/j.issn.1674-4985.2016.11.008
*基金项目:广东省医学科学技术研究基金项目(A2015335)
通信作者:巫金娜
收稿日期:(2015-12-08) (本文编辑:蔡元元)



