傅慧琴
子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是与子宫颈浸润癌密切相关的一种疾病,多发于25~35 岁女性人群,发病原因多与性生活紊乱、人乳头瘤病毒(human papillomavirus,HPV)感染等有关[1-2]。病理学上将CIN 分为3级,CINⅠ级者多数可自行消退,而CINⅡ级、Ⅲ级属于高级别CIN,容易发展成为子宫颈浸润癌,需要积极治疗[3]。当前,子宫颈锥切术是治疗高级别CIN 的主要方法,子宫颈锥切术常用的手术方案包括子宫颈环形电切术(loop electrosurgical excisional procedure,LEEP)、普通电刀锥切术(electrosurgical knife conization,EKC)等,其中LEEP 因具有简单易行、效价比高等优点,受到了广大医师和患者的认可[4]。EKC 属于传统术式,在高级别CIN 的治疗中积累了丰富的经验。然而,目前研究多集中于LEEP、子宫颈冷刀锥切术在高级别CIN 中的应用情况,但少有研究比较LEEP、EKC 治疗高级别CIN的效果。为明确LEEP、EKC 治疗高级别CIN 的安全性和有效性,本研究选取樟树市第三人民医院收治的84 例高级别CIN 患者为研究对象,旨在探讨LEEP、EKC 在高级别CIN 患者中的应用效果,以为临床手术方案的制订提供一定依据。
1 资料与方法
1.1 一般资料 本研究采用前瞻性随机对照的研究方法,选取2018 年1 月-2021 年6 月樟树市第三人民医院收治的84 例高级别CIN 患者。纳入标准:(1)符合文献[5]第8 版《妇产科学》中CIN 的诊断标准;(2)病理分级为CINⅡ、Ⅲ级;(3)凝血功能正常;(4)生命体征平稳;(5)认知功能良好,可配合本研究。排除标准:(1)合并生殖系统疾病;(2)妊娠期、哺乳期妇女;(3)合并严重内科疾病,如高血压、糖尿病等;(4)存在手术治疗禁忌证;(5)合并妇科恶性肿瘤;(6)精神失常;(7)术后失访。以随机数字表法将患者分为LEEP组与EKC组,每组42 例。该研究方案经医院医学伦理委员会批准,所有患者均签订知情同意书。
1.2 方法
1.2.1 LEEP组 患者于月经干净3~7 d 后入院接受LEEP 治疗,入院后对患者进行血常规、凝血功能、肝肾功能等常规检查;应用美国Ellman 公司生产的高频电波刀进行手术,高频电波刀频率为3.8 MHz,电凝功率为50 W;术前指导患者排空膀胱,取膀胱截石位,用碘伏消毒外阴、阴道及肛门,用干棉球擦拭阴道分泌物,术区铺设一次性无菌方巾;用卢氏碘溶液标记病变范围,明确不着色部位,在不着色边缘外约5 mm 处行LEEP 电切,深度为10~25 mm,切除结束后止血,并将病变组织送检,术毕。术后3~5 d 给予患者抗生素预防感染,告知患者避免过早活动,禁止性生活及盆浴2 个月。
1.2.2 EKC组 术前准备同LEEP组,应用苏州康迪电子有限公司生产的S900K 型电刀进行手术,电刀频率为0.5 MHz,电凝功率为45 W;首先,指导患者取膀胱截石位,对患者施行静脉麻醉,暴露并消毒子宫颈,术区常规铺巾;接着,将卢氏碘溶液涂抹于子宫颈表面,判断病变范围,向子宫颈筋膜内注射稀释后的肾上腺素,直至子宫颈筋膜外观水肿发白;然后用探针明确子宫腔深度及子宫颈管走向,并用宫颈扩张棒将子宫颈管扩张至7.5号,于不着色区边缘外3~5 mm 处做环形切口,之后切除瘤变子宫颈;最后,检查创面无出血及渗血后,对子宫颈创面进行消毒,宫腔内留置导尿管。术后3~5 d 给予患者抗生素预防感染,术后48 h 拔除导尿管,指导患者禁止盆浴、性生活2 个月。
1.3 观察指标及判定标准
1.3.1 手术指标 记录并比较两组患者手术时间、术中出血量、锥切面积和锥切高度。
1.3.2 切缘状态 比较两组患者切缘状态,切缘阳性指子宫颈锥切标本任一切缘或补切标本中存在CINⅠ级及以上病变;切缘阴性指所有子宫颈锥切标本中均未发现CIN 病变。
1.3.3 HPV 感染、病灶残留及复发 比较两组术前与术后6 个月HPV 感染率、术后即刻病灶残留率和术后6 个月病灶复发率。(1)HPV 感染检测方法:采用一次性宫颈细胞采集器采集子宫颈上皮脱落细胞,将细胞放置于装有细胞保存液的试管中,应用PCR 荧光法对HPV 基因型进行分型检测,试剂盒购自苏州天隆生物科技有限公司。(2)病灶残留及复发诊断标准:切缘阳性者术后即行全子宫切除术,若全子宫标本中存在CINⅡ级及以上病变者则定义为病灶残留;术后6 个月内细胞学无异常、无CIN病变存在,但在6 个月后经组织学证实为CIN 病变则判定为病灶复发[6]。所有病理结果均由2 位以上经验丰富的病理科医师进行诊断和复核。
1.3.4 并发症 观察并记录患者术后脱痂期出血、子宫颈管粘连等发生情况。
1.4 统计学处理 用SPSS 25.0 软件进行统计分析,所有计量资料均经Shapiro-Wilk 正态性检验,服从正态分布以(±s)表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验;计数资料以率(%)表示,组间、组内比较均采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 纳入的84 例高级别CIN患者均顺利完成本研究,无退出患者。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
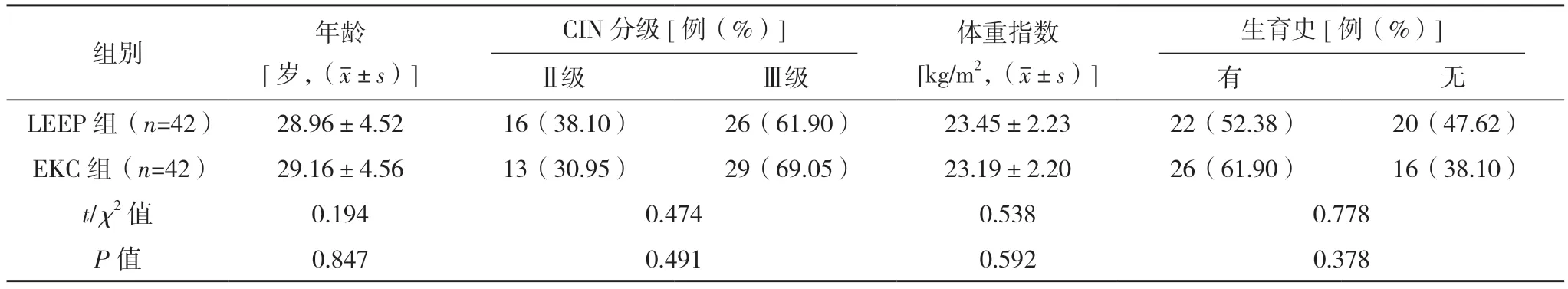
表1 两组一般资料比较
2.2 两组手术指标比较 两组手术时间、术中出血量比较,差异均无统计学意义(P>0.05)。LEEP组锥切面积小于EKC组,锥切高度低于EKC组,差异均有统计学意义(P<0.05)。见表2。
表2 两组手术指标比较(±s)
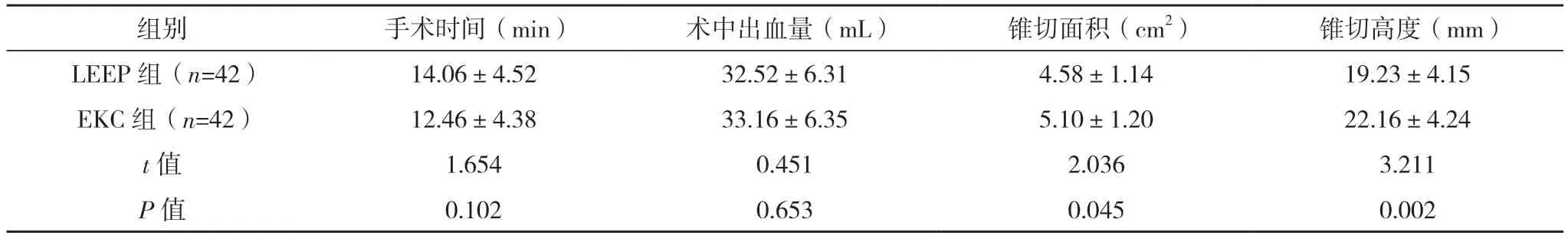
表2 两组手术指标比较(±s)
2.3 两组切缘状况比较 LEEP组42 例患者中,切缘阳性8例,占比为19.05%(8/42);EKC组42 例患者中,切缘阳性2例,占比为4.76%(2/42)。LEEP组切缘阳性率高于EKC组,差异有统计学意义(χ2=4.087,P=0.043)。
2.4 两组HPV 感染率、病灶残留率及复发率比较 LEEP组和EKC组术后病灶残留率分别为9.52%(4/42)、2.38%(1/42),两组病灶残留率比较,差异无统计学意义(χ2=0.851,P=0.356)。随访6 个月,LEEP组病灶复发率为23.53%(8/34),高于EKC组2.50%(1/40),差异有统计学意义(χ2=5.767,P=0.016)。术前,两组HPV 感染率比较,差异无统计学意义(P>0.05);随访6 个月,两组HPV 感染率均低于术前,差异有统计学意义(P<0.05);但两组随访6 个月HPV 感染率比较,差异无统计学意义(P>0.05)。见表3。

表3 两组HPV感染率、病灶残留率及复发率比较[例(%)]
2.5 两组并发症发生率比较 LEEP组42 例患者中,发生脱痂期出血2例,子宫颈管粘连2例,并发症发生率为9.52%(4/42);EKC组42 例患者中,发生创面感染2例,子宫颈管粘连1例,并发症发生率为7.14%(3/42)。两组并发症发生率比较,差异无统计学意义(χ2=0.000,P>0.05)。
3 讨论
子宫颈锥切术是临床上常见的一种妇科手术,可切除子宫颈移行区及部分子宫颈管组织,阻止高级别CIN 持续进展,降低子宫颈癌发生率[7-8]。子宫颈锥切术又分为LEEP、EKC,其中LEEP 属于新兴术式,EKC 为传统术式,二者均具有手术时间短、出血量少等优点,但目前关于EKC、LEEP 治疗高级别CIN 仍存在较大的争议。故本研究将重点探讨EKC、LEEP 在高级别CIN 患者中的应用效果,旨在为临床合理选择手术方式,提升患者手术效果提供参考。
本研究结果表明,LEEP 与EKC 治疗高级别CIN 的手术时间、术中出血量相当,但EKC 可避免LEEP 手术切割深度不够、切割面积有限等问题。分析其原因:LEEP 应用高频电波刀进行手术,高频电波刀刀头构造较为特殊,其承载电流的钨丝电切环是经650~800 ℃高温烧制而成,弯曲时韧性增加;且电切环直径仅为0.1~0.3 mm,当电切环接触病变部位时,病变损伤组织容易黏附于电切环,增加电切环移动阻力,导致电切环发生弯曲、变形,造成锥切标本越往后锥切高度越小,锥切面积也随之减小[9-10]。EKC 可减弱电流的碳化作用,控制电流强度,维持适当的切割深度,避免LEEP 术中切割深度不够、切割面积有限等不足。赵应梅等[11]研究报道,与LEEP 相比,EKC 具有足够的切割深度,能够获得较好的治疗效果。本研究进一步明确了EKC治疗高级别CIN 的优势。
本研究还发现,与LEEP 相比,EKC 可降低高级别CIN 患者切缘阳性率与病灶复发率。分析其原因:高级别CIN 病变范围较大,呈多灶性发展,通常会累及两个及两个以上腺体;LEEP 在切割病变时难以控制切割深度,无法深入切割病变,容易导致病灶切除不彻底,因此患者术后切缘阳性率及病灶复发率较高[12]。有研究指出,LEEP 术后标本切缘阳性还与患者年龄有一定关系,>40 岁患者LEEP术后切缘阳性率明显高于≤40 岁患者[13]。这是因为子宫颈CIN 发生于子宫颈鳞、柱交界区,患者年龄越大,CIN 病变越容易深入子宫颈管,增加LEEP切割难度,致使患者术后病灶复发可能性增大[14]。EKC 属于传统术式,EKC 手术范围广,能够满足不同病变范围、病变深度的CIN 患者,有效切除病变组织,弥补LEEP 术中无法深入切割病变的不足,降低患者术后切缘阳性率与病灶复发率[15]。早期研究报道,EKC 对CIN 患者标本切缘有碳化现象,会影响术者对切缘状态、病灶残留及复发的判断[16]。而本研究严格按照病变范围和级别确定病灶切除范围,同时在病灶与切除区域留有足够的距离,能够减少EKC 对切缘的影响,利于术者准确判定切缘状态、病灶残留及复发情况[17]。
本研究还对比两组患者术后并发症发生率,但结果无明显差异,说明LEEP、EKC 治疗高级别CIN 均具有良好的安全性。分析其原因:LEEP 引起的脱痂期出血主要与切除范围和切割深度有关,由于LEEP 切除范围小,切割较浅,故多数患者术后出血极少,因此应用LEEP 治疗的患者脱痂期出血发生率较低。另外,本研究在LEEP、EKC 术中合理控制切割范围和切割深度,同时术后给予患者抗生素预防感染,可有效预防患者术后发生创面感染、宫颈管粘连等并发症。
本研究还存在以下不足:(1)随访时间较短,只观察了LEEP、EKC 对高级别CIN 患者术后病灶复发、病灶残留的影响,未能观察LEEP、EKC 对患者的远期效果。(2)部分研究证实EKC 在降低病灶残留率、HPV 感染率方面有一定优势,但本研究基于样本数量影响,在病灶残留率、HPV 感染率方面比较并无明显差异。建议未来临床可延长随访时间,纳入更多的样本进入研究,以为高级别CIN 患者手术方式的选择提供依据。
综上所述,LEEP 与EKC 治疗高级别CIN 的手术时间与术中出血量相当,但EKC 在维持锥切高度、切割病变方面更具优势,且EKC 能够显着降低切缘阳性率和病灶复发率,建议临床在手术操作前,可对患者病变范围、病变深度进行充分评估,若患者病变范围较小且较浅时,可选择LEEP 术式,但若患者病变深、且病变范围广,可考虑使用EKC 进行治疗。



