郑彬,霍亚玲,时胜利,王攀鸽,刘玥
(1.郑州大学附属儿童医院,河南省儿童医院郑州儿童医院 a.医学影像科;b.超声医学科,河南 郑州 450000;2.国家儿童医学中心,首都医科大学附属北京儿童医院 影像中心,北京 100045)
恶性横纹肌样瘤是一组罕见的恶性实体肿瘤,好发于婴幼儿,中位发病年龄仅为11月龄[1]。恶性横纹肌样瘤可发生于身体任何部位,根据原发部位可分为中枢神经系统非典型畸胎样/横纹肌样瘤、肾恶性横纹肌样瘤(malignant rhabdoid tumor of the kidney,MRTK)及肾外非中枢神经系统横纹肌样瘤,其中MRTK仅占儿童肾脏恶性肿瘤的2%[2-3]。MRTK具高侵袭性和致命性,即使手术辅以放化疗仍高达80%以上的死亡率,且易发生远处转移和复发,预后极差。本文回顾性分析9例MRTK患儿的影像学及临床特点,归纳整理如下。
1 资料与方法
1.1 一般资料
收集郑州大学附属儿童医院2015年6月至2022年10月经穿刺活检或手术切除病理确诊为MRTK的9例患儿,根据美国肾母细胞瘤研究协作组分期系统分为Ⅱ期1例、Ⅲ期1例、Ⅳ期7例。
1.2 影像学检查方法
9例术前均接受CT检查,8例接受超声检查,3例接受MRI检查,包括1例腹部、2例头颅MRI。(1)超声。采用探头频率3.5~5.0 MHz及10.0~14.0 MHz的PhilipsIPQ7诊断仪。患儿仰卧或侧卧位,低频探头常规扫查患儿腹部,发现肾脏病变后改用高频探头观察肿瘤内部回声及邻近器官受累情况。(2)CT。采用Philips 64层螺旋CT机进行膈顶水平至盆腔入口的全腹部扫查。管电压100~120 kV,管电流200~250 mAs,螺距1.375,层厚5 mm,层距5 mm。增强扫描时使用高压注射器,将300 g·L-1碘海醇经肘静脉快速团注,注射剂量2 mL·kg-1,注射速度0.8~3.0 mL·s-1,注药后16~18 s、45~55 s开始动脉期及静脉期扫描。(3)MRI。采用Philips 1.5 T磁共振诊断仪,患儿口服100 g·L-1的水合氯醛镇静,儿童腹部线圈呼吸触发采集。常规进行冠状位T2压脂,轴位T2WI(TR 1 600 ms、TE 70 ms),T1WI(TR 10 ms、TE 2.3 ms、翻转角15°)及DWI(b=800),轴位T1WI及T2WI像FOV 224 mm×224 mm,矩阵240×240,层厚4 mm,层间距2 mm。增强以e-THRIVE序列为主,对比剂采用钆特酸葡胺注射液。所有报告均由2名高年资影像科医师采用盲法读片,观点不一致时协商或经由上级医师会诊达成一致意见后出具结果。
1.3 病理及免疫组化检查
采用 Envision二步法进行免疫组化染色,二氨基联苯胺显色,一抗采用波形蛋白(Vimentin)、上皮膜抗原(epithelial membrane antigen,EMA)、细胞角蛋白(cytokeratin,CK)、分化簇 99 (cluster of differentiation-99,CD99)、分化簇34(cluster of differentiation-34,CD34)、中枢神经特异蛋白(soluble protein-100β,S100β)、细胞周期素D1(CyclinD1)、肌浆蛋白(Myogenin)和SMARCB1基因(INH-1,BAF47)。
2 结果
2.1 临床表现
男4例,女5例,年龄2个月22天~5岁,中位年龄6个月5天。肿块均单发,其中左肾6例,右肾3例,临床表现为腹胀1例,腹部肿块2例,间断发热并血尿3例,发热3例,肿块最大者为86 mm×103 mm×94 mm。入院时9例乳酸脱氢酶(lactate dehydrogenase,LDH)均不同程度增高,部分患儿铁蛋白(ferritin,FER)、神经元特异性烯醇化酶(neuron specific enolase,NSE)增高。本研究术前7例伴转移,合并颅内肿瘤1例。6例患儿行带瘤肾脏切除术辅以化疗,2例仅行化疗,1例放弃治疗。见表1。
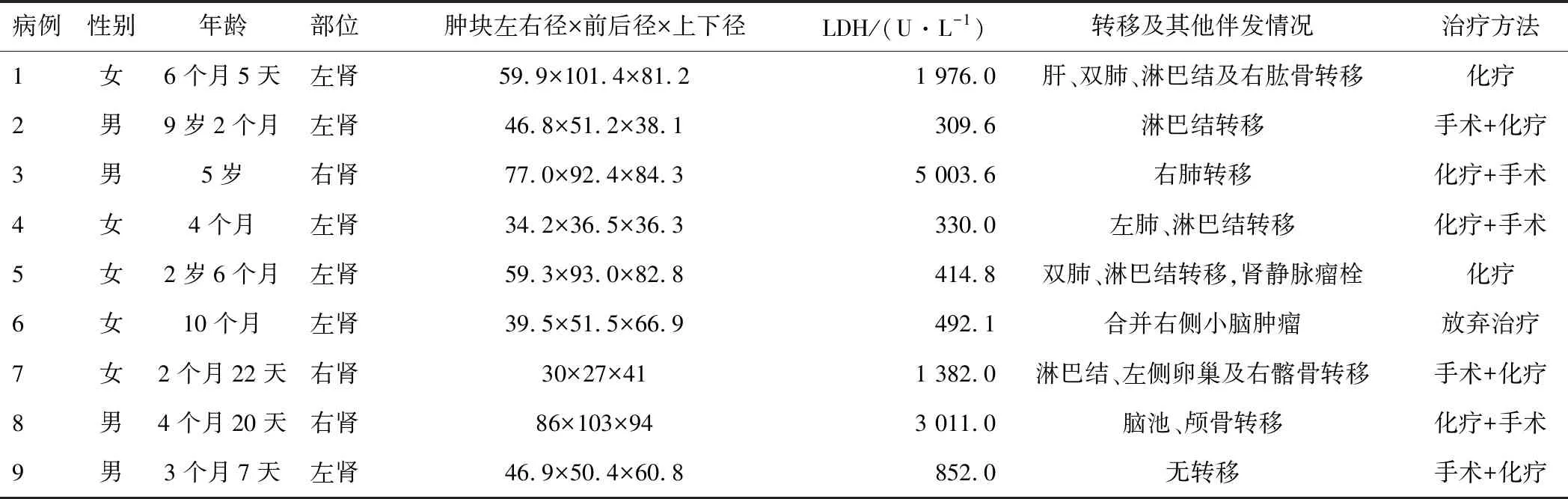
表1 9例患儿一般情况
2.2 影像学表现
超声(8例):肾脏囊实混合回声肿块7例,以实性等低回声为主伴大小不等囊变,实性为主肿块1例,肿块以肾髓质为中心向周围浸润性生长,内部多伴囊变坏死及包膜下出血、积液,与残肾界限不清(图1A),其中6例累及肾门并包绕肾门血管,1例伴肾静脉瘤栓。彩色多普勒超声肿块实性部分见血流信号。
病例1,女,MRTK病程6个月5天。A图为超声显示左肾肿块以实性等低回声为主,并见少许极低回声及囊状无回声,肿块与残肾界限不清;B图为CT平扫显示左中下腹软组织密度肿块,内部伴坏死及条状钙化灶,跨越脊柱向右生长;C图为CT增强显示肿块不均匀强化,并包绕、推挤周围组织;D图为CT增强矢状位显示肿块伴包膜下积液;MRTK为肾恶性横改肌样瘤。
CT(9例):CT平扫呈密度不均囊实性或实性为主肿块(图1B),其中2例囊实性边界模糊呈渐变样过渡,即“融冰征”表现,2例伴斑片状、条状钙化。肿块对邻近肾实质有侵蚀破坏,与残肾界限不清。增强扫描肿块实性部分呈不均匀强化,动脉期可见多根肾动脉分支小血管走行,强化程度低于周围残肾组织(图1C)。其中6例侵犯肾盂,4例伴瘤内出血及肾包膜下积液(图1D)。
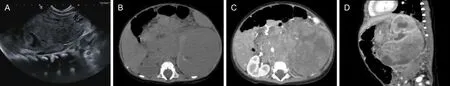
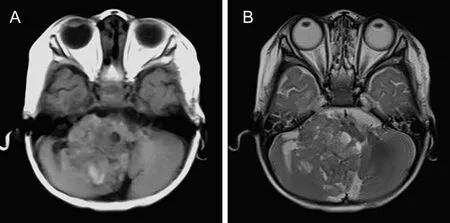
MRI(3例):1例肿块位于左肾,表现为团块状混杂信号,以T1WI稍低T2WI高信号为主,其内囊变坏死呈T2WI更高信号,实性部分DWI呈高信号。1例合并颅内肿瘤(图2A、2B),1例伴脑池转移(图3A、3B)。
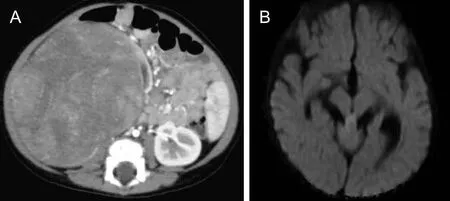
病例6,女,10个月,MRTK。A图为CT平扫显示左肾囊实性肿块;B图为CT增强显示肿块强化不均,伴囊变坏死及包膜下积液;MRTK为肾恶性横改肌样瘤。
病例8,男,4个月20天,MRTK。A图为CT增强显示右肾肿块强化不均匀,可见多条肾动脉分支小血管走行;B图为MRI平扫DWI序列显示四叠体后方类圆形结节,呈环形等高信号;MRTK为肾恶性横改肌样瘤。
2.3 病理表现
肿瘤标本质软,无包膜,瘤内伴坏死并浸润肾门、肾包膜。镜下见瘤组织由多边形增殖横纹肌样细胞组成,呈腺泡状排列,细胞质丰富粉染,可见嗜酸性包涵体(图4A)。免疫组化Vimentin(+)9例, EMA(+)4例,CK(+)4例,CD99(+)3例,CD34(+)8例,CyclinD1(少数细胞+)6例。INI-1(-)6例,1例INI-1(+)患儿补做BRG1呈阴性,证实亦为MRTK(图4B)。
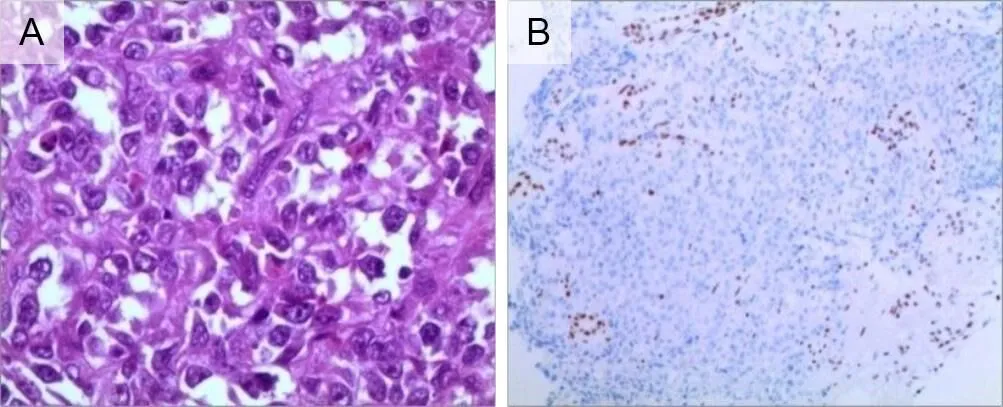
A图为病理(HE×400),镜下瘤细胞体积较大,呈腺泡状排列,可见嗜酸性包涵体;B图为免疫组化Vimentin(+),INI-1(+),BRG1(-),SMA(+);MRTK为肾恶性横改肌样瘤。
2.4 随访情况
6例手术辅以化疗患儿术后原发部位肿瘤复发4例,复发时间1~10个月,其中合并腹腔、腹膜后淋巴结转移3例,腰椎转移1例,2例随访3~12个月后未见复发;2例化疗患儿1例复查肿瘤无明显缩小,腹膜后出现淋巴结转移,之后继续化疗,1例化疗1次后失访;1例放弃治疗患儿死亡。
3 讨论
MRTK曾被认为是肾母细胞瘤(Wilms瘤)的特殊亚型,1981年Haas等发现此肿瘤缺乏横纹肌的超微结构,于是将其单独分类并命名为MRTK[4-5]。MRTK的病因尚不明确,但与分子遗传学关系密切[6]。
MRTK多发生于2岁以下男童,临床上无特征性表现,常因肉眼血尿、腹部包块等症状就诊,欧洲肿瘤协作组研究发现MRTK的中位发病年龄为13个月[7]。本研究中位发病年龄6个月5天,低于以往报道,男女比例大致相同。MRTK 96%单侧发病,具有高度侵袭性,转移率约为80%,常见于肾周淋巴结及脉管,亦可发生肺、肝、脑及骨转移,预后不良[8-9]。本研究术前7例伴转移,合并颅内肿瘤1例,最常见淋巴转移,其次为肺及骨转移。值得一提的是本研究1例伴左侧卵巢囊性转移灶,此部位转移以往未见报道。血清LDH、FER及NSE含量增高提示恶性肿瘤可能,本组患儿入院时LDH均明显增高。
MRTK的影像学表现具有一定特征。超声无辐射且可实时动态检查,在MRTK的初筛及后期随访中具有重要作用,但其对瘤体内血流灌注及肿瘤分期的评估能力有限。超声检查MRTK可探及肾髓质为中心的不均质肿块,实性部分可探及血流信号,多伴囊变坏死及肾包膜增厚、包膜下出血、积液[10-11]。肿块可累及肾皮质、突破肾包膜及肾周组织,推挤包绕肾血管并形成大血管瘤栓,甚至延伸至右心房,肾包膜是否受累对肿瘤分期有重要提示作用。CT空间分辨率高,利用造影剂增强轴位图像并进行三维重建,直观完整地观察肿瘤整体形态及与周围组织关系,有助于评价肿瘤血供情况,但有一定辐射。MRTK患儿CT表现为单侧肾脏囊实性或实性为主肿块,密度不均,起源于肾髓质并靠近肾门。肿块囊、实性部分界限模糊,实性部分强化不均,强化程度低于周围残肾,肾包膜受侵犯时呈结节状增厚并明显强化,囊变坏死组织无强化,残肾组织边界模糊。文献指出,MRTK瘤体囊、实性成分分界不清,CT表现为渐变样过渡的“融冰征”改变[12]。本组2例有此特点,占22.2%,少于以往报道的60.0%。相对于CT检查,MRI无电离辐射,密度分辨率更高,本研究1例患儿肾脏MRI常规序列呈团块状混杂信号,实性部分弥散受限、DWI呈高信号,对于判断肿块良恶性可能具有一定意义。MRTK可合并其他颅内原发肿瘤,此特点可其他肾肿瘤相鉴别。本研究另外2例行MRI患儿为1例合并右侧小脑半球肿瘤,影像学倾向于恶性,因家属放弃治疗未能取得病理结果,1例伴四叠体池内结节状转移灶。综上,总结MRTK的影像学特点主要包括以下几点。(1)囊实性病变为主,回声/密度/信号混杂,囊、实性边界模糊呈“融冰征”表现;(2)肿块实性部分可见细小肿瘤血管,弥散受限;(3)肿块以肾髓质为中心向周围浸润性生长,内部多伴囊变坏死及包膜下出血、积液;(4)易发生远处转移和复发,可合并颅内其他原发肿瘤。MRTK与Wilms瘤、肾透明细胞肉瘤及肾细胞癌等恶性肿瘤影像学表现类似,不易鉴别[13]。Wilms瘤是儿童最常见的肾脏恶性肿瘤,但起源于肾皮质,虽也常见囊变坏死、钙化,但由于瘤周有假包膜,与残肾界限相对清晰。肾透明细胞肉瘤平均发病年龄为36个月,同样起源于肾髓质,但很少侵及邻近血管,少见包膜下出血、积液,早期即可发生骨骼转移。肾细胞癌主要发生于20岁以上,儿童罕见,肿块常凸出于肾轮廓,增强后实性部分强化程度接近肾实质[14]。
MRTK的临床诊断主要依靠病理,大体标本无包膜,切片呈鱼肉状浸润性生长,内部多伴坏死及囊变,外周可见瘤栓。镜下瘤细胞弥漫分布,体积较大,核偏位,细胞质丰富粉染,胞质内嗜酸性包涵体是其光镜特征。免疫组化Vimentin均表达,CK、EMA、SMA多数表达。研究显示MRTK均有即抑癌基因SMARCB1/INI-1异常,在22号染色体上的hSNF5/INI-1基因突变是儿童MRTK的特征[15],检测hSNF5/INI-1基因突变或其基因产物缺乏有助于本病的诊断。本研究共7例检测INI-1,其中6例INI-1(-),1例患儿虽然INI-1(+),但补做BRG1(-),仍支持MRTK的诊断。MRTK的治疗以手术切除为主,辅以放化疗及干细胞移植的综合性治疗。MRTK恶性程度极高,且多于短期内发生复发、转移,发病年龄越小预后越差。本研究4例术后复发及转移者均为小于10个月龄的低龄患儿,最短复发时间仅为1个月。患儿生存时间也与肿瘤分期密切相关,Ⅰ期患儿生存期较长,Ⅱ~Ⅲ期根治性术后辅以化疗后仅少数患儿生存期超过2 a,临床上80%的患儿为Ⅲ期~Ⅳ期,对化疗不敏感,死亡率高[15-16]。
4 小结
本研究就诊时多数已处于临床Ⅳ期,预后很差。MRTK治疗进展较艰难,但有研究报道MRTK的多个分子靶标有望成为潜在的治疗靶标,也开展了相关途径和靶标抑制剂的临床试验,如CDK4/CyclinDl、Sonic-Hedgehog信号通路、AURKA激酶抑制剂等相关研究[3]。因此,对婴幼儿定期进行体检,尽早发现肿瘤并准确分期,针对性靶向药物治疗可能会改善MRTK患儿预后。



