林凌桑,陈 洁,李思广,张 蕾,丁毅鹏,3
(1.海南医学院附属海南医院,海南 海口 570311;2.海南省人民医院全科医学科,海南 海口 570311;3.海南省人民医院呼吸与危重症医学科,海南 海口 570311)
肺纤维化(pulmonary fibrosis,PF)是一种严重的慢性间质性肺疾病,其主要病理改变是肺泡壁及间质异常增生和纤维化[1]。这种病理改变导致肺组织中纤维蛋白沉积,从而使肺泡无法正常展开,进而影响气体交换功能[2]。该病的成因多样,可能与长期吸入有害颗粒物、某些药物或遗传因素有关。尽管目前尚无针对性的治疗方法,但如胞外基质抑制剂、糖皮质激素、抗氧化剂、免疫抑制剂等药物可以减缓病情的进展,并帮助改善症状[3,4]。
近年来,中医辨证论治的中药复方对肺间质纤维化有明显改善作用,且毒副作用小[5,6]。尤其值得关注的是一种名为“化瘀理肺方”的中药复方,它以“活血化瘀、祛痰理肺、畅利气机”为治则[7]。已有研究发现,Wnt/β-catenin 分子通路与肺纤维化的发展密切相关[8],且该通路受微小RNA-27a-3p(miR-27a-3p)的调控[9]。然而,“化瘀理肺方”在治疗博莱霉素诱导的大鼠肺纤维化时,是否会对miR-27a 和α-平滑肌蛋白(α-smooth muscle actin,α-SMA)的表达产生影响,目前尚无研究报道。
在本研究中,采用博莱霉素处理大鼠构建肺纤维化模型[10],并使用化瘀理肺方进行干预治疗,通过观察α-SMA 的表达,检测miR-27a 的表达以及验证它们的结合位点,研究其可能的作用机制,为理解化瘀理肺方的作用机制提供了新的视角。
1 材料与方法
1.1 动物与试剂
健 康 雄 性Wistar 大 鼠,4~6 周 龄,体 重 范 围180~220 g,清洁级,由广州中医药大学实验动物服务中心提供,动物合格证号44005800002779。
博莱霉素从Sigma 公司采购;HE 染色试剂盒、Masson 染色试剂盒和免疫组化试剂盒购于北京Solarbio 公司;α-SMA 一抗购于abcam 公司;293T 细胞株从中科院细胞资源库购买;胎牛血清、DMEM 培养基和胰酶试剂从Invitrogen 公司购买;逆转录试剂盒(P312)和实时荧光定量PCR(Q331)购于南京诺唯赞生物;双荧光素酶报告基因购自上海吉玛基因(GenePharma)。
1.2 化瘀理肺方来源与处理
化瘀理肺方所使用的中药成分包括半夏、丹参、当归、水蛭、黄芪、薏苡仁等。该方剂各中药采用浓缩颗粒剂,由江阴天江药业有限公司负责生产,生产批号为0509025。经过溶解后,含生药量为1 341 mg/mL 的溶剂经高压灭菌并储存在4 ℃冰箱备用[11]。
1.3 肺纤维化大鼠模型制备及分组
将Wistar 大鼠放入饲养环境经过适应1 周后,将其称重和编号。将各组10 只大鼠分为:对照组、模型组(博莱霉素处理)和化瘀理肺方组(博莱霉素加化瘀理肺方处理)。博莱霉素所致的病理改变与人的肺纤维化极为类似,因而被广泛用于建立肺纤维化的动物模型[10]。在本研究中,使用1%戊巴比妥钠(35 mg/kg)对大鼠进行腹腔内注射,致其麻醉后,对大鼠肢体及头部进行固定,然后将与1 mL 注射器相连的导管插入气管,注射0.4%浓度的博莱霉素0.25 mL(5 mg/kg),以正常对照的方式,对照组的大鼠注入等量的生理盐水,注射后,立即对动物进行直立旋转,以确保药物均匀分布在肺内,以此构建肺纤维化模型。化瘀理肺方组在造模后1 周灌胃给与化瘀理肺方药物悬液2 mL(13.4 g·kg-1·d-1)治疗,在随后的1 周中持续给予该剂量药物[11]。对照组及模型组每日以的生理盐水(2 mL/只)灌胃。造模14 d 后将大鼠处死,取出右肺中叶作后续检测。
1.4 肺组织HE 和Masson 染色
将实验大鼠的右肺中叶取出并放入10%甲醛中进行固定。随后,进行常规石蜡包埋过程,制备连续4 μm 厚石蜡切片,采用苏木精-伊红染色法(也被称为HE 染色法)和Masson 三色法对这些切片进行染色,在光学显微镜下观察其肺组织的改变特点。应用HE 染色法,主要观察实验鼠肺组织的炎症病理学变化特征,包括脂肪变和炎性细胞浸润等现象。采用Masson 染色法,主要对实验鼠肺组织肺纤维化程度进行评估,包括纤维化细胞浸润数量、肺组织形态学变化、肺泡壁结构变化等。
1.5 免疫组化检测
用75%乙醇对每组大鼠肺组织的石蜡切片进行脱脂处理,分别在95%和100%乙醇中各浸泡5 min,接着进行2 次二甲苯浸泡,每次10 min。用0.3% 的H2O2甲醛溶液对切片进行去氧处理30 min,该方法能有效地消除内源性过氧化物酶对肺组织切片造成的干扰。用PBS 缓冲液洗涤切片5 min,进行3 次。在室温条件下加入α-SMA 一抗,孵育1 h,随后再次用PBS 缓冲液洗涤切片5 min,进行3 次。加入荧光素二抗,并在室温下孵育1 h,再次使用PBS 缓冲液洗涤切片,接着加入足量的荧光素室温孵育30 min。最后使用PBS 缓冲液洗涤切片3次,每次5 min,将切片用蒸馏水冲洗干净并封片。在显微镜下观察切片,并进行图像记录和分析。
1.6 qRT-PCR 检测
以Trizol 为试剂,从不同组别大鼠肺组织中提取RNA。随后,使用美国赛默飞的NanoDrop 2000对RNA 进行了浓度和纯度评估。接下来,我们使用逆转录试剂盒将RNA 逆转录为cDNA,并使用ABI 7500qPCR 仪进行qPCR 反应。PCR 反应的参数为:首先进行95 ℃的预变性处理,持续5 min,接下来进行95 ℃变性5 s,62 ℃复性20 s,72 ℃延伸30 s,共进行40 个 循 环。以U6 作为内参,并 采 用2-ΔΔct法计算miR-27a 的表达量。miR-27a 上游引物:5′-TGCGGTTCACAGTGGCTAAG -3′,miR-27a 下游引物:5′- CTCAACTGGTGTCGTGGA-3′;U6上游引物:5′- CTCGCTTCGGCAGCACA-3′;U6下 游 引 物:5′- AACGCTTCACGAATTTGCGT-3′。
1.7 双荧光素酶报告基因实验
双荧光素酶报告基因实验使用293T 细胞进行。首先,将ACTA2 的野生型3'非翻译区(UTR)及其突变体插入到pMIR-RB-REPORT™荧光素酶mRNA 表达报告载体中。接下来,将5×104个/孔的293T 细胞接种到6 孔板,并使用Lipofectamine 2000 将四组样本进行转染:ACTA2-WT 和miRNC 组、ACTA2-WT 和miR-27a 组、ACTA2-MUT和miR-NC 组,以 及ACTA2-MUT 和miR-27a 组。在转染48 h 后,利用荧光分光光度计对Firefly 和Renilla 荧光素酶活性进行评估,并将其归一化为Renilla 荧光素酶活性。
1.8 统计学处理
使用GraphPad Prism 9.0 进行数据统计分析,针对符合正态分布的计量资料,使用均值加减标准差(±s)来表示。采用t检验进行两组间数据比较,而对于多组数据之间的比较,采用单因素方差分析方法。统计学差异显着的数据以P<0.05表达。
2 结果
2.1 各组大鼠肺组织病理学观察
使用HE 染色对各组大鼠肺组织进行了病理学特征的观察。结果表明,在模型建立后1 周,对照组大鼠的肺组织展现出正常的肺泡形态。肺组织完整且清晰可见,肺泡壁薄且较连续,并且没有明显的炎症细胞浸润现象。这表明对照组大鼠的肺部没有发现异常的病理改变,没有明显的炎症反应发生。而模型组大鼠肺组织呈弥漫状实变,观察结果显示肺泡壁显着增厚,肺泡间隔也遭到破坏,肺泡内可见大量炎症细胞浸润,间隔也增宽,且肺间质内有较多成纤维细胞。但化瘀理肺方对大鼠肺组织的影响却与正常组相近,肺组织仅偶尔观察到少量炎性细胞浸润,大部分均保持正常,见图1。这些结果表明,化瘀理肺方能够有效改善博莱霉素导致的大鼠肺纤维化。

图1 化瘀理肺方对肺纤维化大鼠肺组织病理改变的影响(HE,400×)Fig 1 The impact of Huayu Lifei formula on the pathological alterations in lung tissue of bleomycin-induced rat lung fibrosis model(HE,400×)
2.2 化瘀理肺方改善博莱霉素诱导的肺组织胶原沉积
通过Masson 染色观察,对照组大鼠的肺组织呈现出清晰的结构,未观察到明显的炎症细胞浸润和胶原沉积(蓝色沉积);模型组大鼠肺间质病变严重,伴有炎症细胞浸润及明显蓝色胶原沉积;而化瘀理肺方组大鼠的肺组织胶原结构与对照组基本一致,见图2。由此可推断,化瘀理肺方有助于减少博莱霉素引起的肺组织胶原沉积的作用。
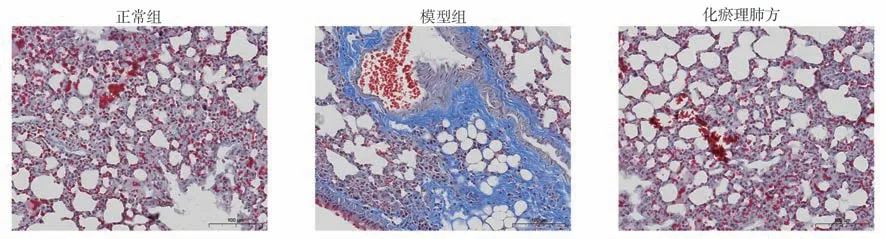
图2 化瘀理肺方对肺纤维化大鼠肺组织胶原的影响(MASSON,400×)Fig 2 The effect of Huayu Lifei formula on the collagen in lung tissue of bleomycin-induced rat lung fibrosis model(MASSON,400×)
2.3 化瘀理肺方抑制博莱霉素诱导的α-SMA 表达
通过免疫组化检测肺纤维化指标α-SMA 表达情况。免疫组化结果提示,α-SMA 在模型中高表达,提示肺纤维化模型构建成功。而α-SMA 在正常组与化瘀理肺方组肺组织中表达量明显下降,见图3。以上结果提示,化瘀理肺方能够抑制博莱霉素诱导所致的大鼠肺纤维化。
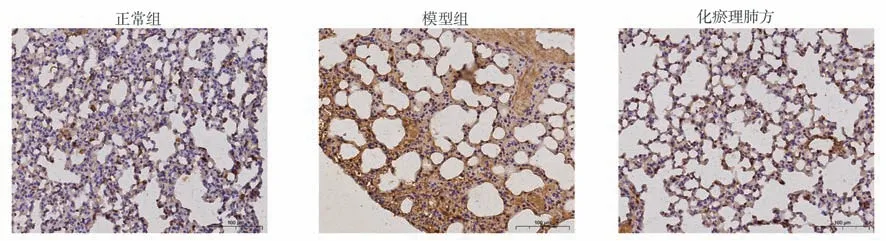
图3 化瘀理肺方对肺纤维化大鼠肺组织α-SMA 表达的影响(400×)Fig 3 The effect of Huayu Lifei formula on the α-SMA in lung tissue of bleomycin-induced rat lung fibrosis model(400×)
2.4 化瘀理肺方促进miR-27a 表达
通过qRT-PCR 检测化瘀理肺方对肺纤维化大鼠肺组织中miR-27a 的影响。qRT-PCR 检测显示,与对照组相比,模型组肺组织中miR-27a 的水平明显 降 低(0.46±0.06vs.0.99±0.05,P<0.001,t=11.14);与模型组相比,化瘀理肺方组肺组织中miR-27a 的 表 达 量则 显 着 上升(2.97±0.38vs.0.46±0.06,P<0.001,t=11.19),见图4。据此,可以推测miR-27a 在化瘀理肺方对博莱霉素诱导的大鼠肺纤维化的抑制作用中发挥了作用。

图4 化瘀理肺方对肺纤维化大鼠肺组织中miR-27a 的影响Fig 4 The effect of Huayu Lifei formula on the miR-27a in lung tissue of bleomycin-induced rat lung fibrosis model
2.5 miR-27a 靶 向 结 合ACTA2 基 因
Targetscan 数 据 库(http://www.targetscan.org/)预测显示miR-27a 与编码α-MA 的基因ACTA2 的3'UTR 存在互补结合位点,见图5A。将含有ACTA2 基因3'UTR 结合位点的荧光素酶报告载体分别与miR-27a 模拟物、miR-27a 抑制剂共转染到293T 细胞中,培养24 h 后,对荧光素酶活性进行共同测试,结果显示,ACTA2 3'-UTR-WT 和miR-27a的共转染显着抑制了荧光素酶活性(0.35±0.03vs.1.02±0.04,P<0.001,t=22.6),而ACTA2 3' -UTR-MUT 和miR-27a 共转染对荧光素酶活性无明显 影 响(0.98±0.09vs.1.02±0.04,P=0.49,t=0.75),见图5B,表明ACTA2 的3'UTR 与miR-27a存在结合位点。上述结果提示,miR-27a 可能通过靶向结合ACTA2 抑制α-SMA 蛋白表达参与化瘀理肺方对博莱霉素诱导大鼠肺纤维化的抑制作用。

图5 miR-27a 靶向结合ACTA2Fig 5 miR-27a binds to ACTA2
3 讨论
肺纤维化是一种主要发生在肺组织中、表现为肺泡和小叶之间的结构损伤的慢性肺部疾病,病理特点是肺组织内肺泡间质炎性细胞浸润、纤维细胞异常增生,并可引起肺间质纤维化及呼吸功能障碍[12]。肺纤维化病情进展迅速,患者从确诊后只有3~5 年的平均生存期,临床表现主要为干咳和呼吸困难[1]。由于目前缺乏有效的防治措施,故对其致病机理进行深入研究具有重要意义[2]。
中医药在中医临床中扮演着重要的角色,常被应用于预防和治疗各种疾病。相对于西药,中医药具有副作用较小、疗效持久,适应范围广泛等优点[13]。研究报道,复方补肺理气汤能够改善肺纤维化,降低TGF-β1 和α-SMA 的mRNA 水平[14]。在本研究中,根据中医理论组成了化瘀理肺方。该方中,丹参活血化瘀,半夏燥湿化痰,两者共同作用,有效消除络脉中的痰浊和瘀血。作为臣药的水蛭和当归,协助君药化痰、通络;黄芪则补气、增强阳气;这三味药物共同辅助作用,促进滞血消散和经络通畅。同时,鱼腥草、薏苡仁和地龙作为佐药,协调全方药性,共同发挥补肺固表、逐瘀和益气的功效。本研究通过使用博莱霉素诱导的大鼠肺纤维化模型,并对该模型组使用化瘀理肺方进行了治疗。实验结果显示,该药方能有效改善博莱霉素诱导的大鼠肺纤维化模型的病理状态以及减少胶原沉积,与李飞等[15]的研究结果,即化瘀理肺方对博莱霉素所致肺纤维化大鼠有一定预防性治疗作用一致。α-SMA 作为纤维化标记物之一,常在肺纤维化中呈高表 达 水平[16,17],本研究实 验 结果显示,α-SMA 在正常组与化瘀理肺方组肺组织中表达量明显下降,进一步提示化瘀理肺方能够抑制博莱霉素诱导所致的大鼠肺纤维化。
从分子机制角度,肺纤维化的发生与TGF-β、Wnt/β-catenin 和PI3K/Akt 等信号通路异常激活和失衡密切相关[8,18,19]。TGF-β 信号通路的异常激活被认为是肺纤维化发展的核心机制之一[20]。最新研究显示,微小RNA(miRNA)在肺纤维化的形成和发展过程中起关键作用,但其具体调节和个体病理作用在很大程度上仍然未知。部分miRNA,如miR-21、miR-33 等,已被发现能够影响纤维母细胞的增殖和分化、基质合成以及免疫反应等过程[21-23]。miRNA 也被视为肺纤维化的潜在治疗靶点,针对特定miRNA 进行干预可以抑制肺纤维化的进展[24]。miR-27a 是一种其定位在人类的第19 号染色体上的多效性微小RNA[25]。研究发现,过表达miR-27a 能够有效缓解博来霉素诱导肺纤维化,它通过靶向抑制Wnt3a/β-catenin 信号通路,减少肺组织细胞外基质的损害,从而改善肺纤维化症状[9,26]。本研究观察到模型组肺组织中miR-27a 的水平大幅下降,而通过化瘀理肺方进行治疗则能够显着提高miR-27a的表达,这暗示了miR-27a 在化瘀理肺方对博莱霉素诱导的大鼠肺纤维化的治疗中发挥作用。据此,推测miR-27a 在化瘀理肺方对博莱霉素诱导的大鼠肺纤维化的抑制作用中发挥了作用。
miRNA 在调控目标基因表达方面发挥重要功能,对基因调控、细胞增殖、分化以及凋亡等生理生化过程有关键影响[27]。α-SMA 由ACTA2 基因编码[28,29],而ACTA2 作为重要的纤维化标志物,其诱导是决定肌成纤维细胞分化的常见关键因素[30]。研究发现,在肿瘤微环境中,miR-27a 的敲低诱导ACTA2 的表达,增强肺成纤维细胞向肌成纤维细胞的分化,并进一步支持纤维化[26,31]。在本研究中,利用Targetscan 数据库进行预测,并通过双荧光素酶报告基因技术进行验证,证实了miR-27a 与编码α-SMA 的基因ACTA2 存在结合位点,这些数据支持已发表的研究结果[31]。因此,推测miR-27a 通过靶向结合ACTA2,抑制α-SMA 蛋白表达,从而介导化瘀理肺方对博莱霉素诱导大鼠肺纤维化的治疗作用。
研究结果表明,采用化瘀理肺方可治疗博莱霉素所致大鼠肺纤维化,促进miR-27a 表达,α-SMA的表达则明显下降。而化瘀理肺方是否通过促进miR-27a 的表达,抑制α-SMA 的表达,从而对博莱霉素诱导大鼠肺纤维化产生有效的治疗作用还需要药物处理同时干预miR-27a 与α-SMA 表达探讨其因果关系。
综上所述,研究结果表明,化瘀理肺方能有效治疗通过博莱霉素诱导所致的大鼠肺纤维化,且促进miR-27a 表达,抑制α-SMA 表达。为化瘀理肺方治疗机制深入理解提供理论依据。本方可作为中医药临床防护肺纤维化的一种新的可行性策略。
作者贡献度说明:
林凌桑:动物实验与稿件写作;陈洁:试剂采购;李思广:病理染色;张蕾:实验结果分析与修稿;丁毅鹏:经费支持与稿件确认。
所有作者声明不存在利益冲突关系。



