贲新宇,易西南,李其富
(1.海南医学院第一附属医院神经内科,海南 海口 570102;2.海南省热带脑科学研究与转化重点实验室,海南 海口 571199)
1-磷酸鞘氨醇 (S1P) 是一种生物活性脂质,由神经酰胺转化为鞘氨醇,通过鞘氨醇激酶 (sphingosine kinase,SphK) 磷酸化鞘氨醇而产生[1]。S1P 可以在细胞内参与各项生理活动,也可以转出细胞外并与细胞上的 S1P 受体(S1PR)结合[2]。S1P 通过五种 S1P 特异性细胞表面 G 蛋白偶联受体(S1PR1~S1PR5)以自分泌或旁分泌方式发挥作用,调节细胞增殖、凋亡等过程[3-6]。S1P 通过这些受体的激活PI3K/Akt 通路和Ras/细胞外信号调节激酶 (ERK) 通路以促进增殖和防止细胞凋亡[7,8]。此外,S1P 还可以激活蛋白激酶 C 来抑制神经酰胺介导的细胞凋亡,抵消神经酰胺诱导的应激激活蛋白 激 酶 (SAPK/JNK) 的 激 活[9]。这 些 证 据 表 明S1P 在调控细胞增殖和凋亡的过程中起到至关重要的作用。
将鞘氨醇磷酸化为S1P 的关键酶SphK 包括两种亚型,即SphK1 和 SphK2。细胞因子介导的SphK1 激活导致鞘氨醇磷酸化,使细胞内产生S1P,然后由鞘脂转运蛋白 2 (sphingolipid transporter 2,SPNS2) 将S1P 从细胞中转运出来[10]。SphK2 主要位于线粒体和细胞核中,其磷酸化线粒体中的鞘氨醇产生的S1P 与抑制素 2 相互作用调节复合体 IV的组装和呼吸[11]。细胞内的S1P 通过在内质网、线粒体和细胞核等不同细胞位置的多种酶促反应发挥 作 用[12,13]。总 而 言 之,SphK1 产 生 的S1P 既 可 以在细胞内发挥作用,又可以介导细胞间的信号传导,SphK2 产生的S1P 仅在细胞内调节细胞功能。
1 1-磷酸鞘氨醇在中枢神经系统中的功能
大脑中 S1P 的含量在人体中最高,在中枢神经系统中发挥着重要的生理功能[14]。已鉴定出五种S1P 受体,包括 S1PR1、S1PR2、S1PR3、S1PR4 和S1PR5,其 中 四 种(S1PR1、S1PR2、 S1PR3 和S1PR5)在中枢神经系统中表达[15,16]。S1PR5 在人类胼胝体中表达最高,而 S1PR1 在小鼠额叶皮层和胼胝体表达较高[17]。在中枢神经系统中,S1PR1 由星形胶质细胞、小胶质细胞、少突胶质细胞和神经元表达,S1P 的失调可能导致中枢神经系统多种细胞出现生理功能障碍,从而促进神经系统疾病的发生发展[18]。最近的一项研究显示,外源添加的 S1P通过 S1P (1,3) 受体依赖性机制增加了SH-SY5Y的活力[19]。大量研究表明,S1P 水平的降低和神经酰胺的积累与认知障碍、智力丧失和神经元丧失的程度成正比[20-22]。随着对神经系统鞘脂代谢研究的逐渐深入,S1P 在中枢神经系统中的具体功能及其机制被人们熟知。
S1P 在突触传递中能够调节神经递质的释放和细胞膜兴奋性,还能通过调节海马神经元的突触强度从而影响记忆的形成[23,24]。除了对神经元的影响,S1P 在胶质细胞的生理过程中发挥着重要的作用。值得注意的是,S1P 在胶质细胞的影响中通常扮演着不利的角色。例如,在活化的小胶质细胞中添加外源 S1P 引起促炎细胞因子释放增加,从而导致神经炎症的发生[25]。此外,S1P 通过 S1PR1 促进星形胶质细胞中 IL-1 诱导的 IL-6 表达,并在S1PR2 依赖性机制中抑制趋化因子 CCL-5[26]。给予星形胶质细胞生理浓度的 S1P 后,星形胶质细胞会诱导神经元变性,而S1P 直接添加到神经元中没有引起任何变化[27]。正因S1P 在神经元和胶质细胞中的作用不一致,使得其在神经系统疾病治疗领域需要进一步探索。
2 1-磷酸鞘氨醇在神经退行性疾病中的研究
神经退行性疾病通常以细胞内或细胞外聚集错误折叠的蛋白质为特征,包括帕金森病(parkinson's disease,PD)、阿尔茨海默病(alzheimer's disease,AD)、亨廷顿病(huntington's disease,HD)、肌萎缩侧索硬化症、多发性硬化(multiple sclerosis,MS)等[28-31]。目前,越来越多的研究发现S1P 信号传导参与神经退行性疾病发生的证据,一系列针对S1P 信号传导途径的药物在这些研究的基础上应运而生,其中部分药物已经在临床试验中进行测试[32]。
2.1 S1P 信号传导对AD 的影响
AD 作为最常见的神经退行性疾病一直是神经科学的研究重点,S1P 在AD 发生过程中的作用也受到广泛关注。众所周知,Aβ 蛋白的沉积是阿尔兹海默病发生的机制之一[33]。大量研究证实S1P 的上调可以减少Aβ 蛋白的沉积,从而改善AD 的进展[34,35]。众多研究发现,在 AD 患者的脑组织中,神经酰胺水平升高,鞘磷脂和 S1P 水平降低[36,37]。此外也有研究认为S1P 的下调可能是AD 后Aβ 蛋白的沉积的结果,从而导致细胞凋亡,加速AD 的发展[38,39]。Couttas 等 和Katsel 等[37,40]发 现AD 发 生 后大脑表现出 S1P 裂解酶 SGPL1 和 S1P 代谢磷酸酶表达上调,从而下调S1P。但随着对S1P 了解的不断增加,人们发现S1P 在某些特定情况下的上调可能起到相反的效果。例如,Dominguez 的研究发现,SphK2 在细胞质和细胞核内的平衡被打破后,核内S1P 增多可能导致了Aβ 蛋白的沉积[41]。除此之外,Zhong 等[42]一项研究指出,Aβ 激活了Spns2,将 S1P 转运出细胞,导致 S1P 与 S1PR1 结合,S1P与 S1P1R 的结合后通过NF-κB 依赖性机制诱导小胶质细胞分泌促炎细胞因子,从而使小鼠的认知功能下降。这些证据表明S1P 通过多种机制参与了AD 发生、发展的过程,但其在AD 发生过程中主要发挥抑制神经元凋亡还是促进神经炎症的作用仍然需要进一步讨论,在哪些情况下可以起到保护作用尚不得而知。
2.2 S1P 信号传导对PD 的影响
PD 是仅次于AD 的第二大常见和严重的神经退行性疾病,目前临床上的治疗效果并不理想[43,44]。随着对PD 研究的不断深入,人们发现引起PD 发生的病理机制主要包括线粒体功能障碍、氧化应激增加、炎症、突触核蛋白聚集和神经元凋亡[45]。S1P 作为鞘脂代谢途径的主要产物,调控其产生的关键酶SphK 已经被证实在PD 氧化应激和神经元凋亡等过程发挥重要作用[46]。此外,Yousefi-Ahmadipour等在对S1P 的研究中发现线粒体内存在神经酰胺代谢途径,S1P 降低引起的细胞凋亡与线粒体功能改变有关[47]。最近的一项研究表明,PD 患者的S1P 水平低于正常健康人群,且在患有 PD 的个体中,S1P 水平的下降与运动功能降低和运动衰退加快密切相关[48]。在1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的帕金森小鼠模型中发现SphK1、SphK2 的表达降低[49,50]。这些研究都提示S1P 通过多种途径参与了PD 的发生与发展。最近的一篇综述指出,PD 的相关研究人员们认为脂质代谢研究正在改变PD 的传统治疗模式,通过改变S1P 相关受体的表达或通过对S1P 相关的关键酶的调控或许能够为PD 的治疗提供新的解决方案[51]。
2.3 S1P 信号传导对HD 的影响
HD 是一种罕见的显性遗传疾病,其特征是进行性的纹状体和皮质退化,同时伴有一定程度的运动、认知和行为障碍[52]。近几年来许多证据表明,脂质(包括胆固醇、脂肪酸和磷脂)的体内失衡可能是导致 HD 的发病机制[53,54]。鞘脂代谢途径作为脂质代谢的重要代谢途径之一,也已经被证实与HD的发生密切相关。Di Pardo 的研究发现在HD R6/2小鼠模型的纹状体中,SphK1 的表达下调,SphK2 的表达上调,S1P 水平降低。而在HD 患者的纹状体中SphK2 表 达 正 常[55]。Pirhaji 等[56]发 现THI 可 以通过抑制S1P 裂解酶1(sphingosine phosphate lyase 1,SGPL1)来提高HD 神经元的存活率,并抑制组蛋白去乙酰化酶的活性。Moruno 等[57]发现在亨廷顿病的神经元模型中,抑制 S1P 裂解酶可保护神经元免受突变亨廷顿蛋白诱导的神经毒性。这些证据都表明,通过激活SphK1 或抑制SGPL1 等方式来提高S1P 的水平可能在HD 的治疗中发挥着有利的作用。
2.4 S1P 信号传导对MS 的影响
MS 是一种T 细胞介导的中枢神经系统自身免疫性疾病,可能会导致年轻人出现永久性残疾,通常是由遗传易感性和环境因素之间的相互作用所引 起[58,59]。有 研 究 发 现,中 枢 神 经 系 统 中 的S1P 信号介导了星形胶质细胞增生和脱髓鞘等MS 的病理过程[60]。此外,S1P-S1P 受体信号系统的阻断导致循环淋巴细胞显着减少,因此功能性拮抗S1P 受体的药物可以通过降低循环中的淋巴细胞水平减轻MS 的发展[61]。由于S1PRs 在MS 发生过程中的作用较为明确,因此S1P 受体调节剂(芬戈莫德、辛波莫德、奥扎尼莫德和波尼莫德)目前已在部分国家被 批 准 用 于MS 的 治 疗[62]。早 在2008 年 就 有 研 究发现口服鞘氨醇类似物 FTY720 可有效降低MS 的疾病活动,且并未出现较强烈的不良反应[63]。
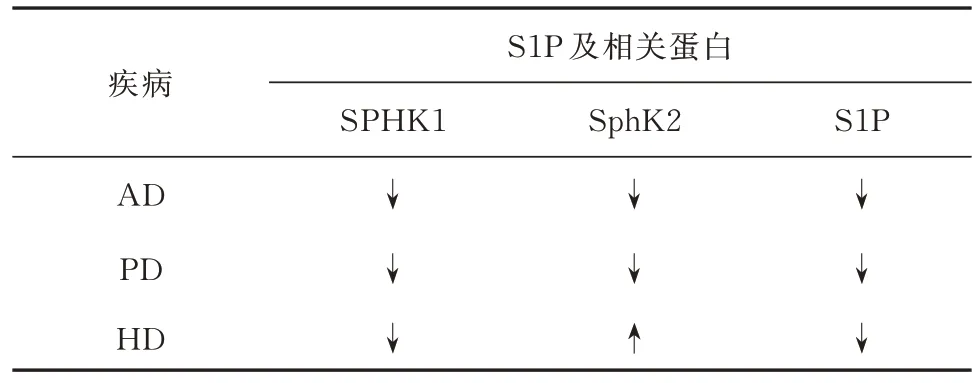
表1 部分神经退行性疾病S1P 及其相关蛋白变化情况Tab 1 Changes in S1P and its related proteins in some neurodegenerative diseases
3 1-磷酸鞘氨醇在中枢神经系统缺血损伤中的研究
中风作为全球第二大致死致残疾病,在全球范围内产生了巨大的经济负担,其中87%的中风是缺血性的[64,65]。目前对于缺血性脑卒中的治疗大多依靠急性期的溶栓和机械再通,这使得部分缺血性脑卒中患者常因未得到有效治疗增加致死致残风险[66]。因此,寻求对缺血性脑卒中更为有效的治疗方式一直是近年来的研究热点。
近年来大量研究表明S1P 传导通路在缺血性脑卒中的治疗中发挥了一定的作用,其通过多种机制改善了缺血性脑卒中的发展[67,68]。同时也有研究发现,血清S1P 水平的与脑缺血患者的严重程度密切相关,S1P 水平较低的患者出现了更多的不良事件[69]。此外,Liu 等[70]在对缺血性和出血性脑卒中患者血清S1P 的检测分析中发现,血清 S1P 降低与早期急性缺血性卒中密切相关,而出血性卒中患者与S1P 水平无明显联系。S1P 对缺血性脑卒中的治疗机制主要包括维持内皮功能、调节血脑屏障(blood brain barrier ,BBB)和促进神经修复[71]。例如,Iwasawa 等[72]发现在急性缺血性卒中小鼠模型中, 选择性激动S1PR1 通过内皮一氧化氮合酶eNOS 的磷酸化增强软脑膜侧支循环,促进缺血后血管生成,增强血脑屏障完整性,从而减少梗死体积。Brunkhorst 等[73]观察到在S1P 类似物在急性缺血性脑卒中模型治疗中反应性星形胶质细胞增生减少、突触可塑性的改变和神经营养因子VEGFα表达的上调。这些证据都表明S1P 传导通路在缺血性脑卒中的治疗中发挥了一定的作用。值得注意的是,由于在中风后的某些阶段,炎症既有害也有益,有研究认为S1P 增强了小胶质细胞中促炎因子的释放,从而在一定程度上加重缺血性脑卒中的损 伤[74,75]。 因 此S1P 在 缺 血 性 脑 卒 中 的 作 用 还 需要进一步探索,其在缺血性脑卒中精神疾病后遗症中的作用也尚未阐明。
4 前景与展望
随着对S1P 在中枢神经系统疾病中的研究不断深入,人们发现S1P 在不同神经系统疾病中的作用并不相同,脑内S1P 水平的升高有些时候可能加快了疾病的发展。这种情况的发生可能因为不同神经细胞上S1P 受体表达的种类有关,从而在疾病中产生了截然不同的效果。这种“双刃剑”的特性使得S1P 在神经系统疾病中的作用需要进一步探索。中枢神经系统中的其他疾病,如癫痫、脑肿瘤等也与S1P 所在的鞘脂代谢通路存在一定的相关性[76,77]。由于S1P 既有抑制神经元凋亡、促进神经元存活的作用,又有促进胶质细胞分泌促炎因子的作用,使得其在癫痫中扮演的角色一直尚未阐明,鞘脂代谢在癫痫中的研究也相对较少。因此,深入了解S1P 相关信号通路及其调控的关键酶对于清楚地理解中枢神经系统疾病至关重要,阐明其在不同疾病和细胞中的作用可以为中枢神经系统疾病的治疗提供理论依据和技术支撑。



