周艳,曹顶国
(山东省农业科学院家禽研究所,山东省家禽育种工程技术研究中心,山东济南250023)
鸡miR NA的研究进展*
周艳,曹顶国**
(山东省农业科学院家禽研究所,山东省家禽育种工程技术研究中心,山东济南250023)
miRNA(microRNA)是一类非编码的、长度约为21~26nt的单链小分子RNA。miRNA广泛存在于真核生物中,序列特异、高度保守。近来研究发现,miRNA广泛参与有机体各个生物学过程,本文就miRNA的发现、作用机制以及在鸡生长发育、生殖以及疫病中的研究进展进行综述。
1 miRNA发现
1993年,VictorAmbros,ColleaguesRosalind Lee和Rhonda Feinbaum首次在线虫中发现lin-4,其产生2个小RNA转录本。一个转录本长度约22nt,另外一个约61nt。通过与Lin-14基因3' UTR的互补序列结合从而调控lin-14的表达[1-2]。Reinhart BJ.等(2000)在线虫中发现let-7编码21核苷酸RNA,并且在lin-14、lin-28、lin-41、lin-42 and daf-12基因3'UTR有互补元件,同lin-4一样对线虫发育具有时空调节作用[3]。随后Lagos-Quintana等[4]Lau等[5]、Lee and Ambros[6]于2001年分别发表了在果蝇、人和蠕虫中发现的大约20个、30个和60个大量表达的、类似lin-4和let-7长度的小RNAs,称之为microRNA(miRNA)。
现代分子技术尤其是高通量测序技术的出现以及生物信息学的发展,为miRNA的研究提供了前所未有的平台,大量的成熟miRNAs和前体小RNA被鉴定出来。2014年6月,miRBase数据库正式发布了21.0版本,包含223个物种的35828条成熟miRNA信息。与20.0版本相比更新了大量的数据,miRNAs发夹前体序列新增4196条,成熟miRNAs新增5441条,包括17个物种的第一个miRNAs。169条发夹前体序列和353条成熟序列更新名称。72条错误注释和重复序列被删除。其中鸡[Gallus gallus]发夹前体miRNAs序列达740条,成熟miRNAs序列994条,部分物种的miRNA数见表1。
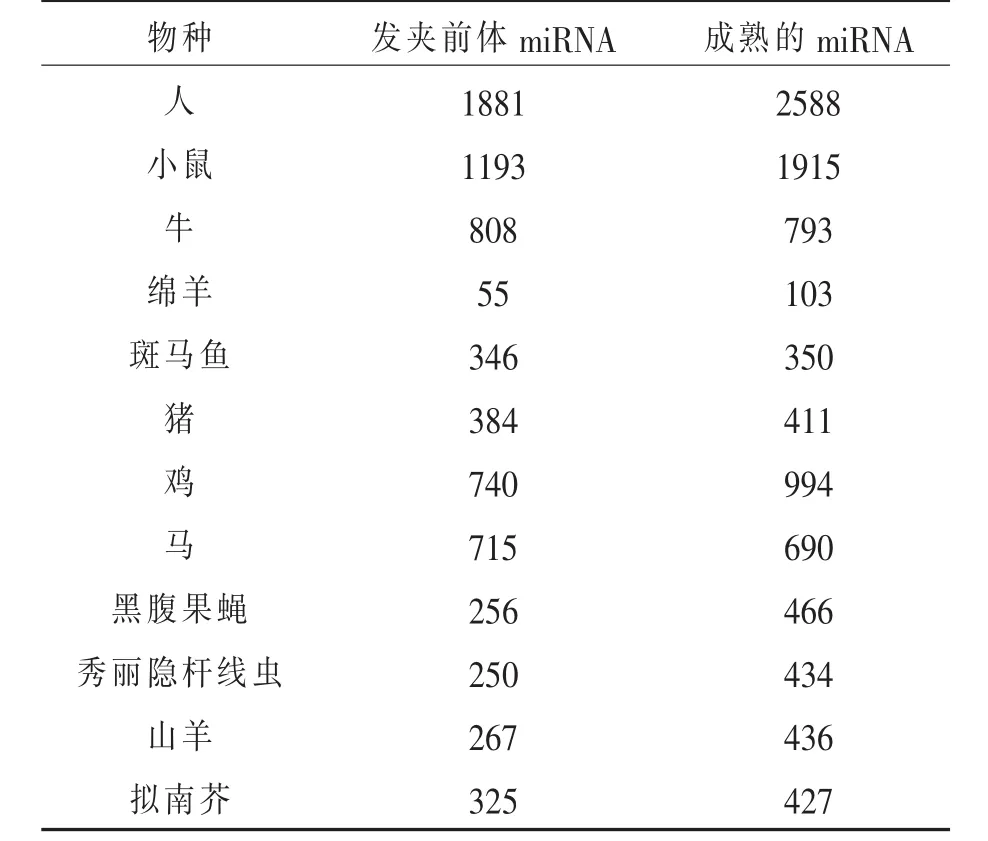
表1 部分物种的miRNA种类数
2 miRNA的特征
miRNA一般具有以下几个特征:①长度通常在21~26nt;②是内源性、非编码的小RNA分子,不具有开放阅读框;③成熟miRNA的序列在邻近物种甚至不同物种间具有高度进化保守性[4,7];④广泛存在于真核生物中,表达具有严格的组织特异性和时空性[8-9];⑤成熟miRNA都是由长度为60~80nt、具有茎环结构的前体经过Dicer酶剪切加工而来[10-11]。
3 miRNA的作用机制及功能
miRNA通过与靶基因3'UTR上存在的不完全或者完全互补位点结合来抑制靶基因的翻译或降解靶mRNA[12-13]。近年来研究发现在靶基因的5'端或者编码区也存在miRNA的结合位点,而且miRNA对靶基因的作用不仅限于翻译抑制和降解,在某些情况下可能对靶基因的翻译和转录起正调控作用。已有研究表明miRNA主要与细胞增殖[14]、凋亡[15-16]、神经发育[17]、造血过程[18-19],以及与人类的某些疾病如癌症[20-21]、心血管病[22-23]等相关。
4 鸡miRNA的相关研究
作为重要调控因子,miRNA在家禽中的功能研究也成为热点,已有研究表明其在鸡生长发育、生殖、疫病等重要生物学过程均发挥重要作用。
4.1 miRNA与鸡生长发育miRNA广泛参与鸡胚早期生长、发育、细胞增殖、分化等一系列生命过程。2006年,Darnell等采用高通量原位杂交技术发现在鸡胚器官形成过程中有部分miRNAs表达快速上调[24]。2008年,Glazov等[25]和Hicks等[26]均构建了鸡胚不同发育时间段的miRNAs文库,分别新发现了449个和14个新的miRNAs。除了在鸡胚生长中发挥作用外,Hicks等(2009)进一步研究了miRNAs在鸡免疫器官形成中的作用,证实miRNAs与法氏囊和淋巴细胞发育分化有关[27]。此外,miRNAs被发现在鸡骨骼肌、胸肌生长和脂肪沉积中均发挥重要的调控作用。Li等(2011)研究了蛋鸡和肉鸡骨骼肌中miRNAs的表达情况,发现了17个miRNAs在蛋鸡和肉鸡的骨骼肌中差异表达,这些miRNAs的部分靶基因与肌肉形成有关[28]。Lin等(2012)年比较了矮小型鸡和正常鸡的骨骼肌中的miRNAs表达,发现miR-1623,miR-181b,let-7b和miR-128的表达量存在差异,进一步研究发现let-7b通过与生长激素受体基因(GHR)的3'端结合,调控GHR的表达。细胞因子信号3基因(SOCS3)通过let-7b介导GHR的表达,对骨骼肌生长和脂肪沉积发挥重要的调控作用[29]。Ouyang H等(2015)比较了隐性白洛克鸡和杏花鸡胸肌中的miRNAs表达,共发现921个miRNAs、miR-34c、miR-223、miR-146b-3p、miR-21和miR-205a被认为是调控鸡生长的功能miRNAs[30]。
4.2 miRNA与鸡性别分化及卵巢卵泡发育近来研究表明,多个miRNAs参与鸡早期性腺发育和性别分化及卵巢卵泡发育等生殖相关的生物学过程。Bannister等(2009)采用基因芯片研究发现MIR202*在鸡胚睾丸发育过程中表达上调[31]。随后其采用雌激素诱导的性别转换模型再次表明,MIR202*表达下调,则导致睾丸相关基因DMRT1和SOX9表达下调,卵巢相关基因FOXL2和CYP19A1(aromatase)表达上调。相反,MIR202*表达上调,则导致睾丸相关基因DMRT1和SOX9表达上调,卵巢相关基因FOXL2和CYP19A1 (aromatase)表达下调,证明MIR202*表达上调与鸡胚性腺分化和睾丸发育过程一致[32]。此外ggamiR-363[33]和gga-miR-551b和gga-miR-1599[34]都被发现可能涉及早期鸡胚性腺发育过程。Cutting等(2012)也发现miR-101在公鸡中高表达,但是在性腺分化后的母鸡中表达显着增加[35]。此外,多个miRNAs被鉴定参与鸡卵巢卵泡发育,Kang等(2013)采用Illumina/Solexa测序技术对鸡性成熟前后卵巢中的miRNAs进行了鉴定,获得了203个在鸡卵巢表达的miRNAs,其中有93个在性成熟前后的卵巢中表现出显着差异表达[36]。本课题组采用Illumina Solexa测序方法分析高、低汶上芦花鸡个体卵巢组织中差异表达的miRNAs。以低产鸡卵巢为对照,在高产鸡卵巢中共筛选到72个差异表达miRNAs,其中13个表达上调,59个表达下调[37]。
4.3 miRNA与鸡疫病发生作为功能广泛的调控因子,miRNAs在鸡马立克氏病、禽流感、支原体、法氏囊等疾病发生过程中同样发挥重要的调控作用。Burnside等(2008)采用深度测序技术分别检测了马立克氏病毒(MDV)感染的和未感染的鸡胚胎成纤维细胞(CEF)的miRNAs表达量,结果表明let-7和miR-199a-1等miRNAs在肿瘤细胞中低表达[38]。Lian等(2012)发现在MDV感染的肿瘤脾脏和肝脏淋巴瘤中,gga-miR-181a、gga-miR-26a、gga-miR-221、gga-miR-222、gga-miR-199*和gga-miR-140*表达下调,gga-miR-146c表达上调[39]。2015年,Li等证实gga-miR-26a靶向NEK6抑制MDV细胞增殖[40]。随后gga-miR-130a[41]和gga-miR-219b[42]分别被发现通过靶基因抑制MDV细胞增殖。
Wang等(2012)研究了禽流感病毒(AIV)感染的肉鸡肺部的miRNAs表达情况,发现108个在AIV感染的肺部高表达,而只有13个在对照中高表达,该结果与蛋鸡中的趋势相反,因此蛋鸡和肉鸡中关于AIV感染的宿主免疫应答调控机制可能不同。多重比较分析结果表明,gga-miR-34a、122-1、122-2、146a、155、206、1719、1594和1599是肉鸡肺部AIV感染的宿主免疫应答调控的重要候选miRNAs[43]。Peng等2015研究了感染和非感染H9N2鸡胚成纤维细胞中的miRNAs,结果发现了48个差异表达miRNAs,其中gga-miR-146c、gga-miR-181a、gga-miR-181b、gga-miR-30b、gga-miR-30c、gga-miR-30e和gga-miR-455被发现在其他类型的禽流感病毒感染的细胞中也差异表达[44]。在A549细胞中,miR-584-5p和miR-1249被发现下调PB2的表达从而抑制H5N1和H1N1的复制[45]。Zhao等(2017)发现gga-miR-99a通过靶向SMARCA5在鸡支原体感染中发挥重要作用[46]。欧阳伟等(2012)研究发现,在传染性法氏囊病病毒(IBDV)弱毒感染的CEF中,有17个表达上调,17个表达下调,在IBDV强毒感染鸡法氏囊组织细胞中,30个表达上调,18个表达下调。结果表明,IBDV感染可导致内源性miRNAs表达发生变化,从而调控细胞内多种代谢和信号传导途径发生异常,引起细胞及组织器官发生病理学变化[47]。ggamiR-2127也被发现通过下调鸡p53调控IBDV天然免疫反应[48]。
5 展望
鸡miRNA研究的广泛开展使人们对其功能和发挥的作用有了更多的认识和理解。但是目前鉴定的miRNA大多局限于与某种生物学过程相关或者单一靶基因的鉴定,而一个miRNA可同时调控上百个基因,一个基因也可以同时受到多个miRNAs的调控,因此单一调控关系鉴定无法准确阐述其对生物学过程的调控机制。只有全面深入的解析miRNA多元化的调控网络,才能更好的阐明其在鸡重要经济性状中发挥的调控作用,而这也将是下一步的研究重点。
[1]Lee RC,Feinbaum RL,Ambros V.The C.Elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell.1993, 75:843-854.
[2]Wightman,B,Ha,I,andRuvkun,G.Posttranscriptional regulationoftheheterochronicgenelin-14by lin-4mediatestemporalpatternformationinC. elegans.Cell.1993;75:855-862.
[3]Reinhart BJ,Slack FJ,Basson M,et al.The 21-nucleotidelet-7RNAregulatesdevelopmental timing in Caenorhabditis elegans[J].Nature.2000, 403(6772):901-906.
[4]Lagos-QuintanaM,RauhutR,LendeckelW,etal. Identificationofnovelgenescodingforsmall expressed RNAs[J].Science.2001,294:853-858.
[5]LauNC,LimLP,WeinsteinEG,etal.Anabundant class of tiny RNAs with probable regulatory roles inCaenorhabditiselegans[J].Science.2001,294: 858-862.
[6]Lee RC,and Ambros V.An extensive class of small RNAs in Caenorhabditis elegans[J].Science.2001, 294:862-864.
[7]Grosshans H and Slack FJ.Micro-RNAs small is plentiful[J].J Cell Biol.2002,156(1):17-22.
[8]Lagos-Quintana M,Rauhut R,Yalcin A,et al.. Identificationoftissue-specificmicroRNAsfrom mouse[C].Curr Biol.2002,12(9):735-739.
[9]RougvieAE.Controlofdevelopmentaltimingin animals[J].Nat.Rev.Genet.2001,2:690-701.
[10]Grishok A,Pasquinelli AE,Conte D,et al..Genes andmechanismsrelatedtoRNAinterference regulateexpressionofthesmalltemporalRNAsthat control C.elegans developmental timing[J]. Cell.2001,106:23-34.
[11]Hutvagner G,McLachlan J,Pasquinelli AE,et al.A cellular function for the RNA-interference enzyme Dicerinthematurationofthelet-7small temporal RNA[J].Science.2001,293:834-838.
[12]Ambros,V.MicroRNAs:tinyregulatorswithgreat poten-tial[J].Cell.2001,107:823-826.
[13]Moss EG.MicroRNAs:hidden in the genome[C]. Curr.Biol..2002,12:R138-R140.
[14]YinR,ZhangS,WuY,etal.MicroRNA-145 suppresseslungadenocarcinoma-initiatingcell proliferationbytargetingOCT4[J].OncolRep. 2011,25(6):1747-54.
[15]冯洪涛,李红普.miRNA-29a对平滑肌细胞增殖凋亡的影响[J].重庆医学,2015(35):4925-4928.
[16]张兵兵,侯汝涛,李磊,等.miRNA-20a作为CHOK1细胞抗凋亡调控靶标的研究[J].中国科技论文,2015,10(6):740-744.
[17]Mouradian MM.MicroRNAs in Parkinson's disease [J].Neurobiol Dis.2012,46(2):279-284.
[18]Dore LC,Amigo JD,Dos Santos CO,et al.A GATA-1-regulatedmicroRNAlocusessentialfor erythropoiesis[C].Proc Natl Acad Sci USA.2008, 105(9):3333-3338.
[19]Zhu Y,Wang DS,Wang F,et al..A comprehensive analysisofGATA-1-regulatedmiRNAsreveals miR-23atobeapositivemodulatorof erythropoiesis[J].Nucl.AcidsRes.2013,41(7): 4129-4143.
[20]Zhang JG,Guo JF,Liu DL,et al.MicroRNA-101 exerts tumor-suppressivefunctionsinnon-smallcell lung cancer through directly targeting enhancer of zestehomolog2[J].JThoracOncol.2011,6(4): 671-678.
[21]Wang R,Wang ZX,Yang JS,et al.MicroRNA-451 functions as a tumor suppressor in human nonsmallcelllungcancerbytargetingras-related protein14(RAB14)[J].Oncogene.2011,30(23): 2644-58.
[22]李建橡,岳桂华,马晓聪,等.miRNA在高血压发生发展和治疗中的作用及与中医药的相关性[J].辽宁中医杂志,2017(1):207-210.
[23]曾萍,杨简.miRNA在冠心病检测中的研究新进展[J],中国老年学,2017,37(1):233-235.
[24]DarnellDK,KaurS,StanislawS,etal.MicroRNA expressionduring chick embryo development[J]. Dev Dyn.2006,235(11):3156-3165.
[25]Glazov EA.,Cottee PA.,Barris WC.,et al.A microRNA catalogofthede-velopingchickenembryo identifiedbyadeepsequencingapproach[J]. Genome Research.2008,18(6):957-964.
[26]Hicks JA.,Tembhurne P,and Liu HC..MicroRNA ex-pressioninchickenembryos[J].Poultry Science.2008,87(11):2335-2343.
[27]Hicks JA,Tembhurne PA,Liu HC.Identification of microRNA in the developing chick immune organs [J].Immunogenetics.2009,61(3):231-240.
[28]Li T,Wu R,Zhang Y,et al.A systematic analysis of theskeletalmusclemiRNAtranscriptomeof chickenvarietieswithdivergentskeletalmuscle growth identifies novel miRNAs and differentially expressedmiRNAs[J].BMCGenomics.2011,12: 186.
[29]LinS,LiH,MuH,etal.Let-7bregulatesthe expressionof the growth hormone receptor gene indeletion-typedwarfchickens[J].BMC Genomics.2012,13:306.
[30]Ouyang H,He X,Li G,Xu H,Jia X,Nie Q,Zhang X. Deep SequencingAnalysisofmiRNAExpression inBreastMuscleofFast-GrowingandSlow-GrowingBroilers.IntJMolSci.2015,16(7): 16242-1662.
[31]Bannister SC,Tizard ML,Doran TJ,et al.Sexually dimorphicmicroRNAexpressionduringchicken embryonic gonadaldevelopment[J].BiolReprod. 2009,81(1):165-176.
[32]BannisterSC,SmithCA,RoeszlerKN,etal. Manipulation of estrogen synthesis alters MIR202 expressioninembryonicchickengonads[J].Biol Reprod.2011,85(1):22-30.
([33-48]参考文献省略,如有需要请联系本编辑部。)
Q753
A
1673-1085(2017)08-0050-04
2017-07-19
山东省自然基金重点项目(ZR2014CZ003);山东省自然基金(ZR2014YL024);山东省农科院青年基金(2014QNM14)。
周艳(1979-),女,汉,山东新泰人,副研究员,博士,主要研究方向:家禽遗传育种。
**通讯作者:曹顶国(1973-),男,汉,山东嘉祥人,研究员,主要研究方向:家禽遗传育种,Email:cdgjqs@163.com。



