邵明辰,王友令
(1.山东鲁南牧工商有限公司,山东 滕州 277500;2.山东省农业科学院家禽研究所,山东 济南 250100)
禽流感(AI)由A型禽流感病毒引发的高度接触性传染病,它不但能造成养禽业的巨大经济损失,还对人类公共卫生安全构成威胁[1]。禽类感染禽流感病毒(Avian Influenza Virus,AIV)后,症状可表现为非显性感染、亚临诊感染,或轻度呼吸道疾病,产蛋量下降直至急性全身致死性疾病等多种形式。禽流感病毒属于正粘病毒科、流感病毒属的A型流感病毒,为分节段的、单股、负链 RNA病毒,每个RNA片段都是由核蛋白包被形成RNPs复合体,RNPs是由基质蛋白(M)构成完整的膜包裹[2]。虽然家禽感染低致病性AIV的发病率、死亡率低,但可引起产蛋量下降,造成免疫抑制,造成养禽业巨大的经济损失。
H9N2禽流感病毒呈世界性分布,其按地区可分为北美和欧亚两个种系[3]。我国于1994年首次公开报道,但未波及全国[4]。HA基因是A型流感病毒致病性的主要影响因子,主要通过HA识别宿主细胞的特异性受体,从而吸附于细胞表面,以吞噬小体的形式进入细胞质,膜融合后释放病毒的RNP[5]。HA蛋白识别受体结合位点是感染的第一步,也是比较关键的一步。HA蛋白能识别两种类型的受体,分别为α-2,3-半乳糖和α-2,6-半乳糖连接的唾液酸[6]。
为了解2016年山东地区H9N2亚型禽流感病毒HA基因的变异情况及探讨其是否发生了重组,特选取所分离的10个H9N2亚型禽流感病毒分离株,对其HA基因进行测序,分析其遗传演化规律,为山东地区H9N2禽流感的防控提供理论依据。
1 材料和方法
1.1 毒株 10株H9N2亚型禽流感病毒流行株由山东省农业科学院家禽研究所按照参考文献中的方法进行分离、鉴定及纯化[1]。其毒株代表号依次为 A-CK-SD-XT31-2016-H9N2、A-CK-SD-XT33-2016-H9N2、A-CK-SD-XT34-2016-H9N2、A-CKSD-XT35-2016-H9N2、A-CK-SD-XT39-2016-H9N2、A-CK-SD-XT43-2016-H9N2、A-CK-SDXT44-2016-H9N2、A-CK-SD-XT46-2016-H9N2、ACK-SD-MHS3-2016-H9N2、A-CK-SD-MHS5-2016-H9N2。
1.2 主要试剂 SPF鸡和鸡胚均由山东省农业科学院家禽研究所SPF鸡研究中心提供。Trizol、DNA回收试剂盒、质粒提取试剂盒、pMD18-T Vector、限制性内切酶和一步法RT-PCR试剂盒均购自大连宝生物有限公司。
1.3 引物合成 参考GenBank上已发表的H9N2亚型禽流感病毒HA基因序列,利用Oligo6.0软件设计了一对引物,由上海生工生物工程有限公司合成,用于扩增HA基因全长序列。
H9上游引物(H9F)∶
5'-CACCATGGAAACAATATATCACTAMT-3';
H9下游引物(H9R)∶
5'-CTATATACAAATGTTGCRYCT-3'。
引物由宝生物工程(大连)有限公司合成。预期扩增的HA基因大小为1687bp,编码560个氨基酸。
1.4 扩增 病毒RNA的提取及HA基因的RTPCR扩增按照Trizol试剂盒说明书提取病毒RNA,取适量DEPC处理的超纯水溶解RNA。RTPCR采用大连宝生物工程有限公司的一步法提取试剂盒说明书进行操作。
1.5 PCR产物的克隆与序列分析 将PCR产物克隆测序,拼接所得HA基因序列,并结合GenBank上已发表的8株H9N2禽流感病毒株的HA基因序列(毒株具体信息及登录号详见表1),用MEGA5.0分别对其进行遗传演化分析,绘制系统进化发育树,从而对上述毒株的HA、NA基因分子遗传变异情况进行分析。
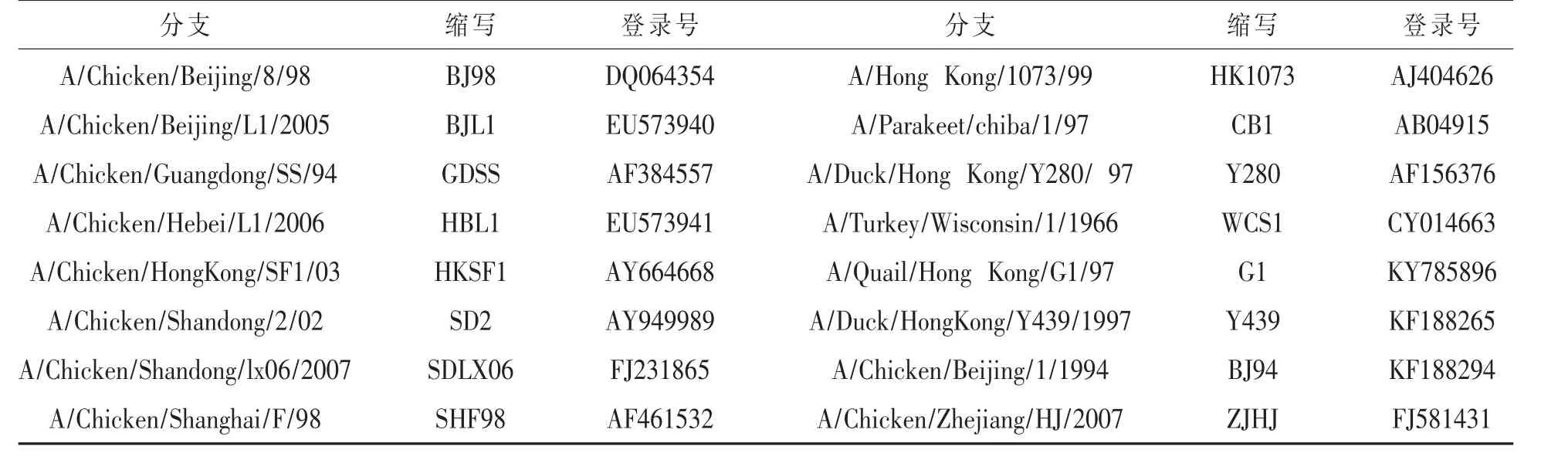
表1 下载毒株的基本信息及登录号
2 结果与分析
2.1 HA基因遗传分析 用 MEGA5.0对参考序列和本实验所得10个H9N2病毒分离株HA基因进行遗传演化分析,得到的进化树见图1。
10株H9N2亚型AIV的HA基因的cDNA全序列,全长1742bp,ORF全长为1683个核苷酸,位置为34~1716位核苷酸,编码560个氨基酸。将10个分离株与GenBank上发表的参考毒株进行核苷酸序列和氨基酸序列的同源性比较,10个分离株与BJ94参考毒株HA基因的核苷酸之间的同源性为89.1%~91.3%,氨基酸之间的同源性为90.0%~93.4%;与 A/chicken/Zhejiang/HJ/2007(G57分支)参考毒株HA基因的核苷酸之间的同源性为89.1%~91.3%,氨基酸之间的同源性为93.6%~97.0%;而分离株之间的HA基因核苷酸同源性为94.1%~99.8%,氨基酸序列之间的同源性为94.3%~100%。
所有分离株的HA裂解位点均为RSSR↓GLF,有 6~8个潜在的糖基化位点(N-X-T/S,X 为除 P外的氨基酸),XT39毒株在 218~220位和313~315位出现糖基化位点双缺失,XT205和XT208毒株在218~220位糖基化位点缺失,XT33和MHS3毒株在551~553位潜在糖基化位点缺失。10株分离株构成HA唾液酸受体结合位点的氨基酸在191位非常保守,为N(天冬酰胺),与经典的禽流感国内分离株一致。10株分离株中有3株在198位上变异为A (丙氨酸),6株变异为T(苏氨酸),1株变异为M(甲硫氨酸)三种形式。10株分离毒在234位受体结合位点均为L(亮氨酸),具有与哺乳动物唾液酸a,2-6受体结合的特征,该类毒株的流行在公共卫生上应值得重视。从进化树分析可知,10个分离株同属于欧亚分支中的A/Chicken/Beijing/1/1994(A/Duck/Hong-Kong/Y280/97)亚群,与近年在中国的鸡群中流行的由A/chicken/Zhejiang/HJ/2007为代表的新的基因型(G57分支)遗传关系最近[7],推测是由其进化演变而来。
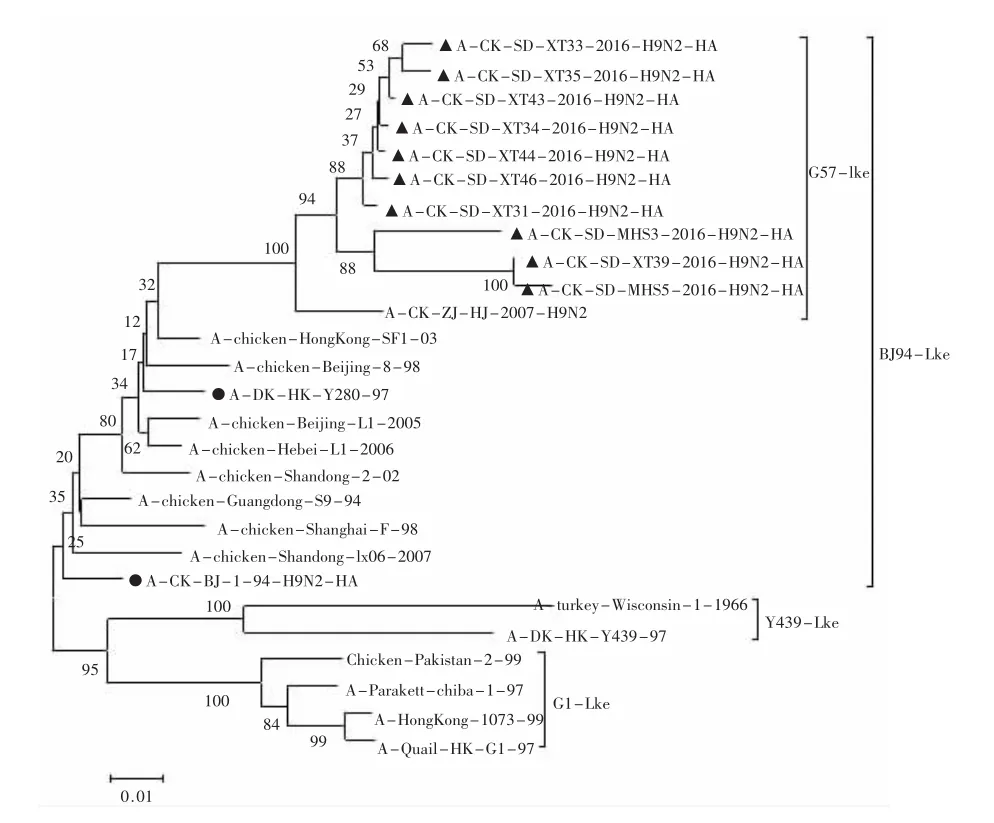
图1 10个H9N2病毒分离株HA基因进行遗传演化分析进化树
3 讨论
HA基因是A型流感病毒致病性的主要影响因子。HA裂解位点氨基酸序列是决定禽流感病毒致病性和毒力强弱的关键因素之一。HA蛋白识别受体结合位点是感染的第一步,也是比较关键的一步。本研究中10个毒株HA基因裂解位点氨基酸序列为RSSR↓GLF,不存在多个连续碱性氨基酸插入,具有低致病性病毒分子特征。Steinhauer[8]发现流感病毒表面血凝素HA蛋白上第183、190和226位氨基酸是关键的受体结合位点,与病毒的受体结合特性和宿主特性相关。本研究中10个毒株HA受体结合位点的第149、198、234位氨基酸也存在变异。10个毒株有6~8个潜在的糖基化位点,10株分离株构成HA唾液酸受体结合位点的氨基酸在191位非常保守,为N(天冬酰胺),与经典的禽流感国内分离株一致。10株分离株中有3株在198位上变异为A (丙氨酸),6株变异为T(苏氨酸),1株变异为M(甲硫氨酸)三种形式。另外有9株病毒在313位氨基酸处出现了一个新的潜在的糖基化位点。新增糖基化位点的出现可能改变病毒的抗原性并影响受体结合特性而感染新的宿主。
Sun等[9]对2003~2008年6年间中国北方不同地区的22株禽源和猪源H9N2毒株分析后也发现,同一时期不同地区病毒株之间同源性较高,但较早期病毒均有不同程度的变异和进化。杨婧等[10]对2005年以后的H9N2HA和NA基因同源性关系研究发现,H9N2HA和NA基因的变异情况与地域无相关性,与时间呈一定的相关性。由此表明,H9N2发生变异与时间呈现一定的相关性,与地域无关。本研究中,从进化树分析可知,10株H9N2分离毒HA基因呈现出与分离时间相近的同源性关系。
H9N2禽流感病毒在亚洲普遍存在,由于较低的致病性,对人类健康产生的威胁也较低,致使公众的警惕性不高[11]。Butt等[12]发现2003年香港感染人类的H9N2禽流感毒株A/Human/Hong Kong/2108/03其HA蛋白的226位即为亮氨酸(L),而从家禽体内分离到的H9N2禽流感毒株A/Gf/Hong Kong/nt184/03其HA蛋白的226位则为谷氨酸(Q)。本研究中,10株H9N2禽流感病毒的226位氨基酸,均为亮氨酸(L),呈现出典型的人流感受体结合特性。由此表明2016年山东地区H9N2具有对哺乳动物的感染性有增高的趋势,易感染人类,有一定的公共卫生危害,因此需要提高对其的重视度。另外还需提防H9N2与其他流感病毒的重组或者抗原漂移现象,以防制造出新流感病毒的风险。已有研究报道证实感染人的H5N2、H10N8、H7N9的6个内部基因均来自H9N2亚型禽流感病毒[13]。综上所述,应该加强重视低致病性的H9N2亚型禽流感病毒,防止其打破原有的种间屏障直接传播给人类和低等哺乳动物,以进一步降低其公共危害。



