齐喜英,翁孝刚
(1.河南五建建设集团有限公司职工医院内分泌科,河南 郑州 450007;2.新乡医学院第三临床学院内分泌科,河南 新乡 453003)
糖尿病(diabetes mellitus,DM)是一种常见慢性病,具有发病率高、病程长、治疗难度大和并发症多等特点,且在DM进展过程中会引发多种急慢性并发症,其中以糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)最为常见,对患者正常生活和工作造成极大影响,甚至危及其生命安全。甲钴胺为内源性维生素B12,对神经元的传导有良好改善作用,但长期使用易引发皮疹、头痛、发热等身体不适[1]。α-硫辛酸能够改善胰岛功能与葡萄糖代谢,减轻应激反应,同时可以在水溶性和非水溶性环境下发挥抗氧化作用,对于治疗DM、肝肾病变等多种慢性病均有显着效果[2]。本研究针对α-硫辛酸对DPN患者神经功能及硝基酪氨酸(NT)、超氧化物歧化酶(SOD)、丙二醛(MDA)水平的影响进行概述,以下为结果报道。
1 资料与方法
1.1 一般资料 回顾性分析河南五建建设集团有限公司职工医院于2018年3月至2020年8月期间收治的84例DPN患者的临床资料,按照治疗方法不同分为单一组(42例)和联合组(42例)。其中单一组患者年龄40~75岁,平均(59.80±5.36)岁;男、女患者分别为24、18例;DM病程2~16年,平均(8.71±2.14)年;DPN病程1~6年,平均(3.12±0.78)年。联合组患者年龄42~77岁,平均(60.32±5.29)岁;男、女患者分别为25、17例;DM 病程2~15年,平均(8.82±2.11)年;DPN病程1~5年,平均(3.14±0.75)年。将两组患者年龄、性别、DM病程、DPN病程等一般资料进行对比,差异无统计学意义(P>0.05),组间具有可比性。诊断标准:参照《美国糖尿病协会关于糖尿病神经病变的诊断和治疗指南》[3]中的相关诊断标准。纳入标准:符合上述诊断标准者;病历资料完整者;无相关药物(甲钴胺、α-硫辛酸等)用药禁忌者等。排除标准:其他疾病所致周围神经病变者;合并全身感染、精神障碍或恶性肿瘤者;哺乳或妊娠期女性等。
1.2 方法 所有患者均接受降糖药物治疗或注射胰岛素控制血糖。在此基础上给予单一组患者甲钴胺注射液(青海晨菲制药有限公司,国药准字H20056628,规格:1 mL∶0.5 mg)治疗,将0.5 mg甲钴胺注射液与100 mL生理盐水混合后静脉滴注,1次/d。联合组患者在单一组的基础上使用α-硫辛酸注射液(德国史达德大药厂,注册证号J20090105,规格:12 mL∶300 mg)治疗,用法:0.6 g α-硫辛酸注射液 + 250 mL生理盐水混合后静脉滴注,12~24 mL/次,1次/d。两组患者均持续治疗4周。
1.3 观察指标 ①比较两组患者治疗前后多伦多临床系统(TCSS)评分[4]、神经病变主觉症状问卷(TSS)评分[5],TCSS评分包括神经症状、神经反射、感觉功能3个部分,共19分;TSS评分包括疼痛、麻木、灼热感和感觉异常共4项,每项0~4分,总分16分。TCSS和TSS评分越高表明症状越严重。②比较两组患者治疗前后氧化应激指标水平,抽取患者清晨空腹状态下的肘部静脉血5 mL,将其放入离心机内操作(3 500 r/min转速,时间7 min)后取血清,用放射免疫沉淀法检测血清NT、SOD、MDA水平。③比较两组患者治疗期间发生(恶心呕吐、腹泻、食欲减退的情况。
1.4 统计学方法 数据采用SPSS 20.0统计软件进行处理,计量资料(TCSS评分、TSS评分以及血清SOD、NT、MDA水平)用(±s)表示,采用t检验;计数资料(不良反应发生率)用[例(%)]表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 TCSS评分、TSS评分 治疗后,两组患者TCSS评分、TSS评分与治疗前比均显着降低,且联合组较单一组显着降低,差异均有统计学意义(均P<0.05),见表1。
表1 两组患者TCSS评分、TSS评分比较(±s,分)
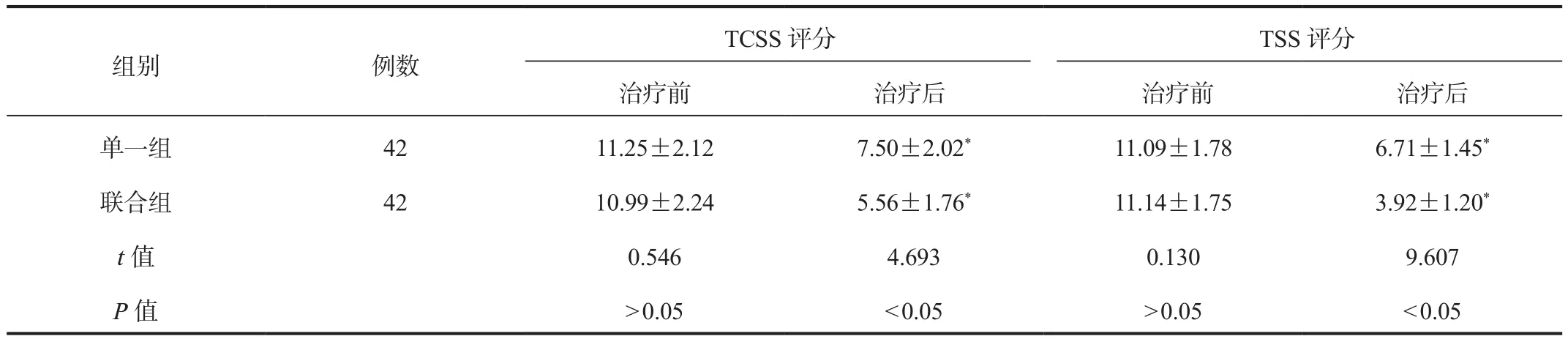
表1 两组患者TCSS评分、TSS评分比较(±s,分)
注:与治疗前比,*P<0.05。TCSS:多伦多临床系统;TSS:神经病变主觉症状问卷。
组别 例数TCSS评分 TSS评分治疗前 治疗后 治疗前 治疗后单一组 42 11.25±2.12 7.50±2.02* 11.09±1.78 6.71±1.45*联合组 42 10.99±2.24 5.56±1.76* 11.14±1.75 3.92±1.20*t值 0.546 4.693 0.130 9.607 P值>0.05<0.05>0.05<0.05
2.2 氧化应激 治疗后,两组患者血清SOD水平与治疗前比均显着升高,且联合组较单一组显着升高;两组患者血清NT、MDA水平与治疗前比均显着降低,且联合组较单一组显着降低,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者氧化应激指标比较(±s)
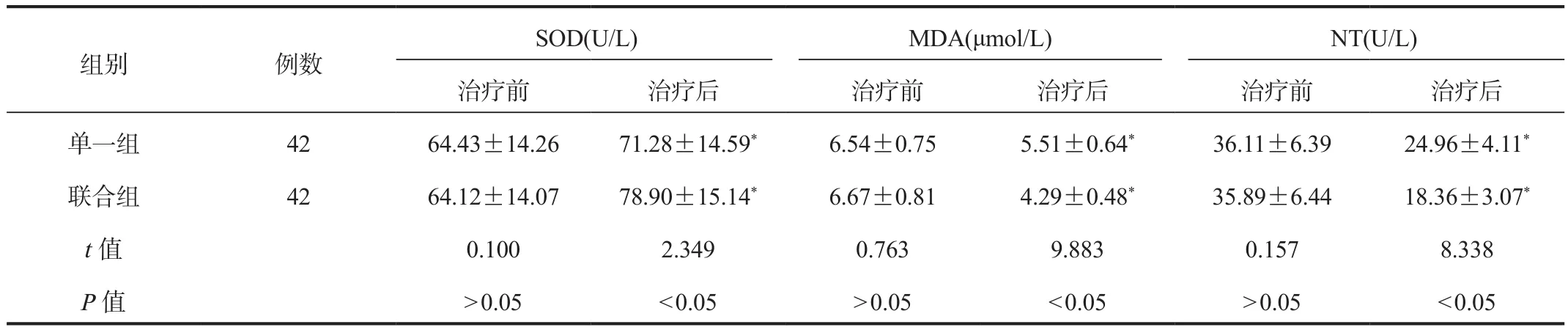
表2 两组患者氧化应激指标比较(±s)
注:与治疗前比,*P<0.05。SOD:超氧化物歧化酶;MDA:丙二醛;NT:硝基酪氨酸。
组别 例数SOD(U/L) MDA(μmol/L) NT(U/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后单一组 42 64.43±14.26 71.28±14.59* 6.54±0.75 5.51±0.64* 36.11±6.39 24.96±4.11*联合组 42 64.12±14.07 78.90±15.14* 6.67±0.81 4.29±0.48* 35.89±6.44 18.36±3.07*t值 0.100 2.349 0.763 9.883 0.157 8.338 P值>0.05<0.05>0.05<0.05>0.05<0.05
2.3 不良反应 对比两组患者用药期间不良反应总发生率,差异无统计学意义(P>0.05),见表3。
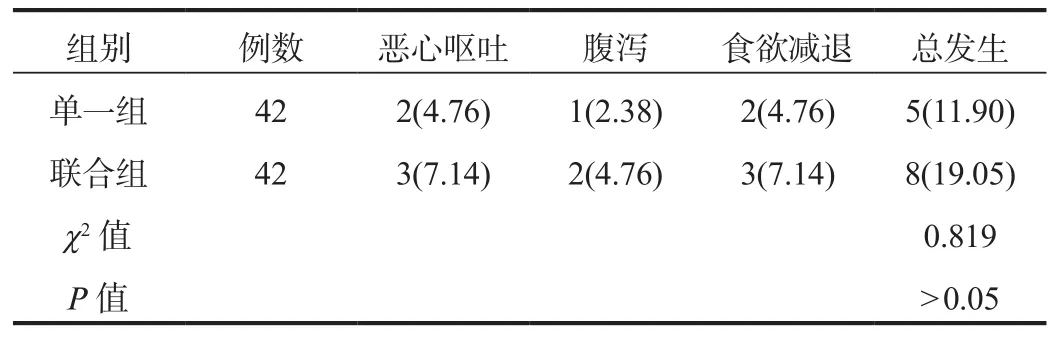
表3 两组患者不良反应发生率比较[例(%)]
3 讨论
DPN是DM最常见的并发症之一,也是引发足部感染和溃疡的主要危险因素之一。DPN的发病机制尚未完全阐明,通常认为该病发生与血糖控制不良、脂质代谢紊乱、氧化应激作用、免疫炎性反应、微血管损害、营养因子缺乏等多种因素有关[6]。甲钴胺能促进髓鞘卵磷脂合成及轴突受损区域再生,进而对受损周围神经发挥修复作用,达到治疗DPN的效果,但偶见皮疹、头痛、发热等不良反应发生[7]。
α-硫辛酸归属于一种代谢性抗氧化剂,其可转换成还原性二氢硫辛酸,促进一氧化氮自由基同类型异构体生成,改善神经细胞线粒体内氧化应激形态,并可通过还原机体抗氧化系统,延长谷胱甘肽、维生素C、辅酶Q等抗氧化剂的作用时间,同时还可促进受损髓鞘恢复,与甲钴胺联合使用能显着提高神经电生理传导速度[8]。在本研究中,相较于单一组,联合组患者治疗后TCSS评分、TSS评分均显着降低;对比两组患者用药期间不良反应总发生率,差异无统计学意义,证实α-硫辛酸联合甲钴胺治疗DPN疗效显着,可有效改善患者神经症状,且不增加不良反应,安全性良好[9]。氧化应激损伤在DPN发病过程中发挥关键性作用,也是诱发DM相关并发症的共同机制。SOD能结合超氧阴离子发挥抗氧化作用,其水平升高提示机体对氧自由基的清除能力增强;MDA是脂质氧化反应的重要产物,能反映机体受氧自由基损伤程度,其水平升高,病情加重;NT为反映机体氧化应激状态的重要标志物,其水平与疾病严重程度呈正相关。α-硫辛酸能增强对周围神经病变的抑制作用,减轻氧化应激损伤,改善血液微循环,避免高血糖所致代谢紊乱进一步恶化,促进周围神经功能恢复[10]。在本研究中,相较于单一组,联合组患者治疗后血清SOD水平显着升高,血清NT、MDA水平显着降低,证实α-硫辛酸联合甲钴胺治疗DPN,能够有效减轻患者机体氧化应激反应。
综上,α-硫辛酸联合甲钴胺治疗DPN疗效显着,可有效改善患者神经功能,缓解机体氧化应激反应,具有良好的临床应用安全性。



