蒋莉萍,王 霞,彭心华,宋适寅,瞿 明
(1.吉安市妇幼保健院病理科;2.井冈山大学医学部;3.吉安市妇幼保健院检验科;4.吉安市中心人民医院病理科;5.吉安市妇幼保健院乳腺外科,江西 吉安 343000)
近年来,乳腺癌已经成为我国女性发病率和死亡率最高的恶性肿瘤性疾病,乳腺癌细胞的转移是导致乳腺癌患者死亡的主要原因之一,一旦发生转移,患者预后较差,5年生存率仅为20%[1]。恶性肿瘤的转移是一个多分子共同参与相互作用的复杂过程,因此对反映乳腺癌细胞具有侵袭、转移潜能的分子生物指标进行检测,有助于乳腺肿瘤的早期筛查、诊断及治疗,动态监测乳腺癌转移情况,并评估乳腺癌患者的预后。胰岛素样生长因子Ⅱ mRNA结合蛋白3 (IMP3)是一个新发现的癌胚mRNA结合蛋白,可与胰岛素样生长因子Ⅱ (IGF-Ⅱ)转录物进行结合。研究发现,IGF-Ⅱ在乳腺癌组织中呈高表达,但关于IGF-Ⅱ的翻译调控因子IMP3在乳腺癌中的表达研究甚少[2];程序性死亡受体配体-1 (PD-L1)是肿瘤免疫逃逸过程中的重要免疫检查点分子,且在多种实体肿瘤组织中呈过表达,且有研究证实,其过表达与三阴性乳腺癌患者术后生存率密切相关[3]。但目前IMP3和PD-L1在乳腺癌发生侵袭和进展中的临床意义尚不明确,因此本研究旨在探究两者在乳腺癌组织中的阳性表达情况,分析其与患者临床病理特征、术后复发的相关性,为临床乳腺癌患者的治疗与预后评估提供依据,现将研究结果详细报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月至2021年3月吉安市妇幼保健院和吉安市中心人民医院收治的102例乳腺浸润性癌患者的临床资料,所有患者均保存有完整的病理切片、石蜡档案及临床资料。年龄32~89岁,平均(47.60±10.09)岁。参照《WHO(2012)乳腺肿瘤组织学分类》[4]中相关乳腺上皮源性肿瘤分类标准进行分类:非特殊类型87例,混合型癌(浸润性导管癌+特殊类型癌)15 例;TNM 分期:TNM Ⅰ~Ⅱ期 76 例,Ⅲ~Ⅳ期 26例;病理组织学分级:Ⅰ级56例、Ⅱ级28例、Ⅲ级18例;淋巴结转移情况:转移50例,未转移52例。诊断标准:所有患者均符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[5]中关于乳腺浸润性癌的诊断标准。纳入标准:符合上述诊断标准者;女性;术前未行新辅助化疗,无任何抗肿瘤治疗史者;所有患者均经病理学检测,并均由高年资的病理医师复核切片确诊;所有患者病理组织标本均经免疫组织化学染色并由高年资的病理医师进行判读评分。排除标准:合并其他恶性肿瘤者;合并全身感染性疾病者;合并心血管疾病或严重肝、肾疾病或其他重大疾病者等。本研究经吉安市妇幼保健院和吉安市中心人民医院医学伦理委员会批准。
1.2 检验方法
1.2.1 免疫组织化学染色 采用SP法免疫组织化学染色检测乳腺癌组织中PD-L1、IMP3表达情况:乳腺癌病理组织标本经4%中性甲醛固定,常规制作石蜡组织切片,进行免疫组织化学染色,所涉一抗:兔抗人IMP3单克隆抗体(克隆号:ZA-0639UM),购自北京中杉金桥生物技术有限公司;兔抗人PD-L1单克隆抗体(克隆号:ZR3),购自基因科技(上海)股份有限公司。将已知的阳性组织做阳性对照和PBS代替一抗做阴性对照。
1.2.2 免疫组织化学染色结果判定方法 采用半定量评分法,根据每张切片阳性细胞百分数与染色强度进行综合计分。①PD-L1阳性表达位于肿瘤细胞胞膜和淋巴细胞、单核细胞的胞质和胞膜(PD-L1只计数肿瘤内和近瘤周的淋巴细胞和单核细胞)。染色强度评分标准:无着色计0分,淡黄色颗粒不明显计1分,棕黄色颗粒计2分,棕褐色颗粒计3分;阳性细胞占比评分标准:无阳性细胞计0分,0<阳性细胞占比≤ 1%计1分,1%<阳性细胞占比≤ 10%计2分,10%<阳性细胞占比≤ 50%计3分,阳性细胞占比> 50%计4分。②IMP3阳性表达位于肿瘤细胞胞质内,其染色强度评分标准同PD-L1,而阳性细胞占比评分标准为:无阳性细胞计0分,0<阳性细胞占比≤ 10%计1分,10%<阳性细胞占比≤ 50%计2分,50%<阳性细胞占比≤ 80%计3分,阳性细胞占比>80%计4分。免疫组化染色评分=染色强度评分×阳性细胞百分比评分,分值范围0~12分,得分≥4分判为阳性,得分<4分判为阴性。参考半定量标准,随机观察5个高倍视野,计算阳性细胞百分比及染色强度评分,经3位病理高级医师判定,在判定结果中若同一病例存在不同评分视野,则取最大值和最小值的平均值,结果均经2次重复观察,计分不一致者再次观察确认。
1.3 观察指标 ①统计乳腺癌病理组织中PD-L1、IMP3阳性表达情况。②分析乳腺癌病理组织中PD-L1、IMP3阳性表达与患者临床病理特征的关系。③统计并分析乳腺癌病理组织中PD-L1、IMP3阳性表达与患者术后复发风险级别的关系。其中术后复发风险级别评估参照《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[5],分为低度风险(2例),中度风险(64例),重度风险(36例)。④采用Spearman等级相关分析探究乳腺癌病理组织中PD-L1、IMP3阳性表达的相关性。
1.4 统计学方法 采用SPSS 20.0统计软件进行数据分析,计数资料以[例(%)]表示,两组间比较采用χ2检验,多组间比较采用χ2趋势检验;采用Spearman等级相关分析乳腺癌组织中IMP3、PD-L1阳性表达的相关性。以P<0.05为差异有统计意义。
2 结果
2.1 乳腺癌组织PD-L1、IMP3阳性表达情况 102例乳腺癌病理组织标本中PD-L1、IMP3的阳性表达率分别为57.84%(59/102)、19.61%(20/102);免疫组织化学染色显示,PD-L1在乳腺癌组织中阳性表达于肿瘤细胞胞膜和淋巴细胞、单核细胞的胞质和胞膜,可见明显的棕黄色颗粒,见图1-A; IMP3乳腺癌组织中阳性表达于肿瘤细胞胞质内,可见明显的黄褐色颗粒,见图1-B。
2.2 乳腺癌组织PD-L1、IMP3阳性表达与患者临床病理特征的关系 不同年龄、组织学级别、肿瘤直径、TNM分期、Ki-67增殖指数及淋巴转移情况、合并瘤栓情况乳腺癌患者病理组织中IMP3、PD-L1阳性率比较,差异均无统计学意义(均P>0.05);IMP3在不同分子分型乳腺癌患者病理组织中的阳性表达率从高到低依次为Basal-like型(66.67%)、LuminalB型[人表皮生长因子受体-2(HER-2)阳性](17.24%)、HER-2过表达型(15.38%)、LuminalA型(14.29%)、LuminalB型(HER-2阴性)(10.00%),差异均有统计学意义(均P<0.05);且合并坏死的乳腺癌组织中IMP3阳性表达率(33.33%)显着高于未合并坏死者(14.67%),差异有统计学意义(P<0.05),见表1。
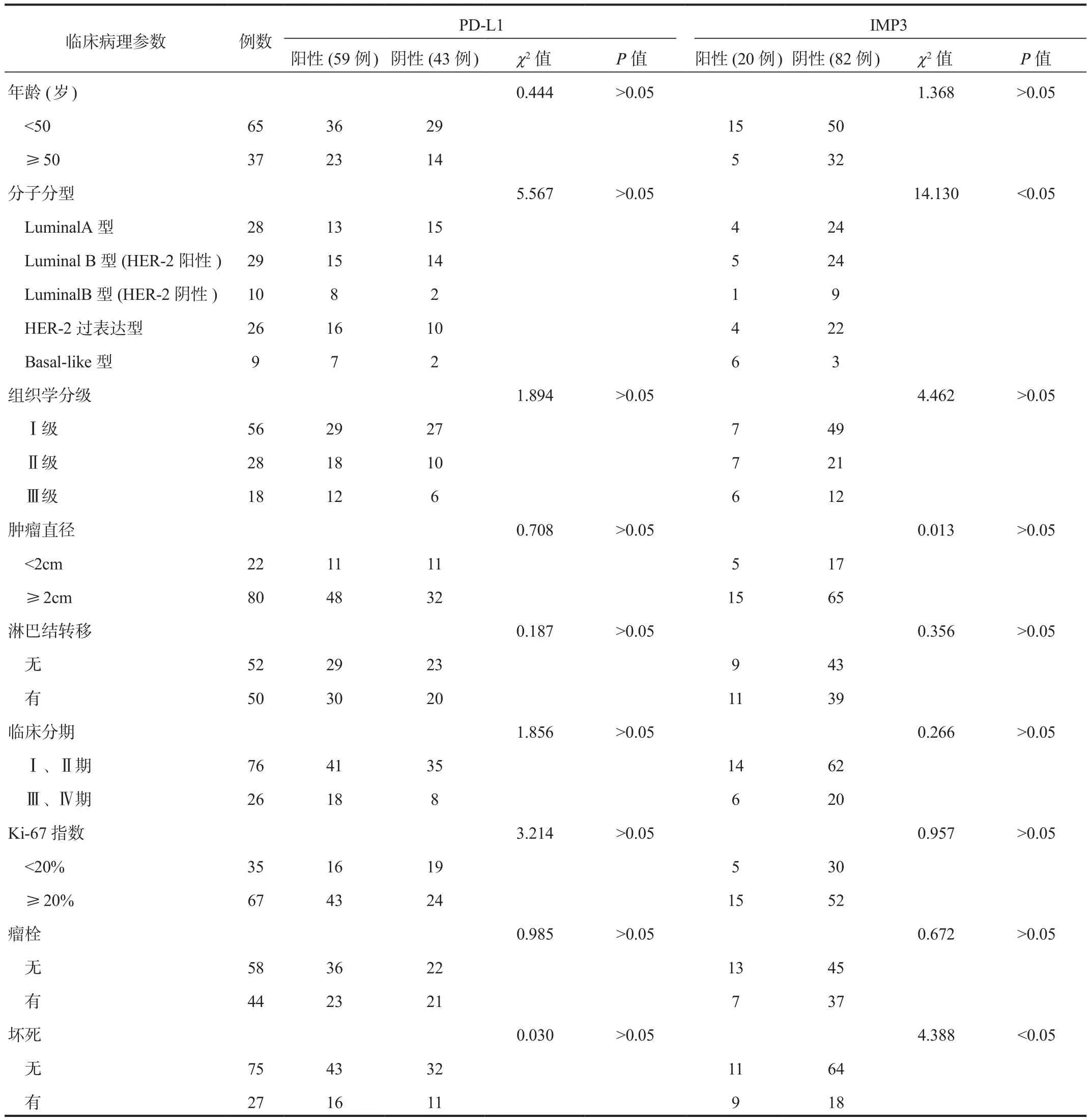
表1 乳腺癌组织PD-L1、IMP3表达与患者临床病理特征的关系
2.3 PD-L1、IMP3与乳腺癌术后复发风险级别的关系 随着乳腺癌患者术后复发风险级别的逐渐升高,乳腺癌组织中PD-L1、IMP3阳性表达率逐渐升高,但组间比较,差异均无统计学意义(均P>0.05),见表2。
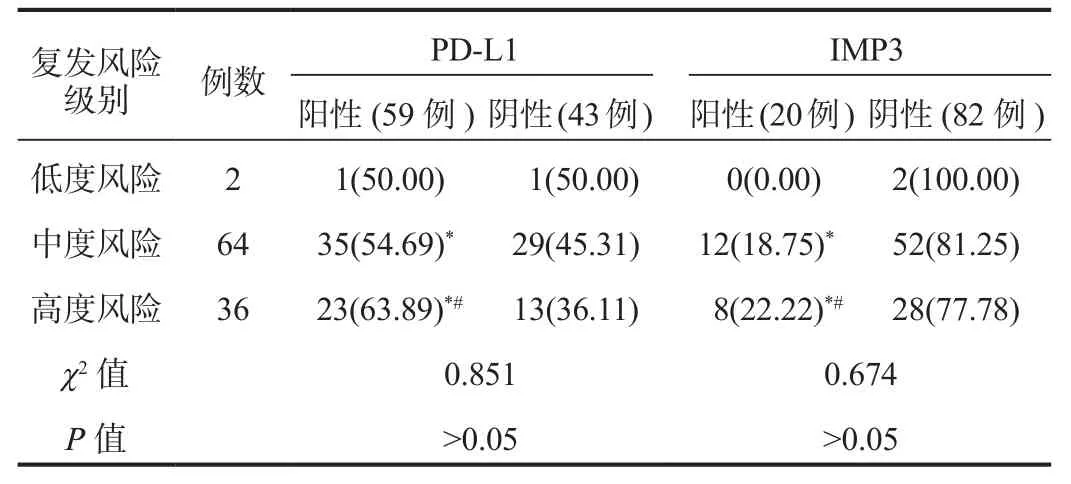
表2 PD-L1、IMP3与乳腺癌术后复发风险级别的关系
2.4 乳腺癌组织中PD-L1、IMP3表达的相关性 经Spearman等级相关分析显示,乳腺癌组织中PD-L1与IMP3阳性表达呈正相关性(r=0.172),但差异无统计学意义(P>0.05),见表 3。

表3 乳腺癌组织中PD-L1、IMP3表达的相关性
3 讨论
乳腺癌的发生、发展是多基因变化、多阶段累积和叠加作用的结果,乳腺癌晚期易发生远处转移,是导致患者死亡、预后不良的关键因素;且多种基因的异常表达和机体微环境中众多细胞因子之间的相互作用与乳腺癌的转移、疾病进展密切相关。
肿瘤微环境中肿瘤细胞和肿瘤浸润淋巴细胞均可表达PD-L1,与淋巴细胞PD-1结合后可抑制淋巴细胞免疫和分泌功能,进而参与肿瘤进展[6]。万玉秋等[7]报道,PD-L1在浸润性乳腺癌肿瘤细胞中阳性表达率为11.0%~56.6%;李丽煌[8]报道,PD-L1在116例乳腺癌组织中的阳性表达率为77.59%,且其阳性表达与乳腺癌的临床分期、组织学分级有关。本研究结果显示,102例乳腺癌病理组织标本中PD-L1的阳性表达率为57.84%(59/102),但PD-L1阳性表达与乳腺癌患者年龄、组织学级别、肿瘤直径、TNM分期、Ki-67增殖指数、淋巴转移情况、合并瘤栓情况、合并坏死情况及分子分型均无显着相关性,分析原因可能与本研究样本量少有关,因此临床仍需进一步开展大样本量深入研究。三阴性乳腺癌是指雌激素受体(ER)、孕激素受体(PR)、HER-2均呈阴性表达,是较其他亚型肿瘤更具侵袭性的乳腺癌病理分型,其远处器官转移率较高。黄述斌等[9]报道,PD-L1在乳腺癌组织中的总体阳性表达率为35.3%,尤其在三阴性乳腺癌中阳性率最高;此外,有研究报道,PD-L1阳性肿瘤干细胞可能参与了三阴性乳腺癌相关免疫逃逸复杂动力学,PD-L1通过与淋巴细胞表面的PD-1相互作用来削弱机体对肿瘤细胞的免疫应答,促进肿瘤细胞免疫逃逸,从而导致三阴性乳腺癌的发生、发展[10]。黄德妤等[11]研究报道,PD-L1 在三阴性乳腺癌组织中的表达水平明显升高,且其阳性表达与三阴性乳腺癌 TNM分期、淋巴结数量相关,同时会影响三阴性乳腺癌患者的预后,PD-L1阳性表达的三阴性乳腺癌患者术后生存率明显降低。本研究中,PD-L1在三阴性乳腺癌(Basal-like型)和非三阴性乳腺癌中(Luminal A型、Luminal B型、HER-2过表达型)的阳性表达率分别为77.78%(7/9)和55.91%(52/93),虽无显着性差异,但三阴性乳腺癌病理组织PD-L1阳性表达率更高,与上述研究报道相似。
IMP3是一种癌胚蛋白,其可通过上调IGF-Ⅱ蛋白表达水平而促进肿瘤细胞的增生,且其与乳腺癌干细胞的功能有关,目前已有研究报道,其在多种恶性肿瘤组织中呈高表达,与肿瘤细胞的侵袭性关系密切,因而与多种肿瘤的发生、发展密切相关,直接影响肿瘤患者的预后[12-13]。汤红平等[14]研究表明,IMP3在乳腺癌中的阳性表达率为22.86%(81/105),IMP3表达与组织学分级、Ki-67高表达及三阴性乳腺癌有关。本研究中,102例乳腺癌病理组织中IMP3的阳性表达率为19.61%;且IMP3在三阴型乳腺癌中阳性表达率66.67%(6/9),较非三阴型乳腺癌15.05%(14/93)显着升高;此外,IMP3的阳性表达率有坏死者(33.33%)较无坏死者(14.67%)显着升高,提示乳腺癌患者病理组织IMP3阳性表达与乳腺癌分子分型及坏死与否具有显着相关性。但IMP3的表达与乳腺癌患者年龄、组织学级别、肿瘤直径、TNM分期、Ki-67增殖指数、淋巴转移情况、合并瘤栓情况均无显着相关性,分析原因可能还是与入组病例偏少有关,因此建议后期开展大样本量深入研究。
IMP3主要与IGF-Ⅱ leader3 mRNA结合,促进其翻译,继而促进IGF-Ⅱ蛋白表达,然后通过IGF-Ⅱ蛋白发挥致癌效果,因此IMP3表达水平越高,越利于肿瘤疾病的转移及复发[15];免疫失调在肿瘤疾病的发生、发展中普遍存在,而PD-L1是一个重要的免疫卡控点,其可与T淋巴细胞表面的受体结合,诱导肿瘤患者发生免疫抑制应答翻译,介导肿瘤细胞逃逸,因而导致肿瘤侵袭与转移,因而肿瘤复发风险级别较高[16]。本研究结果显示,随着乳腺癌患者术后复发风险级别的逐渐升高,乳腺癌组织中PD-L1、IMP3阳性表达率逐渐升高,但组间比较,差异均无统计学意义。同时,本研究中,经Spearman等级相关分析显示,乳腺癌组织中PD-L1与IMP3阳性表达呈正相关性,但差异无统计学意义,表明乳腺癌组织中PD-L1与IMP3阳性表达无明显相关性,但目前有关乳腺癌病理组织IMP3表达情况与意义的相关报道尚不多见,且本研究所入选样本量偏小,因此研究结果尚不具备代表性,建议后期临床继续开展大样本量相关研究。
综上,乳腺癌病理组织PD-L1、IMP3高表达,尤其在三阴性乳腺癌(Basal-like型)病理组织中表达水平最高,且IPM3阳性表达及其表达水平变化与乳腺肿瘤患者的不良预后和进展有关,而PD-L1的阳性表达及其表达变化与肿瘤的不良预后和进展无关,且两者间阳性表达亦无明显相关性。但由于本研究样本量较小,且目前相关研究报道尚不多见,因此建议临床后期开展大样本量深入研究,为临床乳腺癌患者的分子治疗提供依据。



