樊宽鲁,王贵涛,刘灿灿,刘 超
(1.徐州医科大学第二附属医院内分泌科,江苏 徐州 221000;2.江苏恩华药业股份有限公司,江苏 徐州 221000;3.江苏省中西医结合医院内分泌科,江苏 南京 210028)
甲状腺癌是内分泌系统最常见的恶性肿瘤,其发病率呈逐年上升的趋势[1],其中90%以上为分化型甲状腺癌(differentiated thyroid carcinoma,DTC)[2]。目前国内外针对DTC普遍推崇的规范化治疗方案为“手术治疗+131碘治疗(131I治疗)+内分泌治疗(TSH抑制治疗)”的综合治疗。其中131I治疗作为DTC术后重要的辅助治疗方法,在清除残余甲状腺组织及辅助治疗潜在微小残留癌灶甚至远处转移灶等方面发挥重要作用。本研究旨在探讨131I治疗疗效及其影响因素,为今后更好指导临床、提高疗效以及兼顾131I治疗个体化原则提供理论基础。
1 资料与方法
1.1一般资料:选取2012年1月~2016年5月行甲状腺全切或次全切除术后经病理证实为DTC,行清甲治疗并在我院规律复诊、资料完整的DTC患者,共229例,年龄8~78岁;男69例,女160例;乳头状癌210例,滤泡状癌19例;无转移40例,术后无转移(手术将所有转移淋巴结清扫干净)133例,术后淋巴结转移35例,远处转移21例。
1.2方法
1.2.1甲状腺功能评定:采用电化学发光免疫分析测定法(Roche Germany)检测TSH、Tg、TgAb、TPOAb。
1.2.2清甲疗效标准:刺激状态下Tg<1 ng/ml或131I显像甲状腺床无放射性碘浓聚为清甲成功,否则为清甲未成功。
1.2.3131I清甲流程:手术后或停用左甲状腺素(L-T4) 3~4周使内源性TSH>30 mIU/L;低碘饮食1~2周,避免含碘药物,使尿碘<100 μg/L;育龄期妇女需测定尿HCG,以排除妊娠;告知患者治疗的目的、可能出现的不良反应及应对措施;排除131I治疗禁忌证后签署知情同意书;空腹一次性服用治疗剂量的131I(原子高科股份有限公司),服药2 h后多饮水,含服维生素C片、酸性食物以保护唾液腺,甲氧氯普胺预防恶心、呕吐;治疗24~48 h后开始进行甲状腺素替代治疗。
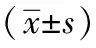
2 结果
2.1131I首次清甲疗效:首次清甲成功率70.74%(162/229)。
2.2影响首次清甲疗效的单因素分析
2.2.1与首次清甲疗效相关的因素:原发癌灶大小、复发危险分层、转移情况、清甲前sTg水平。
2.2.2与首次清甲疗效无关的因素:年龄、性别、手术方式、病理类型、有无桥本氏病、癌灶单双侧、数目、TNM分期、首次手术距清甲的时间、清甲前TSH水平、131I剂量。
2.3影响首次清甲疗效相关因素的二元Logistic回归分析:对单因素分析影响首次清甲疗效的指标纳入二元logistic回归分析,结果显示原发癌灶直径、sTg及转移情况是影响清甲疗效的关键因素。原发癌灶直径及sTg水平越高清甲疗效越低,术后淋巴结转移及远处转移组清甲疗效较无转移组低,而术后淋巴结转移组与无转移组清甲疗效无统计学差异。见表1。
2.4清甲治疗前sTg水平预测首次清甲疗效的ROC曲线:清甲前sTg预测首次清甲疗效的ROC曲线下面积为0.827,约登指数最大值为0.625,预测清甲疗效的最佳界值为5.35 ng/dl,其对应的敏感度和特异度分别为94%、68.5%。见表2,图1。
表1Logistic回归分析结果
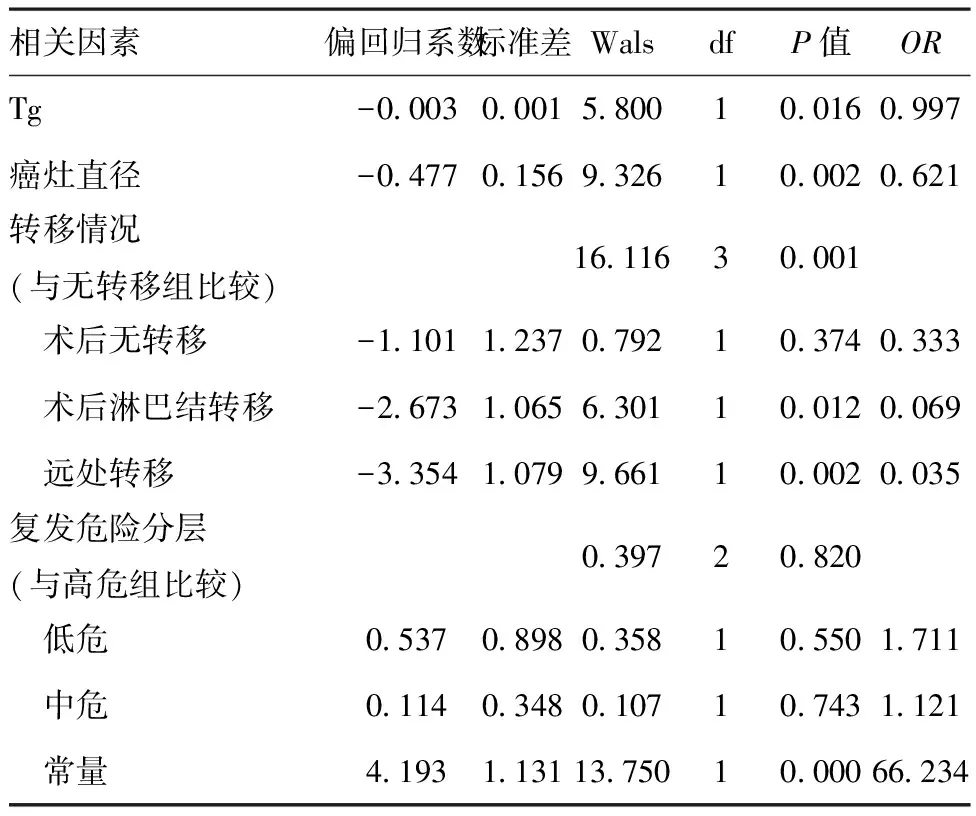
相关因素偏回归系数标准差WalsdfP值ORTg-000300015800100160997癌灶直径-047701569326100020621转移情况(与无转移组比较)1611630001 术后无转移-110112370792103740333 术后淋巴结转移-267310656301100120069 远处转移-335410799661100020035复发危险分层(与高危组比较)039720820 低危053708980358105501711 中危011403480107107431121 常量41931131137501000066234
表2131I清甲治疗前sTg水平预测清甲疗效的价值

观察指标面积界值(ng/dl)真阳性数假阳性数真阴性数假阴性数阴性预测值(%)准确性(%)灵敏度(%)特异度(%)sTg08275356351111496527694685
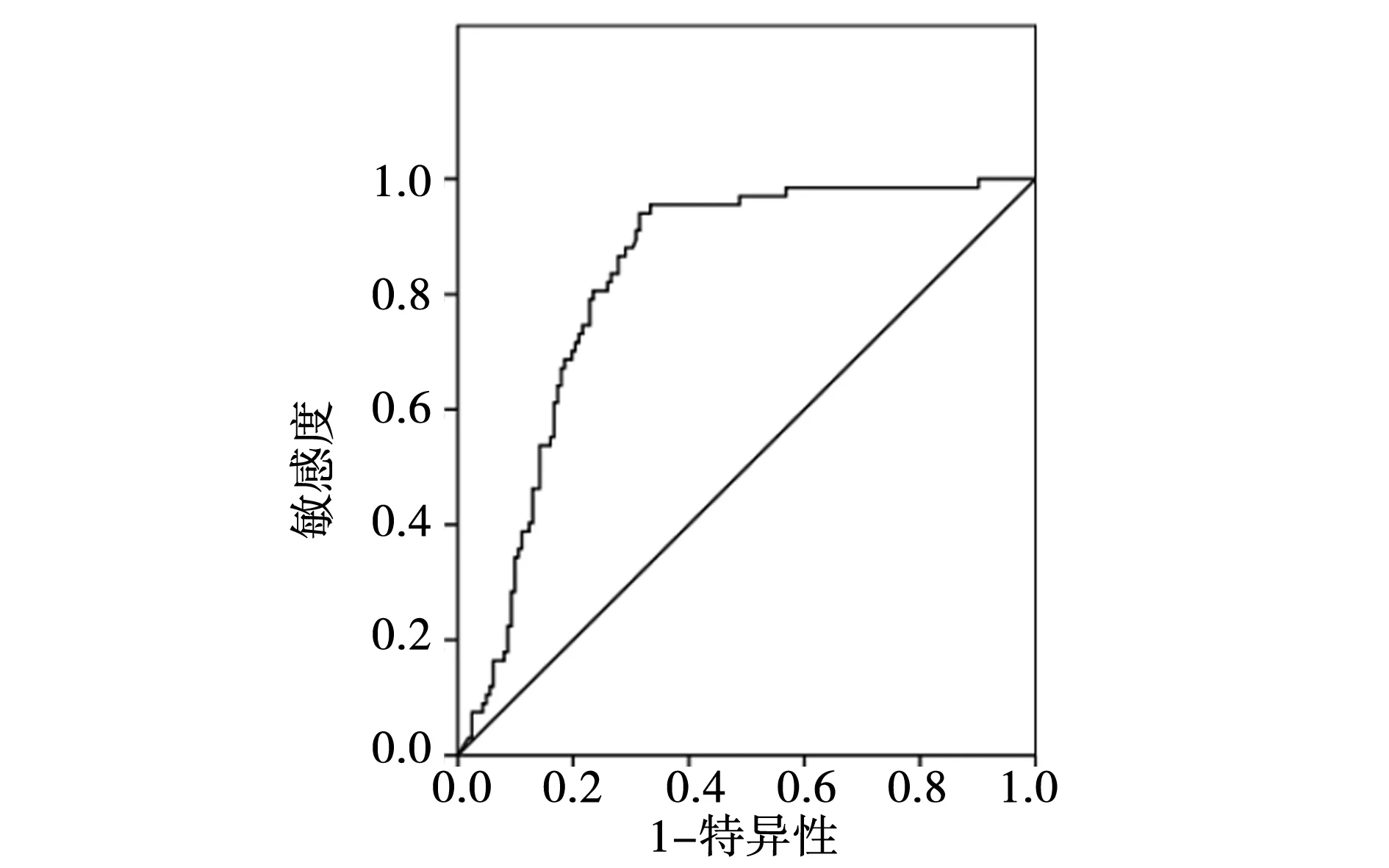
图1 清甲前sTg水平预测首次清甲疗效的ROC曲线
3 讨论
131I治疗利用放射性核素131I衰变时发出的β射线破坏残留的甲状腺组织、甲状腺原发癌灶及转移灶,其作为DTC治疗三步曲中的重要环节,能够显着降低DTC的复发和转移率,并且有利于通过监测血清Tg水平以预测DTC的复发和转移,同时131I治疗后5~7 d行131I全身显像可以判断术后残余甲状腺组织的大小、有无淋巴结及远处转移,可能会改变DTC的分期和危险分层,在DTC患者的动态风险评估中起着重要作用。
国内外学者对DTC患者进行了一些有关131I清甲治疗的临床研究,但其首次清甲成功率报道不一。Ha等报道首次清甲成功率68.8%,Verburg等[4]报道首次清甲成功率56.6%[3],国外尚有学者报道首次清甲成功率高达98.5%[5],国内报道首次清甲成功率在43%~87.2%之间[6-7]。本研究回顾性分析了229例清甲治疗DTC患者,首次清甲成功率70.74%,与多数学者报道的首次清甲成功率相似[3,8]。各研究报道不仅首次清甲成功率不同,而且影响清甲疗效的因素也各不相同。本研究单因素分析显示原发癌灶直径、复发危险分层、转移情况及清甲前sTg的水平是影响首次清甲疗效的重要因素;Logistic回归分析结果提示癌灶直径增大、转移程度加重(术后淋巴结转移及远处转移)以及清甲治疗前sTg水平升高是清甲疗效的不利因素。
对于甲状腺全切或次全切的DTC患者,术后可给予131I治疗以清除残留的甲状腺组织或隐匿的病灶。理论上手术去除甲状腺组织越干净,残余甲状腺组织越少,甲状腺激素及Tg分泌得越少,垂体分泌的TSH水平就越高,单位组织摄取的131I的剂量就越多,首次清甲成功率就越高。本研究中甲状腺全切、次全切组首次清甲成功率无统计学差异,可能是因为本研究只有少数患者行次全切除术,其残留的甲状腺组织很少,二者的差异不足以影响首次清甲的疗效。另外,本研究中清甲治疗的剂量均≥100 mCi,大剂量的131I也可能抵消了因甲状腺组织残留大小的微弱不同而导致的清甲疗效的差异。本研究同时比较了不同水平TSH与清甲疗效的差异,结果示TSH>40 mIU/L组首次清甲成功率略高于30 mIU/L﹤TSH≤40 mIU/L组(72.64%VS50.86%),但差异无统计学意义(P>0.05)。而认为清甲疗效与TSH水平有关的研究大部分都是以30 mIU/L为界限[6,9],推测TSH>30 mIU/L时,其促进残余甲状腺组织摄碘的能力达到最大,即使再升高TSH并不显着改变清甲的成功率。可见,指南将清甲前TSH界值定为30 mIU/L,有着其重要的临床意义。
Tg是一种大分子的糖蛋白,甲状腺组织或分化好的甲状腺癌组织合成的Tg在TSH的刺激下随甲状腺激素一起分泌,对甲状腺癌全切或次全切除术后判断131I治疗的疗效及监测甲状腺癌复发或转移有重要意义。本研究发现首次清甲成功组sTg水平远低于首次清甲未成功组。Tg不仅影响首次清甲疗效,而且对清甲疗效也有一定的预测价值。Tamilia等回顾性分析了157例DTC患者,发现首次清甲前sTg>6 ng/ml预测清甲失败的敏感性和特异性分别为67%、79%[10],Zubair等研究发现sTg预测清甲成功和未成功的界值为18 ng/ml,敏感性和特异性分别为76.7%、79.1%[11]。本研究发现sTg>5.35 ng/ml预测清甲不成功的敏感性高达94%,准确率76%,阴性预测值96.52%,也就是说清甲前如果sTg≤5.35 ng/ml,96%以上的DTC患者首次清甲可能成功。可见,清甲前sTg水平是预测清甲疗效的较好指标。
Verkooijen等发现有淋巴结转移DTC患者首次清甲成功率显着低于无淋巴结转移组(44.9% VS 60.9%)[12],Kumar等的研究也表明随着淋巴结及远处转移增加清甲治疗的剂量,但是清甲成功率却下降[13]。本研究发现即便是手术已将转移的淋巴结清扫干净,术后无转移组清甲成功率仍低于无转移组,术后淋巴结转移组及远处转移组清甲成功率均低于无转移组,说明首次清甲成功率因淋巴结或远处转移的存在而下降。可能是因为大部分甲状腺癌组织具有摄碘能力,若同时存在甲状腺腺外转移时,131I不仅在残余甲状腺内聚集,而且在甲状腺外组织也能聚集,减少了甲状腺内131I的浓度,从而降低了清甲疗效。同时当发生淋巴结、远处转移时可能病程比较长,肿瘤细胞在增殖的过程中可能会出现低分化、甚至失分化,使得癌灶或残余甲状腺组织对131I的敏感性下降。可见,淋巴结转移和(或)远处转移是首次清甲疗效的不利因素,因此对于有甲状腺腺外转移的DTC患者,清甲治疗时应该考虑增加131I剂量,以达到彻底清甲并兼顾清灶的目的。
总之,科学、规范的131I治疗是DTC综合治疗的重要环节,为了最大程度保证患者的利益,一方面要合理使用131I治疗,对原发癌灶大、sTg水平高、有淋巴结或远处转移的DTC患者适当增加131I剂量;另一方面,对未接受131I治疗的DTC患者密切随访,实施动态风险评估。
[1] Desantis C E,Lin C C,Mariotto A B,et al.Cancer treatment and survivorship statistics,2014[J].Ca A Cancer Journal for Clinicians,2014,64(4):220.
[2] Wang S,Liang J,Lin Y,et al.Differential expression of the Na(+)/I(-) symporter protein in thyroid cancer and adjacent normal and nodular goiter tissues[J].Oncol Lett,2013,5(1):368.
[3] Ha S,Oh SW,Kim YK,et al.Clinical Outcome of Remnant Thyroid Ablation with Low Dose Radioiodine in Korean Patients with Low to Intermediate-risk Thyroid Cancer[J].J Korean Med Sci,2015,30(7):876.
[4] Verburg FA,Lassmann M,Mader U,et al.The absorbed dose to the blood is a better predictor of ablation success than the administered131I activity in thyroid cancer patients[J].Eur J Nucl Med Mol Imaging,2011,38(4):673.
[5] Campenni A,Giovanella L,Pignata SA,et al.Thyroid remnant ablation in differentiated thyroid cancer:searching for the most effective radioiodine activity and stimulation strategy in a real-life scenario[J].Nucl Med Commun,2015,36(11):1100.
[6] 刘 晔,晋建华,刘建中,等.放射性131I去除分化型甲状腺癌术后残留甲状腺组织的疗效与影响因素分析[J].中国药物与临床,2013,13(5):556.
[7] 申 勇,刘恒超,胡永全,等.92例分化型甲状腺癌131I治疗临床分析[J].中华全科医学,2011,9(10):1517.
[8] 陈永辉,马艳茹,林岩松.不同剂量首次131I去除甲状腺术后残留组织疗效比较[J].中华核医学与分子影像杂志,2012,32(1):39.
[9] 张桂芝,谭 建,刘雪辉,等.131I治疗分化型甲状腺癌术后患者疗效影响因素研究[J].中华核医学杂志,2010,30(4):259.
[10] Tamilia M,Al-Kahtani N,Rochon L,et al.Serum thyroglobulin predicts thyroid remnant ablation failure with 30 mCi iodine-131 treatment in patients with papillary thyroid carcinoma[J].Nucl Med Commun,2011,32(3):212.
[11] Hussain S Z,Zaman M U,Malik S,et al.Preablation Stimulated Thyroglobulin/TSH Ratio as a Predictor of Successful I131Remnant Ablation in Patients with Differentiated Thyroid Cancer following Total Thyroidectomy[J].Journal of Thyroid Research,2014,2014:610273.
[12] Verkooijen RB,Stokkel MP,Smit JW,et al.Radioiodine-131 in differentiated thyroid cancer:a retrospective analysis of an uptake-related ablation strategy[J].Eur J Nucl Med Mol Imaging,2004,31(4):499.
[13] Kumar A,Bal CS.Differentiated thyroid cancer[J].Indian J Pediatr,2003,70(9):707.



