辛雯艳,刘 冬,许西琳,鲁德玕
(1.新疆石河子大学医学院第一附属医院呼吸内科,新疆 石河子 823008;2.山东省千佛山医院呼吸内科,山东 济南 250014)
慢性阻塞性肺疾病(简称慢阻肺)是一种常见的呼吸系统疾病,常与吸烟产生的烟雾颗粒或其他原因产生的有害气体相关,上述可导致肺泡和(或)气道的异常反应,本质是气道的炎性反应改变,气道炎性反应的程度通常与慢阻肺病情的严重程度相关[1]。因此,找到一种简便快捷的方法来了解患者气道炎性反应并预测患者的治疗反应是极为重要的。呼出气冷凝液检查是目前国内外新开展的热门的无创生化肺功能检查技术,EBC中可以检验许多炎性反应介质[2],FENO检测是近年来一种新兴的无损伤的判断气道炎性反应的方法,因此本文研究的核心在于评价检验FENO和EBC中白介素-17在慢阻肺发病机制及病情评估中的意义。
1 资料与方法
1.1一般资料:收集2014年11月~2015年6月在我院住院治疗的81例急性加重期慢阻肺患者,所有患者符合《内科学》第8版中的慢阻肺诊断标准:有吸烟等危险因素的患者吸入支气管扩张剂后FEV1/FVC<0.7;排除标准:有类似症状和肺功能的其他疾病如支气管哮喘、其他原因引起的慢性咳嗽、咯痰症状的疾病,其他引起劳力性气促的疾病,其他原因所致的呼吸气腔扩大。急性加重的慢阻肺患者经过大约14 d左右的抗感染、雾化吸入等处理无明显不适后视为稳定期。将在我院行健康体检的78例无系统疾病的志愿者作为对照组;所有入组对象家属或本人均知情同意,并经过医院伦理委员会审核通过。慢阻肺急性加重期组年龄(73.1±5.85)岁、性别(男/女:50/31)、身高(164.31±7.26)cm、体重(64.95±11.10)kg,稳定期组年龄(73.1±5.85)岁、性别(男/女:50/31)、身高(164.31±7.26)cm、体重(64.95±11.10)kg,对照组年龄(68.6±7.36)岁、性别(男/女:38/40)、身高(160.29±7.90)cm、体重(65.67±11.89)kg等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1FeNO检测:采用瑞典(Nioxmino,Aero-cine AB Solna)行FeNO测定。测定要求:①4 h之内不能食用含硝酸盐的食物,比如韭菜、咖啡、酒等;②1 h之内不能做剧烈运动;③不能主动或被动抽烟。嘱患者尽量排空肺内空气,然后嘴唇包紧一次性过滤器,均匀吸气大约5 s,然后让患者平稳的把肺部气体呼出,呼气时间为10 s,大概90 s后可读取数值。
1.2.2EBC标本收集:天津易贸有限公司和山东佛山医院共同设计完成呼出气冷凝液收集器并由天津易贸有限公司制作,EBC收集完成后放入-80 ℃冰箱保存。
1.2.3EBC中IL-17浓度检测:使用酶联免疫法测定EBC中IL-17的浓度。
1.2.4FEV1%测定方法:采用我院Medgraphics肺功能仪检查。根据受试者个人的身高、体重、年龄、性别计算出其正常预计值;受试者带鼻夹,通过一次性口器与肺功能计量器连接;嘱受试者平静呼吸15 s,于平静呼气末用力吸气至最大肺容量,然后迅速用力呼气,直至呼尽,不得中断,呼气时间不得少于4 s;反复3次,取最佳1次。
1.3统计学方法:使用SPSS17.0统计软件包进行分析,统计方法有方差分析、SNK-q检验、直线相关分析等方法,以P<0.05为差异有统计学意义。
2 结果
2.1FENO值及肺功能、EBC中IL-17分析:慢阻肺急性加重期患者EBC中IL-17及FENO都高于稳定期及健康对照组,差异有统计学意义(P<0.05),慢阻肺稳定期患者EBC中IL-17及FENO高于健康对照组,差异有统计学意义(P<0.05),慢阻肺急性加重期FEV1%明显低于稳定期组,差异有统计学意义(P<0.05),急性加重期与稳定期FEV1%均显着低于健康对照组,差异有统计学意义(P<0.05),见表1。
2.2EBC中各指标相关性分析:相关关系研究发现,慢阻肺急性加重期组和稳定期组患者FENO水平和FEV1%均无相关性,差异无统计学意义(P>0.05),见表2;FENO从急性加重期到稳定期的改善程度与FEV1%从急性加重期到稳定期的改善程度有明显正相关关系,差异有统计学意义(P<0.05),见表3;慢阻肺急性加重期与稳定期FENO与EBC中IL-17都存在明显正相关关系,差异有统计学意义(P<0.05),见表4。
表1慢阻肺急性加重期和稳定期FENO、IL-17及肺功能
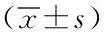
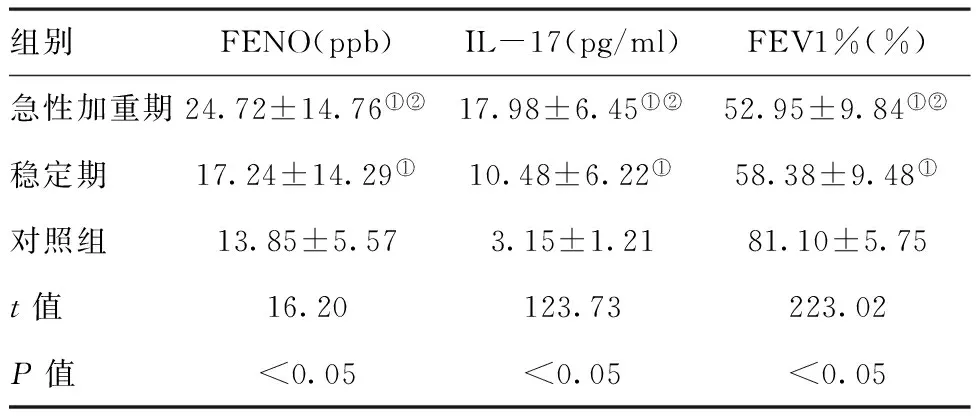
组别FENO(ppb)IL-17(pg/ml)FEV1%(%)急性加重期24.72±14.76①②17.98±6.45①②52.95±9.84①②稳定期17.24±14.29①10.48±6.22①58.38±9.48①对照组13.85±5.573.15±1.2181.10±5.75t值16.20123.73223.02P值<0.05<0.05<0.05
注:与对照组比较,①P<0.05;与慢阻肺稳定期比较,②P<0.05
表2慢阻肺急性加重期及稳定期FENO与FEV1%的相关性
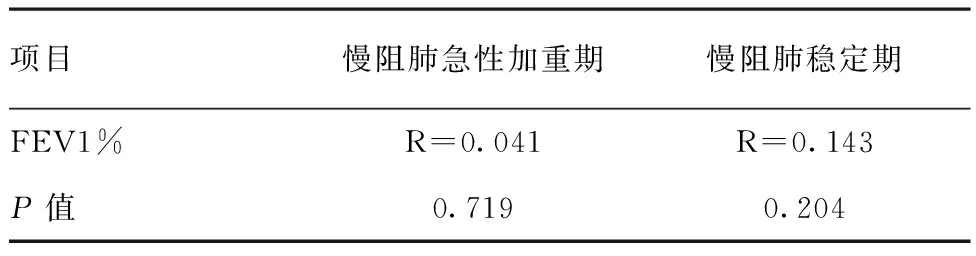
项目慢阻肺急性加重期慢阻肺稳定期FEV1%R=0.041R=0.143P值0.7190.204
表3慢阻肺急性加重期到稳定期FENO改善与急性加重到稳定期FEV1%改善的相关关系

项目FEV1%改善值FENO改善值R=0.237P值0.033
表4慢阻肺患者急性加重期及稳定期FENO与EBC中IL-17的关系
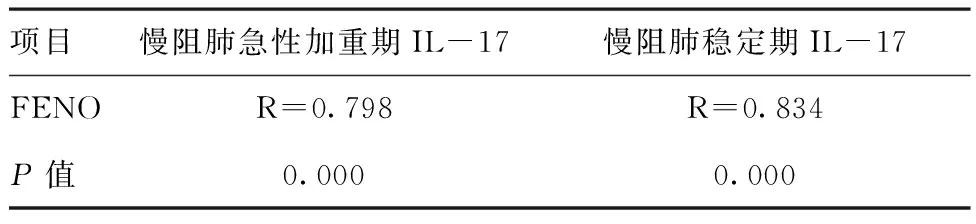
项目慢阻肺急性加重期IL-17慢阻肺稳定期IL-17FENOR=0.798R=0.834P值0.0000.000
3 讨论
慢阻肺是一种由多种原因引起的气道慢性疾病,在慢阻肺中慢性气道炎性反应可引起肺泡上皮细胞凋亡、结构破坏、气道和血管重构、微生物的定植和感染甚至全身炎性反应。特别是在慢阻肺急性加重期,气道炎性反应程度明显增加,因此气道炎性反应严重程度的检查和评估有助于疾病的临床诊疗。诱导痰、肺泡灌洗、支气管黏膜活检等是传统的测定气道炎性反应的方法。但这三种方法由于其有创性及过程复杂等原因,若广泛应用于临床必将受到限制。
FENO测定作为一种简易、快速、有效的无创气道炎性反应检测方法,其测定无论在儿童或成人都具高度重复性,被ATS/ERS首推作为检测气道炎性反应的方法[3],现广泛应用在支气管哮喘患者气道炎性反应的评估。支气管哮喘与慢阻肺都是以气道炎性反应为特点的疾病,其中慢阻肺的主要效应细胞是中性粒细胞[4],而FENO则被认为是反应气道嗜酸性炎性反应的指标,所以FENO在慢阻肺中的运用存在局限性。近年的很多研究发现,慢性阻塞性肺疾病急性加重期患者的气道炎性反应还存在嗜酸性粒细胞的增加[5],因而现今许多的研究者都提出了慢阻肺与支气管哮喘的气道炎性反应均有嗜酸性细胞参与的观点。且已有研究显示,大于40%的慢阻肺患者痰中嗜酸性粒细胞大于3%[6],这提示我们测定慢阻肺患者FENO也许对慢阻肺患者病情评估及预后有重要的价值。通过揭示气道炎性反应,区分炎性反应的表型,从而评估慢阻肺患者对抗炎等处理是否有良好的效果。目前有研究提示,稳定期患者值较健康人升高[7],本研究与其相符,但也有研究表明,稳定期患者FENO水平和正常对照人无区别。研究提示,经抗炎、吸入激素等处理后FENO的水平从慢阻肺急性加重到稳定期降低,且FENO水平及降低程度与肺功能的增加程度有明显正相关关系[8],这与笔者的研究也相符。Malmberg LP[9]以支气管活检方法发现呼出气体中的一氧化氮水平与气道炎性细胞的总数正相关,这一点也能很好的解释慢阻肺患者FENO增高的现象。
EBC中能够检验各种细胞因子和炎性反应介质,且对患者来说是完全无痛苦、易配合的检查。IL-17主要是T淋巴细胞产生炎性反应的早期启动因素,它能够分泌前炎性细胞因子增加炎症反应而损伤气道[10],从而在慢阻肺的发生、发展中起到重要的作用[11]。有研究表明[12],IL-17可以导致内皮血管损伤,并抑制内皮修复,加剧血管受损,导致肺损伤,加剧肺功能恶化,进而加重慢阻肺的进展。我国季巧英等人[13]实验证实,血清中IL-17和中性粒细胞百分百在慢阻肺患者急性加重期患者中升高,通过抗炎对症处理后降低也显着。本研究显示慢阻肺急性加重期及稳定期EBC中IL-17均明显高出健康对照组,急性加重期经过治疗后IL-17显着降低,同时急性加重期及稳定期IL-17均与FENO有很好的相关性,因而提示IL-17的增高可能是慢阻肺的重要发病机制,尤其是它的水平增多可能导致慢阻肺的急性加重,其水平的高低可以反应慢阻肺的病情轻重。但慢阻肺患者中性粒细胞的募集和激活是否完全归因于IL-17介导,IL-17是否与慢阻肺的气道重塑相关,尚需进一步研究。
综上所述,慢阻肺在其发生、发展过程中IL-17、NO也许起到了非常重要的作用,而具体的机制还需医务工作者继续探究。而EBC、FENO均可看做与外周血、体液等有同等地位的可鉴定生物学标记的检测对象,可重复操作且不影响疾病的病理生理。IL-17联合FENO因为其简易,无创伤,依从性好,通过对其监测对于甄别慢阻肺患者病情严重程度有帮助,进而有助于慢阻肺患者的诊治。
[1] 庞红燕,杨 汀,王 辰.2016年更新版GOLD慢性阻塞性肺疾病诊断、治疗和预防的全球策略简介[J].中国医学前沿杂志(电子版),2016,8(7):30.
[2] Ahmadzai H,Huang S,Hettiarachchi R,et al.Exhaled breath condensate:a comprehensive update[J].CCLM,2013,51(7):1.
[3] GOLD Executive Committee.Global strategy for the diagnosis,management and prevention of chronic obstructive pulmonary disease(updated 2015)[EB/OL].(2015-01).http:///www.goldcopd.org.
[4] Daniel Chang,Weiguo Yao,Christina J.Tiller,et al.Exhaled nitric oxide during infancy as a risk factor for asthma and airway hyperreactivity[J].Eur Respir J,2015,45(1):98.
[5] Balbi B,Aufiero A,Pesci A,et al.Lower respiratory tract inflammation in chronic bronchitis:evaluation by bronchoalveolar lavag and changes associated with treatment with immucytal,a biological response modifier[J].Chest,2014,106(3):819.
[6] Perng DW,Huang HY,Chen HM,et al.Characteristics airway inflammation and bronchodilator reversibility in COPD:a potential guaid to treatment[J].Chest,2015,126(2):375.
[7] Kelly E,Owen CA,Pinto-Plate V,et al.The role of systemic inflammatory biomarkers to predict mortality in chronic obstructive pulmonary disease[J].Expert Rev Respir Med,2013,7(1):57.
[8] 刘 冬,许西琳,蒋雪龙,等.慢性阻塞性肺疾病患者CAT评分、呼出气一氧化氮、肺功能之间的相关性研究[J].吉林医学,2017,38(5):831.
[9] Malmberg L,Pelkonen A,Haahtela T,et al.Exhaled nitric oxide rather than lung function distinguishes preschool children with probable asthma[J].Thorax,2003,58(6):494.
[10] 陈子伟,庄俊合,罗宜红,等.血浆IL17在慢性阻塞性肺疾病综合评估中的作用[J].广州医科大学学报,2015,43(2):97.
[11] 晏斌林,顾为丽,杜 娟,等.慢性阻塞性肺疾病患者呼出气冷凝液 IL-17、IL-10、8-iso-PG 的测定及临床意义[J].中国呼吸与危重监护杂志,2017,16(2):142.
[12] ZHANG J,CHU S,ZHONG X,et al.Increased expression of CD4+IL-17+cells in the lung tissue of patients with stable chronic obstructive pulmonary disease( COPD) and smokers[J]. IntImmunopharmacol,2013,15(1):58.
[13] 季巧英,舒彩敏,方双燕,等.IL-17在COPD患者中的表达[J].临床肺科杂志,2012,17(12):2188.



