李宇林 (广安市人民医院心内科,四川 广安 638500)
急性冠状动脉综合征(ACS)是一种起始表现为冠状动脉粥样硬化斑块破裂,进而诱导完全或不完全闭塞性血栓形成为病例基础的心血管疾病[1-2]。加强对动脉粥样硬化斑块的研究学习对ACS的防护和根治具有深远的意义。斑块的稳定性是由许多原因造成的,细胞外表面存在的脂质池越小,炎性细胞数量越少,纤维帽的厚度越大,斑块的稳定性就越高[3]。其中斑块内的炎性反应是造成斑块不稳定性的首屈一指的影响因素[4]。炎性反应程度越强烈,进程越远,其斑块的破裂几率就会越大。目前,控制斑块浅表部位炎性反应的发生率成为稳定易损斑块进而降低ACS发生率的研究热点。抵抗素是一种经过参与胰岛素信号转导路径和代谢有关的酶来控制人体代谢过程的多肽类激素[5]。近年来,相关抵研究报道显示,抵抗素存在于外周血单核细胞中,并且大量分泌同时还被多个炎性反应标志物所标识,提醒研究者一个重要的信号,那就是所有的抵抗素作为一种已经在机体中表达过的、现在以潜藏的形式存在于外周血中,其作为诱导因素可再次参与炎性反应过程[6-7]。为了进一步了解抵抗素影响炎性因子参与过程的机制,深入研究动脉粥样斑块稳定性的影响因素,现将结果报告如下。
1 资料与方法
1.1 动物模型的建立与分组:雄性ApoE小鼠普通饮食2周之后继续给予高脂饮食(0.25%胆固醇 +15%脂肪)喂养2周。向小鼠腹腔内注射0.08%戊巴比妥钠进行麻醉,查看小鼠的麻醉效果,待其充分麻醉后把小鼠用结实的绷带牢牢地固定在手术台上,于颈部正中切口,把右侧颈部肌肉及腺体分离出来,将右侧颈总动脉完全暴露出来,用硅胶管套(长度为3 mm,内径为0.3 mm)放在颈总动脉旁边,锁定套管后缝合切口继续高脂喂养8周后,对颈总动脉进行局部暴露然后摘除硅胶套管,避免破坏小鼠组织。向颈总动脉处小心滴注100μl浓度为2×10 TU/ml的病毒悬液,局部孵育15 min后将切口缝合,这样小鼠就受到不同程度的慢性病毒感染。转染慢病毒的程度有PBS浸润 、转染携带空载体的慢病毒、转染携带干扰序列Si-RELM的慢病毒。根据三种不同状态依次对应分为正常对照组、Si-NC组和Si-RELMβ组,每组20只。继续进行为期4周的高脂喂养 ,最终对小鼠行安乐死,收集血液及颈总动脉标本用作检验。
1.2 各组体质量和血脂的检测:所有小鼠处死前三次测量体重,取平均值记录并留样空腹血。用Microfuge系列台式微量离心机(Microfuge 20/20R)进行离心,取上层血清,检测血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL)以及低密度脂蛋白胆固醇(LDL)的浓度。
1.3 方法:斑块中RELMβ蛋白的表达水平选择常见的Western blotting法对其测定。取一些冰块使50 mg新鲜的颈动脉血处于低温环境并将血剪碎,将500μl的Western裂解液滴入剪碎的新鲜血中,再继续向其滴加5μl的蛋白酶抑制剂。三者均匀混合后在4℃冰上孵育30 min,在12 000 r/min转速下将血液进行离心15 min。各组均取等量的总蛋白加入10%SDS-PAGE进行电泳分离(200 mA转膜2 h),染色并鉴定转膜效果。将5%脱脂奶粉置于室温下封闭2 h,分别加入小鼠来源单抗抗体(1∶1 000),兔来源单抗使用 β-action抗体(1∶1 000),4℃孵育一晚,第2天用1×TBS-T溶液漂洗3次,15 min/次。加入由相应的辣根过氧化酶标记的二抗(1∶10 000),室温条件下培育2 h,1×TBS-T溶液漂洗3次,15 min/次。暗室发光,应用Photoshop技术、胶片曝光显影进行半定量分析。分析进程中选β-action作为内参照物,应用目的蛋白和β-action的灰度比来表示蛋白相对表达水平。
1.4 平滑肌细胞、巨噬细胞、1L-1β、1L-6含量的检测:分别选用生理盐水、浓度为4%的多聚甲醛溶液灌洗心血管,使其保持固定状态。小心地剥开并分离出右侧颈总动脉,放于4%的多聚甲醛溶液中浸泡24 h,设定-80℃条件,将被OTC冲洗过的包埋组织冻存。截取5μm颈动脉斑块组织做切片标本并进行相应的指标(斑块内脂质、胶原含量)测定,使用到的检测方法依次是油红染色检测法和天狼猩红染色法。冰冻切片室温晾片20 min,双蒸水浸泡10 min,PBS冲洗3次,每次冲洗5 min,用3%的双氧水将切片浸泡10 min,然后用PBS反复冲洗。紧接着取浓度为5%的山羊血清封存20 min后加兔抗小鼠平滑肌细胞、大鼠抗小鼠巨噬细胞、兔抗小鼠1L-1β一抗、兔抗小鼠1L-6一抗9(1∶1 000),控制温度在4℃孵育过夜。PBS冲洗3次,冲洗时间5 min/次,滴加相应的二抗,37℃孵育40 min,洗片后DAB染色Harris苏木素染核,此操作应避光。脱水透明后封片。ImaginPro Plus6.0检测显色面积,利用公式进行易损指数的计算=(m脂质+Q巨噬细胞)/(Q胶原 +Q平滑肌细胞),其中Q表示某物质的含量,进一步计算易损指数/斑块总面积。
1.3 统计学处理:采用专门进行数据处理的SPSS18.0统计学软件(IBM SPSSStatistics),计量资料采用均数±标准差(x±s)表示,比较不同试验组别相互之间的不同程度,采用单一因素的方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 慢病毒体内转染的效率:与正常对照组比较,Si-RELMβ组蛋白表达明显减少,差异有统计学意义(P<0.05);Si-NC组没有明显不同,差异无统计学意义(P>0.05)。
2.2 各组体重的变化及血脂水平的表达:各组体重、TC、TG、LDL和HDL蛋白全都没有明显不同,差异无统计学意义(P>0.05)。见表1。
2.3 REMLβ影响斑块稳定性的程度:与正常对照组相比,Si-RELMβ组内胶原和平滑肌细胞的总量明显增加,差异有统计学意义(P<0.05)。
2.4 Si-RELMβ对斑块内炎性因子表达的影响:Si-RELMβ组颈动脉斑块内IL-1及IL-6表达与正常对照组相比有显着降低,差异有统计学意义(P<0.05);SI-NC组与正常对照组相比,差异无统计学意义(P>0.05)。
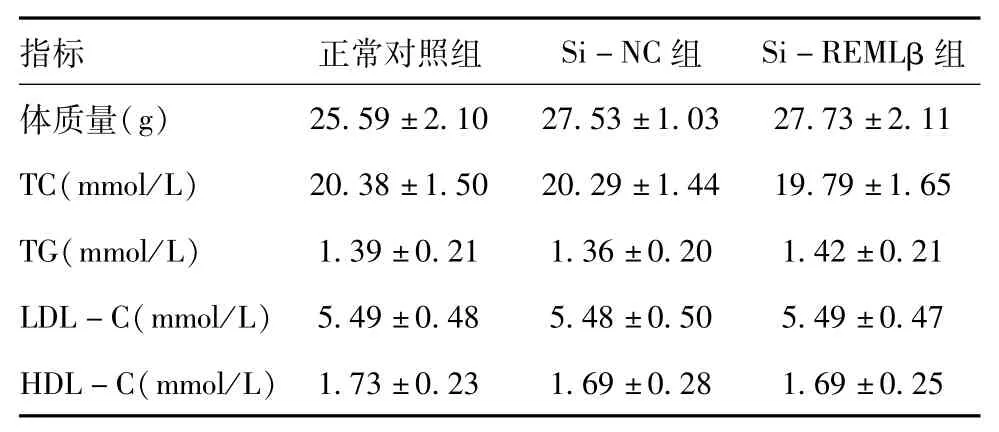
表1 各组体重、TC、TG、LDL、HDL水平比较(x±s,n=20)
3 讨论
急性冠状动脉综合征(ACS)是以一种十分常见的心血管疾病,尤其是在老年人群中多见,临床表现为起始冠状动脉粥样硬化斑块破裂,进一步转为不完全性或完全性的闭塞性血栓[8]。斑块的稳定性是由许多因素决定的,细胞外脂质池越小,炎性细胞数量越少,纤维帽越厚斑块的稳定性越高。因此,斑块内炎性反应的多少是造成斑块不稳定性的首要因素。斑块的破裂与炎性反应的发展进程关联紧密。
RELMβ广泛存在于在心肺及肾等多种器官,尤其是巨噬细胞白介素-6细胞(IL-6)等炎性反应细胞和平滑肌细胞。由此可知,RELMβ极有可能是参与动脉粥样硬化斑块炎性反应过程中的一部分,影响斑块稳定性。本实验结果显示,慢性病毒感染转为安全的时候无显着变化。Western blotting显色反应表明携带RELMβ干扰序列的慢性病毒感染后,抵抗素样分子表达显着降低,表明感染成功且干扰的效率高。利用小鼠颈总动脉套管+高脂肪喂食的方法作为研究ACS的常用模型,结果显示RELMβ被干扰后存在于颈总动脉斑块中平滑肌细胞的含量和胶原含量发生显着变化,存在大大增加的现象,而斑块内巨噬细胞及脂质含量明显减少。这说明干扰后的RELMβ能促进斑块的形成,降低斑块的易损指数。
综上所述,炎性介质是参与斑块形成的重要因素,尤其是1L-1β、1L-6是关键的炎性反应因子。既往研究发现,在消除了1L-1β、1L-6之后,ACS斑块面积以及巨噬细胞含量均显着减少足以说明1L-1β、1L-6在维持板块稳定性的重要作用。本实验显示,RELMβ干扰后的斑块中,1L-1β、1L-6蛋白的含量减少,说明RELMβ有利于易损斑块的形成。提示对ACS的防治研究可通过调节RELMβ的含量来控制斑块的稳定性。
[1] 宋 莹,许晶晶,唐晓芳,等.残余SYNTAX积分对急性冠状动脉综合征介入治疗预后分析[J].中华医学杂志,2017,97(7):502.
[2] 张 宁,朱文玲,刘晓红.衰弱与老年患者急性冠状动脉综合征的研究进展[J].中华心血管病杂志,2017,45(2):174.
[3] 吕苏花,田士宏,杨晓雪.阿托伐他汀治疗急性脑梗死患者的疗效及对血脂、超敏C-反应蛋白及颈动脉粥样硬化斑块的影响[J].中国实用医刊,2017,44(4):18.
[4] 彭文宏,陈兆芸,邓 彦.阿托伐他汀联合拜阿司匹林对缺血性脑卒中患者颈部动脉斑块的影响[J].中国实用医刊,2017,44(4):13.
[5] 闫佳兰,李 波,高利涛,等.血清抵抗素、ox-LDL及hsCRP水平与急性缺血性脑血管疾病严重程度的相关性[J].心血管康复医学杂志,2017,26(1):45.
[6] 孟凤珠,温 凯,张芙荣,等.血清抵抗素、ox-LDL及MMP-9水平与老年ACI患者颈动脉斑块的关系[J].西南国防医药,2017,27(1):29.
[7] 朱影明,许新强,周 强,等.广东地区2型糖尿病与抵抗素基因位点rs2161490和rs1423096多态性的相关性研究[J].现代检验医学杂志,2017,32(1):48.
[8] 李芳芳,张黎军.抵抗素样分子α与动脉粥样硬化关系的研究进展[J].中国糖尿病杂志,2012,4(5):304.



