李秋宇,金醒昉,朱惠容,李京辉
(1.昆明医科大学附属延安医院重症医学科,云南 昆明 650051;2.昆明医科大学附属延安医院全科医学科,云南 昆明 650051;3.昆明医科大学附属延安医院病理科,云南 昆明 650051)
脓毒症(sepsis)是由感染导致的全身炎性反应综合征(systemic inflammatory response syndrome,SIRS),可发展为脓毒性休克、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),并进一步发展为多器官功能衰竭(multiple organ failure,MOF)。在脓毒症诸多易受损器官中 ,肺脏是脓毒症是最易被攻击的靶器官 ,患者常较早并发急性呼吸窘迫综合征(acute respir‐ atory distress syndrome ,ARDS) ,是脓毒症患者死亡的主要原因之一[1]。近年来,研究发现脓毒症患者的共同病理生理特征使一系列炎性细胞被相继激活[2],炎性反应通过多种分子和细胞机制促进凝血活化,炎性反应和凝血之间的反馈作用加剧了器官功能障碍。现代研究表明,红花黄色素具有扩张血管、改善心肌供血、明显抑制ADP诱导的家兔血小板聚集[3]、抗炎作用等多种药理作用,适用于冠心病、血管栓塞性疾病、高血压、糖尿病并发症等疾病[4]。因此本实验再次深入研究脓毒症导致大鼠早期ARDS时不同剂量红花黄色素A对大鼠血清中细胞因子和肺部功能的影响,希望能给脓毒症治疗提供更多实验室依据。
1 资料与方法
1.1实验动物:本次实验经过本院医学伦理委员会同意,取健康SD大鼠195只,雌雄不拘,体重140~224 g(昆明医科大学实验动物中心提供),于实验室饲养(通风向阳,自由饮水,新鲜饲料,温度20~22℃,湿度50%~55%)。
1.2实验方法
1.2.1动物模型制备:清洁级雌雄不拘SD大鼠,体重 140~224 g。适应性饲养1周后,按照Rittirsch等报告的方法行CLP,复制严重腹腔感染致大鼠脓毒症模型[5]。术前禁食12 h,可以自由饮水。以3%戊巴比妥腹腔注射(0.12 ml/kg体重)麻醉,大鼠麻醉后,腹正中线切口,结扎暴露的盲肠根部(避免结扎回盲部肠系膜血管),用16号穿刺针贯通穿刺盲肠2次形成肠瘘,并轻轻挤压让小量大便进入腹腔。将盲肠还纳腹腔,逐层缝合腹壁切口,术毕皮下立即注射10 ml生理盐水,抗休克,给自由饮水。
1.2.2动物的分组及处理:SD大鼠195只,雌雄随机分成5个大组,细分13个小组,每组15只:正常对照组、手术组(模型组)、手术组+红花黄色素A 20 mg/kg组、手术+红花黄色素A 40 mg/kg组、手术+红花黄色素A 60 mg/kg组,后四组再按处死大鼠时间分为手术后6 h组、12 h组、24 h组三组。红花黄色素A各组于CLP后立即将注射用红花黄色素(浙江永宁药业股份有限公司,国药准字:20050148)20 mg/kg、40 mg/kg、60 mg/kg稀释至1 ml进行腹腔注射,而给予手术组等量生理盐水,继而将大鼠按相应时间点麻醉后, 经腹主动脉无菌采血,采集肺部标本。送检各项目的测试。
1.3标本采集及处理
1.3.1血标本的采集与处理:将动物按相应时间点麻醉后,经腹主动脉无菌采血,留取1 ml立即送检动脉血气分析,留取3 ml血于含有3.8%枸橼酸钠的试管内,分离血浆于-80℃保存待用。
1.3.2留取标本用动脉血气分析仪检测氧分压:用大鼠APC酶联免疫吸附法(ELISA ) [江莱化学科技(上海)有限公司]检查白介素-1β(IL-1β),肿瘤坏死因子(TNF-α),血清组织因子(TF)及组织因子途径抑制物(TFPI)。
1.3.3支气管肺泡灌洗液细胞计数分类:将支气管肺泡灌洗液离心,获得的细胞沉渣悬浮于0.2 ml盐水中,涂片,离心,瑞-吉染液染色,在40倍光镜下分类计数玻片上每200个细胞中的中性粒细胞。
1.3.4肺部病理切片制作: 大鼠处死后,立即取左下肺肺叶,取0.9%生理盐水冲洗干净血渍,放置固定液中,送本院病理实验室进行固定,脱水,浸蜡,包埋,切片,然后由病理实验室医师出片报告。

2 结果
2.1各组大鼠血清中 TNF-α、IL-1β、TF、TFPI表达含量:IL-1β:CLP各时间组、CLP+红花黄色素A低剂量6 h组、12 h组和中、高剂量6 h组较正常组升高明显,差异有统计学意义(P<0.05), CLP+红花黄色素A低剂量24 h组、中剂量12 h组、24 h组和高剂量6 h组、12 h组、24 h组较CLP相同时间组下降差异有统计学意义(P<0.05)。CLP+高剂量6 h较低低剂量6 h组下降明显 (P<0.05)。说明红花黄色素A对白介素-1β有下调作用,但低剂量组时下降不明显,反而到中-高剂量组效果才明显。见表1。
TNF-α:CLP组与红花黄色素A各剂量组较正常组明显升高,差异有统计学意义(P<0.05)。同一时间段CLP+红花黄色素A中剂量12 h组、24 h组和高剂量6 h组、12 h组、24 h组的比CLP组相同时间段比较明显下降,差异有统计学意义(P<0.05),中-高剂量组显着下降,差异有统计学意义(P<0.01),说明红花黄色素可以显着减少脓毒症时TNF-α的释放。而且与剂量有关。见表1。
TF:CLP组和CLP+红花黄色素A各剂组较正常组显着升高(P<0.05),CLP+红花黄色素A低、中剂量的12 h组,24 h组及高剂量的6 h组、12 h组、24 h组较CLP组相同时间段下降明显,差异有统计学意义(P<0.05) ,CLP+红花黄色素A相同时间段不同剂量组之间相比较,高剂量组6 h组、24 h组较低剂量相同时间段有明显差异,说明对于下调组织因子小剂量的红花黄色素A12 h就已经有效,但高剂量效果更明显。见表1。
TFPI:与正常组相较CLP+红花黄色素A各剂量组升高明显,差异有统计学意义(P<0.05), CLP+红花黄色素A各剂量12 h组、24 h组较相同时间段的CLP组升高明显,差异有统计学意义(P<0.05)。说明红花黄色素对组织因子途径抑制物有增强调节作用,在低剂量12 h就有增强作用,到24 h时增强最明显。见表1。
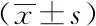
表1 各组大鼠血清中 TNF-α,IL-1β,TF,TFPI表达含量
2.2各组大鼠动脉血氧分压(mm Hg)比较:与正常组比CLP组和红花黄色素A各剂量组PaO2显着降低,差异有统计学意义(P<0.05),CLP+红花黄色素A各剂量组与CLP组相同时间段比较,血氧分压均改善,差异有统计学意义(P<0.05),CLP+红花黄色素A相同时间段不同剂量组之间相较:高剂量组较低剂量组有改善,高剂量6 h组、24 h组较低剂量组血氧分压明显改善,差异有统计学意义(P<0.05),说明低剂量的红花黄色素A已经有改善氧和的作用,只是高剂量的红花黄色素A 改善血氧含量的功效强于低剂量组。见表2。
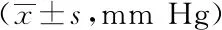
表2 大鼠动脉血氧分压
2.3各组大鼠氧合指数比较:与正常组比CLP组和红花黄色素A各剂组氧合指数显着降低,差异有统计学意义(P<0.05),CLP+红花黄色素A各剂量组与CLP组相同时间段比较氧合指数改善,差异有统计学意义(P<0.05),CLP+红花黄色素A相同时间段不同剂量组之间相较,高剂量12 h组、24 h组较低剂量组氧合指数明显,差异有统计学意义(P<0.05),说明低剂量的红花黄色素A已经有改善氧和指数的作用,只是高剂量的红花黄色素A 改善血氧含量的功效强于低剂量组。见表3。
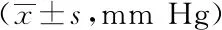
表3 大鼠氧合指数
2.4各组大鼠肺支气管肺泡灌洗液中中性粒细胞计数:与正常组比CLP组和红花黄色素A各剂组显着升高,差异有统计学意义(P<0.05),CLP+红花黄色素A各剂量组与CLP组相同时间段比较中性粒细胞计数明显减少,差异有统计学意义(P<0.05),CLP+红花黄色素A相同时间段不同剂量组之间相较,高剂量组较低剂量组有改善明,差异有统计学意义(P<0.05),说明低剂量的红花黄色素A已经有减少中性粒细胞炎性聚集是作用,只是高剂量的红花黄色素A 改善炎性反应功效强于低剂量组。见表4。

表4 大鼠肺支气管肺泡灌洗液中中性粒细胞计数
2.5各组光镜下大鼠肺组织病理表现(HE×40倍)比较:正常组肺组织病理切片肺组织结构完整清晰,肺泡壁光滑薄,肺泡间隔一致、均匀,CLP 6 h炎性病变重度、肺间质中度水肿,肺间质内及肺泡腔见中度淤血。CLP+红花黄色素A 6 h炎性病变中度、肺间质中度水肿,肺泡腔内见中-轻度淤血。CLP 12 h组炎性病变重度、肺间质中度水肿,部分肺泡腔变窄或消失,肺间质及肺泡腔内见中度淤血。CLP+红花黄色素A 12 h肺泡壁增厚、肺泡腔变窄、腔内可见炎性细胞浸润,肺间质充血、水肿,可见局部肺气肿并灶状炎性细胞浸润。CLP 24 h肺泡壁明显增厚,肺泡腔变窄或消失,肺间质增宽,腔内可见炎性细胞明显增多,肺间质水肿、充血, 可见肺气肿伴局灶性肺不张并炎性细胞弥漫性浸润,CLP+红花黄色素A 24 h组肺泡壁变薄,肺泡腔变窄,腔内可见炎性细胞浸润,肺间质充血、水肿,可见局部肺气肿并灶状炎性细胞浸润。红花黄色素A治疗后肺部组织的病变较CLP相同时间段组明显缓解。见图1。
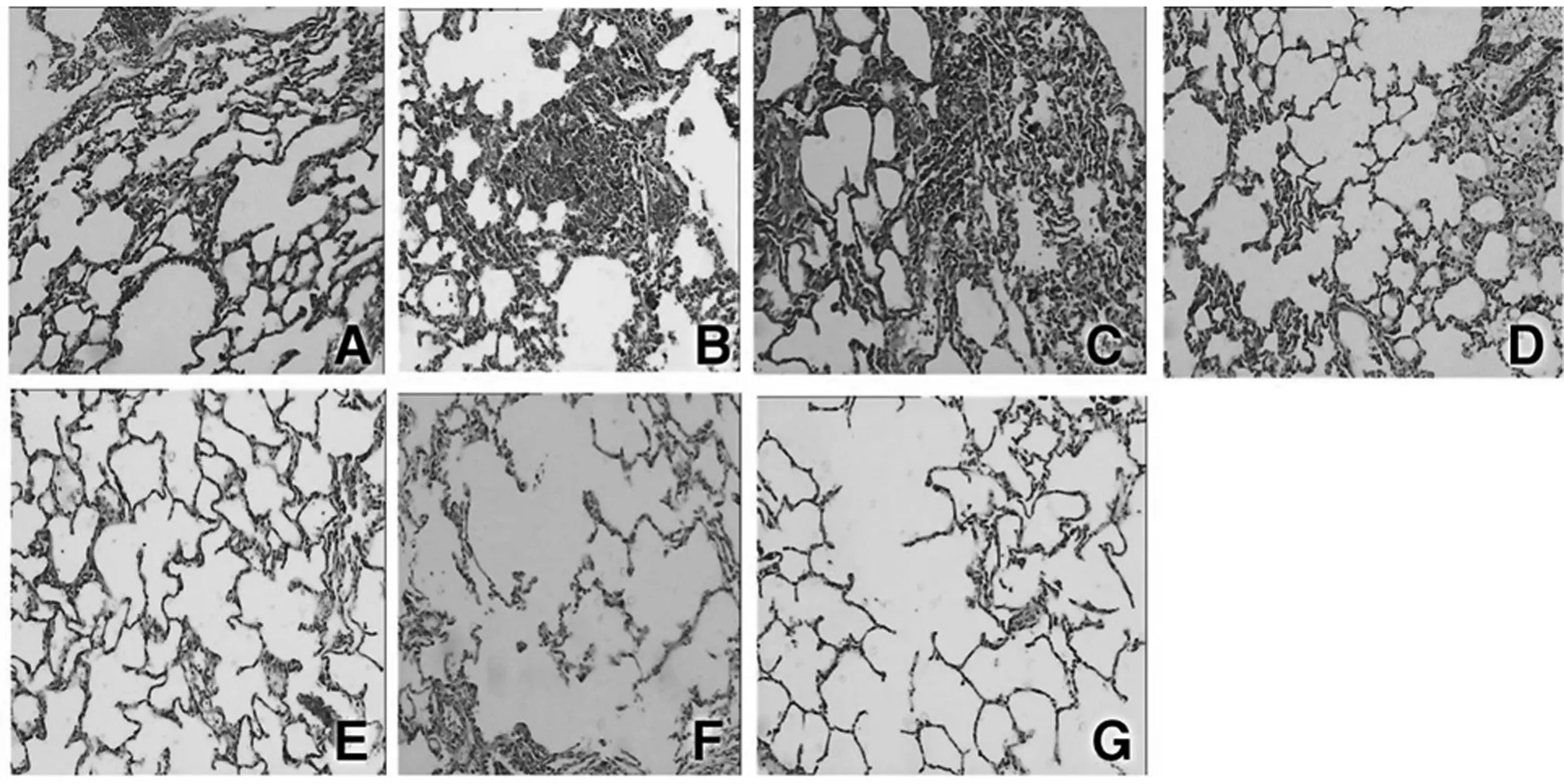
注:A:正常肺组织;B: CLP6h组肺组织;C: CLP+红花黄色素A 6 h组肺组织;D: CLP 12 h组肺组织;E: CLP+红花黄色素A 12 h组大鼠肺组织;F: CLP 24 h组肺组织;G: CLP+红花黄色素A 24 h组肺组织
3 讨论
脓毒症是临床中极为常见的一种病情凶险、病死率高的综合征。脓毒症时各炎性因子和炎性细胞共同构成一个复杂的炎性系统,相互协同或彼此拮抗,一旦机体炎性细胞免疫平衡被打破,则发生炎性介质大量释放,导致全身靶器官组织的损伤,其中首先累及的脏器是肺,最早、最常见的并发症是ALI/ARDS(急性肺损伤/呼吸窘迫综合征),也是脓毒症患者直接死亡的原因之一。既往关于脓毒症ARDS在动物实验方面进行了大量的基础研究[6],已有部分指标如TNF-α、IL-10、IL-6应用于临床,作为脓毒症ARDS早期预警生物标志物之一指导其早期诊断和治疗。近年来,脓毒症导致的急性肺损伤主要还是在积极治疗脓毒症的同时给予呼吸机机械通气治疗,但病死率仍高达30%~70%[7],因此本实验再次深入研究脓毒症导致大鼠ALI/ARDS时不同剂量红花黄色素A对肺部炎性反应的控制和肺部功能的改善,希望能给脓毒症治疗提供实验室依据。
肺部生理解剖结构显示,肺是唯一接受全部心排血量的器官 ,有着丰富的毛细血管网。肺血管内皮细胞在局部炎性反应中起着积极主动的作用,肺巨噬细胞释放一系列损伤性炎性介质,是肺局部趋化因子的主要来源,可引起中性粒细胞等在肺脏的聚集造成损伤[8],同时肺内过度活化的炎性反应,最终出现肺部广泛的渗出,肺间质及肺泡水肿,氧交换发生障碍,发生ALI /ARDS[9]。因此,在脓毒症中肺脏是最早受累的靶器官,其急性肺损伤 (ALI)出现得最早且发生率最高。
红花是中医治疗中常用的中药之一,在很多验方中都是主要成分。由红花中提取的注射用红花黄色素主要成分是红花黄色素A,现代研究发现它有降低白细胞黏滞及抗血小板集聚功能[10],故而对抗凝血和改善循环,改善器官供血[11]降血压、改善心肌缺血[12-13],降血脂[14],抑制细胞凋亡从而保护大鼠大脑缺血再灌注的损伤[15],抗氧化[16]提高机体耐受缺氧的能力[17]抗炎作用,保护脂多糖导致的大鼠急性肺损伤的炎性因子有明显的抑制作用[18]等广泛的药理作用。
本研究通过观察SD大鼠盲肠结扎穿孔(CLP)建立脓毒症模型。同时给予不同剂量的红花黄色素A注射液治疗发现,红花黄色素A可以改善大鼠脓毒症时炎性因子的表达,明显降低血清TF、IL-1β、TNF-α表达水平,使血清TFPI表达水平升高,符合之前研究[19]。同时观察到大鼠脓毒症发生ALI/ARDS时,红花黄色素治疗组大鼠肺组织的损伤较CLP组减轻,符合红花黄色素A可下调炎性因子水平的研究,说明红花黄色素可减轻脓毒症时炎性因子的促进作用,减缓器官功能障碍综合征的发生,对脓毒症时的肺损伤有保护作用,这与红花黄色素A可以抑制脓毒症大鼠肺组织的炎性因子和中性粒细胞增加的作用有明显关系。
总之,脓毒症的发病机制复杂多变,涉及多脏器,特别是一开始就伤及肺脏,可以引起炎性失控、免疫功能紊乱、凝血障碍等一系列问题,本研究结果说明,给予较大剂量红花黄色素A治疗能够显着改善脓毒症大鼠的肺功能,改善氧和指数,明显减低促炎因子的表达,增加抗炎因子的释放,并且具有保护大鼠凝血功能[19]、调节促炎/抗炎平衡、保护肺功能,故可以考虑在脓毒症早期有凝血功能障碍及ALI/ARDS时选择使用。



