马 璐,殷虎明,李 煜,谢赣生,李 纲 (苏州大学附属第一医院泌尿外科,江苏 苏州 215031)
前列腺癌(Prostate cancer,PCa)是男性常见恶性肿瘤之一,发病率和患病率的走势逐年增长[1]。前列腺特异性抗原(prostate specific antigen,PSA)的发现可使得PCa诊断的时间提早5~8年,但前列腺的良性改变也会使PSA水平升高,其特异性或灵敏度较低,特别是在PSA水平为4.0~10.0 ng/ml时,其特异性仅为25%~40%[2]。因此如何准确的对PCa的鉴别诊断显得尤为重要。
随着3.0T mp-MRI成像的广泛应用,其在PCa诊断方面的价值也日益凸显[3]。与此同时,前列腺成像报告和数据系统版本2(prostate imaging reporting and data system version 2,PI-RADS v2) 提高了磁共振对PCa 图像的判读和病变识别率[4],但PI-RADS v2评分在诊断PCa存在主观分析的局限性。
Mp-MRI中弥散加权成像(diffusion-weighted imaging,DWI)是一种功能成像技术,它可以量化组织中水分子扩散的随机布朗运动特性,而水分子弥散程度主要以表观扩散系数(apparent diffusion coefficient,ADC)值量化,通过ADC值可反应疾病的病理生理学功能性变化情况,对鉴别PCa和良性前列腺增生(BPH)有重要意义[3,5]。Manetta Rosa等人研究表明ADC值是肿瘤侵袭性的有用标志,且与Gleason评分之间存在负相关关系[6],但之前的研究大多是通过单个层面的图像获得ADC指标,不能很好地捕捉PCa的形态异质性[7]。此外有研究表明,将ADC值纳入PI-RADS v2指南,可改善mp-MRI对癌症特征的识别率[8]。
本研究通过PI-RADS v2评分对4/5分患者的全病灶ADC定量分析,探究全病灶ADC定量指标对PI-RADS v2评分4/5分患者的临床诊断价值。
1 资料与方法
1.1研究对象:自2017年8月~2018年6月苏州大学附属第一医院经直肠超声与磁共振融合(TURS-MRI)靶向前列腺穿刺患者中mp-MRI存在PI-RADS v2评分4/5分病灶的55例纳入研究。患者纳入标准:①具有2014版中国泌尿外科诊断与治疗指南中的前列腺穿刺指征;②mp-MRI PI-RADS v2评分为4/5分;③经直肠超声与磁共振融合成像靶向前列腺穿刺病理诊断。排除标准:①有MRI检查禁忌证;②图像质量不佳或图像不全,无法进行分析者;③MRI检查前进行手术、穿刺或内分泌治疗。所有患者均被病理证实为BPH或PCa,PCa患者中PI-RADS v2评分4/5分的病灶均见癌细胞且Gleason评分以所有穿刺点中的最高分。本次研究经过我院医学伦理委员会同意。
1.2仪器与方法:采用3.0TMRI(西门子Skyra)扫描和8通道腹部相控阵线圈接受信号,扫描范围包括前列腺和双侧精囊腺。各参数如下:①常规MRI:轴位T1WI、矢状位T2WI扫描、轴位FS-T2WI;②轴位FS-T2WI的扫描参数:TR4000 ms,TE89 ms,层厚3.0 mm,无间距扫描,FOV240 mm×240 mm,矩阵 256×256,NEX 1;③DWI序列扫描分为SS-EPI和RS-EPI序列b值为0、1 000 s/mm2;④SS-EPI序列:TR4500 ms,TE85 ms,FOV160 mm×296 mm,矩阵1.3×1.3×3,层厚3 mm,无螺旋扫描,分段读出13次,回波间隙0.30 ms;⑤RS-EPI序列:TR4800 ms,TE59、95 ms,FOV160 mm×296 mm,矩阵1.3×1.3×3,层厚3 mm,无间距扫描,分段读出次数13次,回波间隙0.30 ms。根据T2、DWI和ADC图确定病灶位置及层面,提取所有层面病灶每个像素ADC值,计算第25百分位(P25)ADC值、第75百分位(P75)ADC值、平均ADC值和中位ADC值,根据病理结果分为前列腺癌组(PCa组)和良性病灶组(BPH组)。
1.3图像分析及数据处理:由两名经验丰富的放射科医师严格按照PI-RADS v2评分系统进行评分筛选出符合标准的患者,将患者所有的ADC图像以DICOM格式导入Onis 2.5 Free Edition软件中,选中包含病灶区域的图像并将其导出保存为无压缩的DICOM文件。利用ImageJ软件[9],勾画出每张ADC病灶图像(见图1C、图1F),导出此每层病灶区域中所有像素的ADC值,用SPSS25.0计算全病灶ADC值的P25ADC值、P75ADC值、平均ADC值、中位ADC值、峰度、偏度。
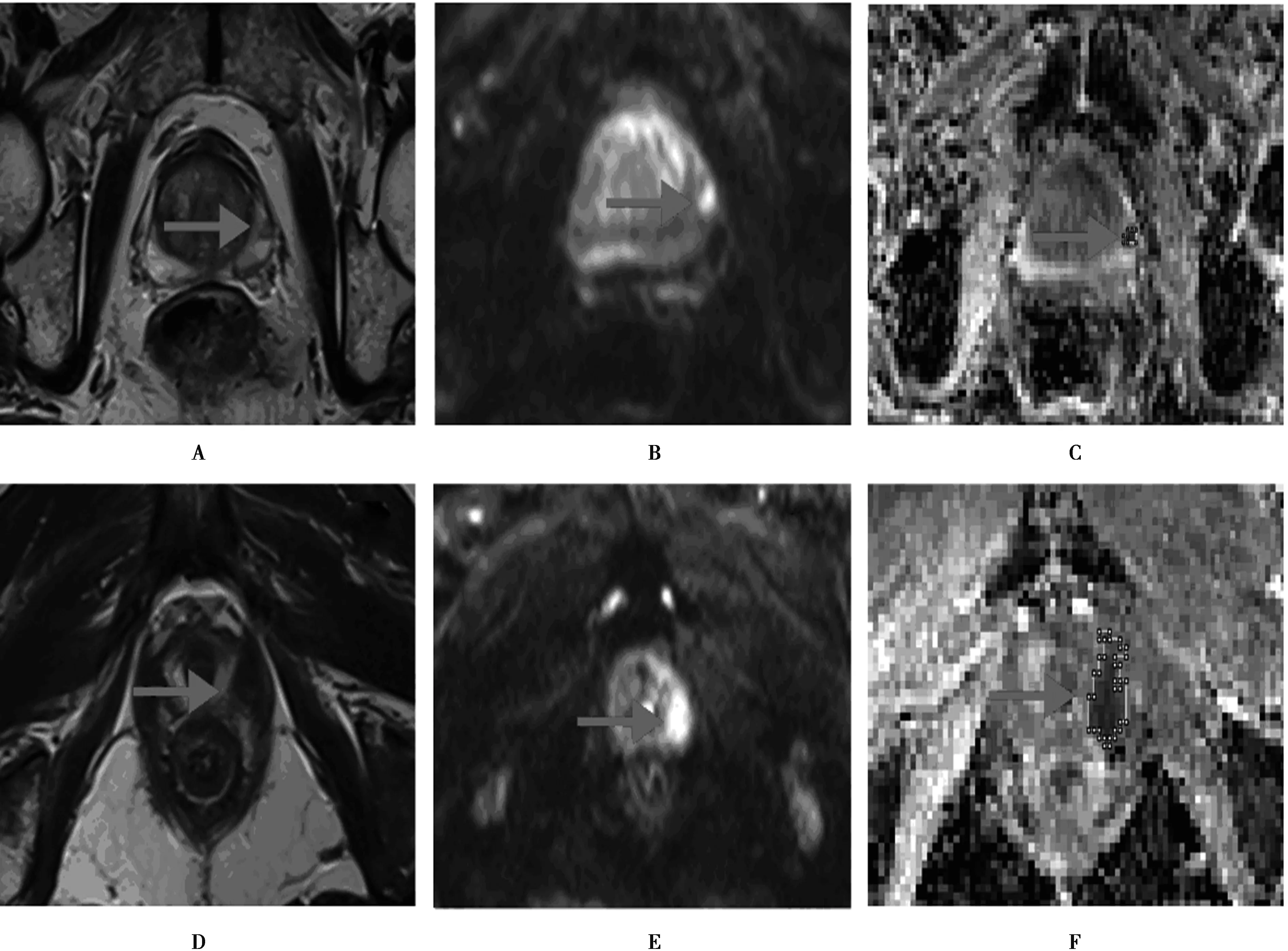
图1 图A、图B、图C为BPH患者MRI图像;图D、图E、图F为PCa患者MRI图像;图A及图D:T2WI上左侧外周区局灶性、边界清楚的低信号结节;图B及图E:DWI上的明显高信号;图C及图F:ADC图上明显低信号
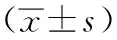
2 结果
2.1病理结果与评分:所有病例均行穿刺活检,病理标本使用10%福尔马林固定,并用石蜡包埋切片,行常规HE染色,由资深病理科医师进行读片,得出BPH组7例,PCa组48例。对诊断为PCa的病例进行Gleason评分。其中,GS=6分3例;GS=7分19例;GS≥8分26例。
2.2PCa组和BPH组的参数统计分析:通过SPSS25.0软件计算得出PCa组P25ADC值、P75ADC值、平均ADC值、中位ADC值均低于BPH组,差异有统计学意义(P<0.05)。PCa组的年龄、峰度、偏度、病灶体积和前列腺体积与BPH组比较差异无统计学意义(P>0.05)。见表1。PSA的曼-惠特尼检验结果:PCa组PSA大于BPH组,差异有统计学意义(Z=-3.343,P<0.05)。
表1 PCa组与BPH组参数比较
2.3ROC曲线分析:ROC曲线结果分析显示,P25ADC值、P75ADC值、平均ADC值、中位ADC值的AUC分别是77.70%、78.60%、81.30%、81.00%。其中平均ADC值的AUC最大,诊断PCa效能最高,当约登指数最大时,得出诊断PCa的截点值为0.89×10-3mm2/s,此时,诊断PCa的敏感度、特异度分别为60.4% 和100%。见图2、表2。
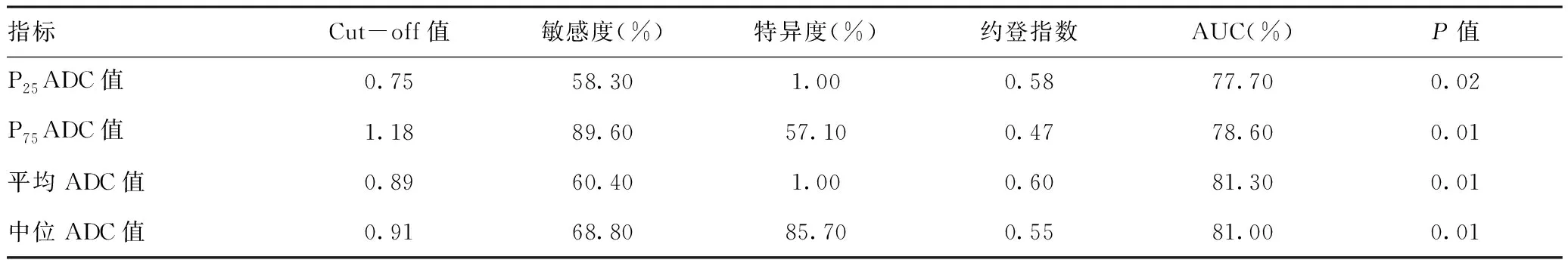
表2 全病灶ADC指标诊断PCa的效能分析
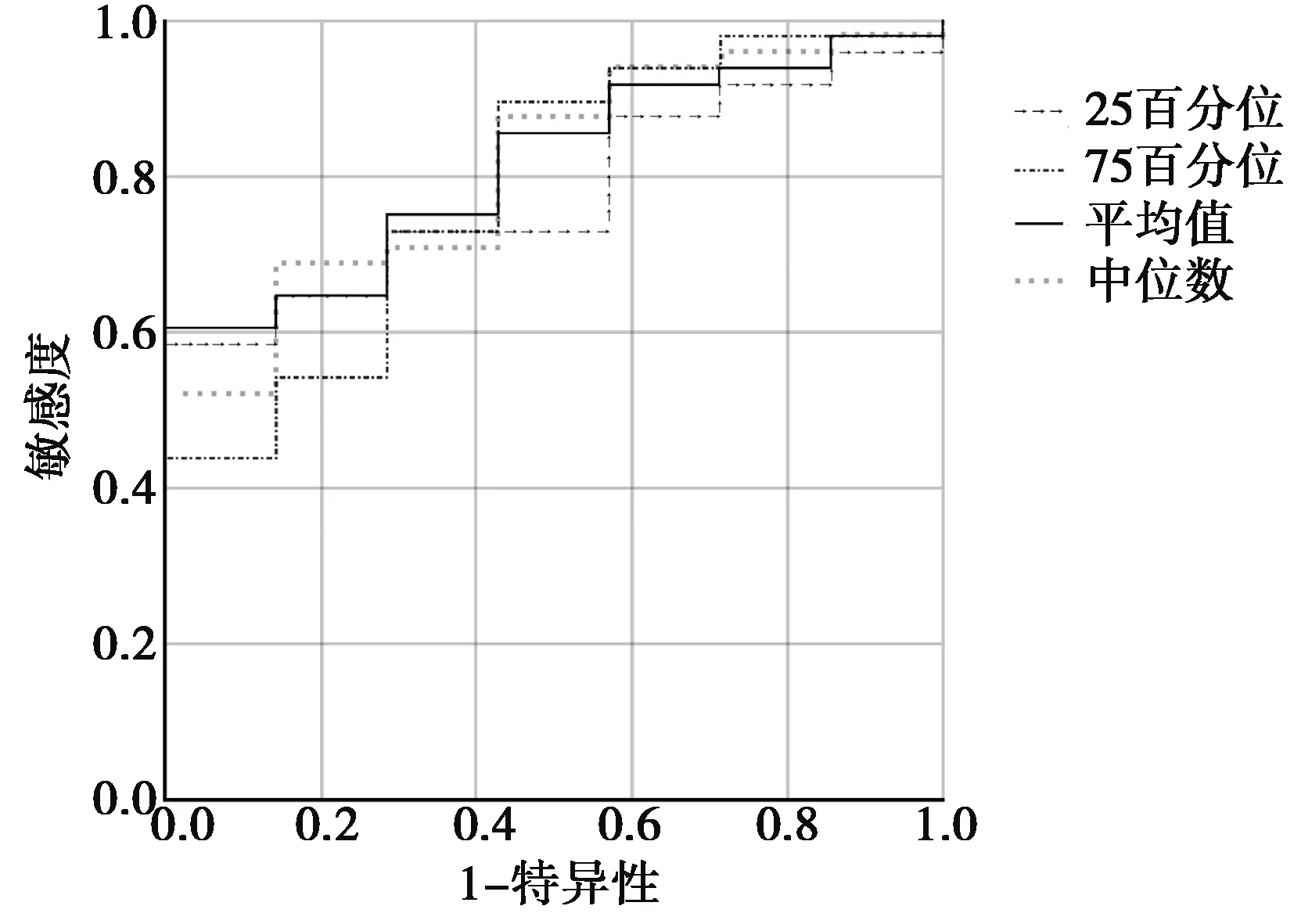
图2 ADC指标诊断PCa的ROC曲线
3 讨论
近年来我国PCa的发病率呈明显上升趋势,因PCa和BPH的早期临床症状十分类似,但治疗方案却大相径庭,而提高PCa的早期诊断率可以提高患者的生存率,因此PCa和BPH的鉴别是临床的关注焦点。前列腺mp-MRI图像可反映前列腺及其病变的侵袭信息,并具备定位病灶和预测生物学行为等能力,被公认为是PCa临床检查的最重要方法[10]。全病灶ADC定量分析是在PI-RADS v2评分的基础上对其空间分布的特征研究和像素的数学分析,通过量化的病灶参数进一步对PCa进行诊断,其优势还在于不依赖影像医师的主观判断,观测结果更为客观。
本研究中PCa组的P25ADC值、P75ADC值、平均ADC值、中位ADC值均低于BPH组,差异有统计学意义(P<0.05)。平均ADC值的AUC最大,诊断PCa的效能最高,这可能是因为由于PCa病灶的异质性组织学特征所致,平均ADC值比P25ADC值、P75ADC值、中位ADC值代表的范围更加集中,能更好的鉴别PCa和BPH[7,11]。
本研究中PCa组的全病灶各ADC值均低于BPH组,与宋志强等先前的研究相一致[12]。这可能因为前列腺组织恶变后向更坚实、高密度的结构变化,组织内自由水分子运动受到限制[13]。BPH患者的组织内水分子的扩散运动受限程度虽高于正常前列腺软组织,但是明显低于PCa。其原理是正常腺体和间质被肿瘤组织替代,且癌细胞具备繁殖速度快、排列周密、细胞外间隙小、核质比大的特点,因此癌灶的水分子扩散程度和方向受限,DWI呈高信号,ADC值越低[14]。
先前许多研究已经评估了ADC值对PCa的诊断价值,但传统研究都是通过单层面图像来选取感兴趣区域的ADC指标。在其他组织中的成像研究已经证明了使用基于整个病变体积的方法测量ADC值的重要性,除了提供整个肿瘤的更完整的表示之外,这也便于计算更高级的度量来反映整体病变的纹理和不均匀性[15-16]。在我们的研究中,ADC指标是从包含覆盖整个PIRADS v2评分4/5分病灶的所有ADC图像中确定的,此分析方法可能更好地揭示肿瘤内的异质性,并改善临床评估。
本研究通过对全病灶ADC值的定量分析可更好的辅助PI-RADS v2评分鉴别PCa和BPH,为临床的诊断和治疗提供帮助。平均ADC值诊断PCa的效能优于其他ADC指标,提示全病灶平均ADC值对PI-RADS v2评分4/5分病灶的辅助诊断价值值得扩大样本进一步研究。尽管病灶定位严格根据PI-RADS v2评分选定,但不排除手动勾画全病灶区域时因主观因素所产生的偏差,且BPH组病例相对较少,因此如何降低人工勾画全病灶造成的主观偏差并扩充样本量是后期研究继续探索的方向。



