王旭升,王石枫,刘荣梁,刘新海
(赣州市第五人民医院肝胆外科,江西 赣州 341000)
原发性肝癌在赣州市第五人民医院国的发病率呈现逐年增长的趋势,且恶性程度高,早期症状不明显,临床症状往往与病变程度不相符,患者确诊时病变大多已发展为中后期[1],因此,原发性肝癌术后预后较差,其5年生存率低于10%[2]。因此,原发性肝癌的早期诊断治疗对改善患者预后、提高患者生存质量至关重要。据调查,约50%原发性肝癌患者切除术出现肝外转移[3],且肝外转移较肝内复发更难发现,是导致其术后生存时间缩短的重要诱因,但目前仍缺乏早期评估策略。基于此,本次研究旨在分析血清相关生化指标水平与原发性肝癌患者腹腔镜肝切除术治疗预后的相关性,为原发性肝癌腹腔镜肝切除术治疗预后评估提供参考。
1 资料与方法
1.1一般资料:回顾性分析在赣州市第五人民医院行腹腔镜肝切除术的72例原发性肝癌患者的临床资料,根据患者术后2年内是否复发分为预后不良组(复发或转移,n=32)和预后良好组(未复发,n=40)。纳入标准:①符合原发性肝癌诊断标准[4];②符合手术指征并已接收手术治疗;③临床资料完整。排除标准:①合并其他恶性肿瘤者;②确诊为继发性肝癌者;③存在心肺功能不全者。
1.2方法
1.2.1资料采集方法:统计并比较所有患者性别、年龄、肝炎史、HBsAg状态、肿瘤直径、肿瘤数目、包膜完整性、肿瘤分化程度、TNM分期、血管侵犯等临床资料。比较两组患者入院时血清MIF、AFP水平。
1.2.2指标检测方法:所有患者入院时均空腹状态下采集外周静脉血一次,以3 500 r/min速度离心后,取上层血清并置于-80 ℃环境下保存,分别采用血清巨噬细胞移动抑制因子(MIF)和甲胎蛋白(AFP)对应试剂盒测量其水平,具体操作如下:血清样品10倍稀释后,于酶标板样品孔中加入100 μl血清样品,空白孔中加入等量稀释液,室温下放置于培养箱内孵育1 h,随后洗板5次,然后分别在样品孔和空白孔加入50 μl酶标记溶液,摇匀后室温下孵育1 h,随后清洗液洗板4次,每次静置15 s,室温避光孵育0.5 h进行显色反应,随后每孔加终止液50 μl,终止反应,于波长450 nm的酶标仪上读取各孔液体吸光度,绘制标准曲线,根据标本曲线及回归方程计算MIF和AFP浓度。
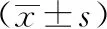
2 结果
2.1两组临床资料比较:预后不良组与预后良好组在肝炎史、HBsAg状态、肿瘤直径、肿瘤数目、包膜完整性、肿瘤分化程度、TNM分期和血管侵犯上差异有统计学意义(P<0.05),其中预后不良组肝炎史、HBsAg阳性、肿瘤直径>5 cm、肿瘤多发、肿瘤高分化、存在血管侵犯例数较预后良好组显着更多,差异有统计学意义(P<0.05),而肿瘤分期处于Ⅰ期和Ⅱ期以及存在完整包膜例数较预后明显更少,差异有统计学意义(P<0.05);两组年龄和性别比较,差异无统计学意义(P>0.05)。见表1。
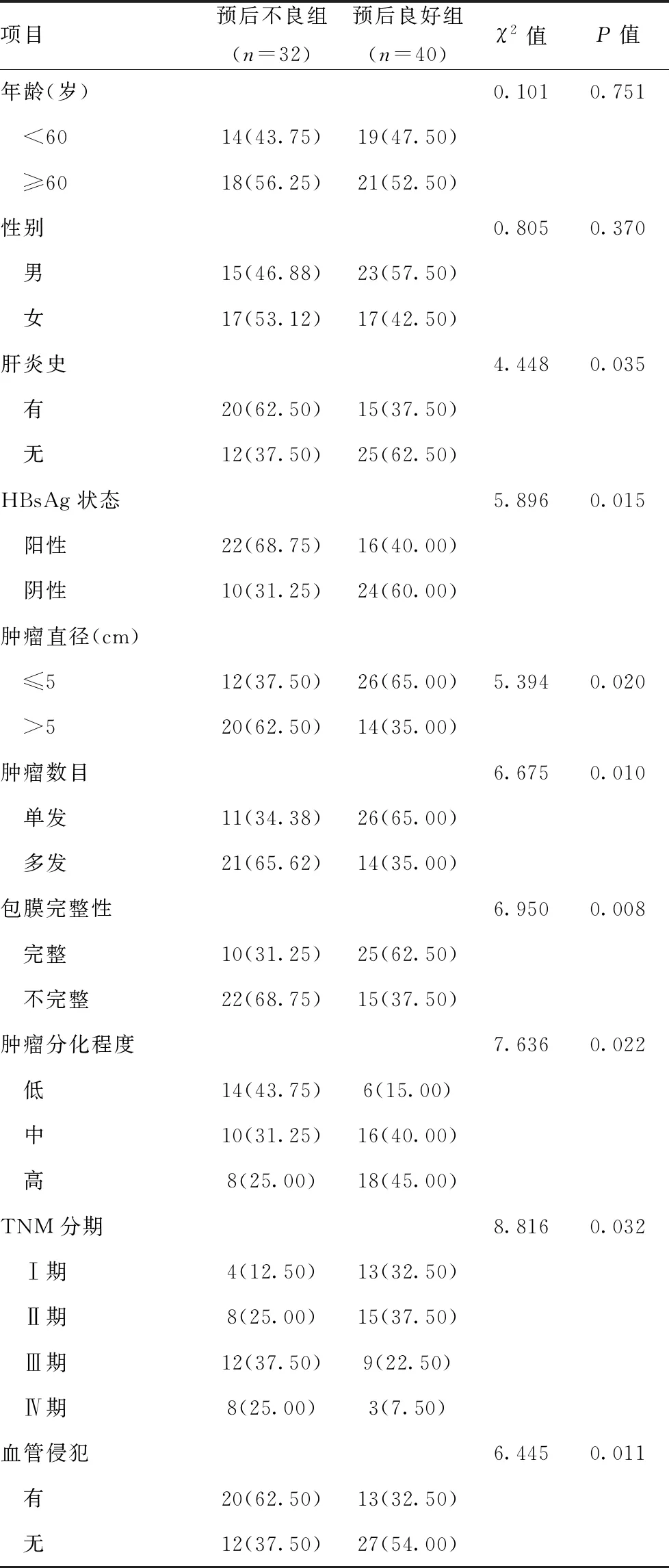
表1 两组临床资料比较[n(%)]
2.2两组入院时血清MIF、AFP水平比较:预后不良组入院时血清MIF、AFP水平均较预后良好组显着更高,差异有统计学意义(P<0.05)。见表2。
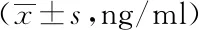
表2 两组入院时血清MIF、AFP水平比较
2.3入院时血清MIF、AFP水平与原发性肝癌腹腔镜术治疗预后的关系:经Logistic回归分析可得,入院时血清MIF、AFP水平均是影响原发性肝癌腹腔镜切除术治疗预后的独立影响因素,差异有统计学意义(P<0.05)。见表3。
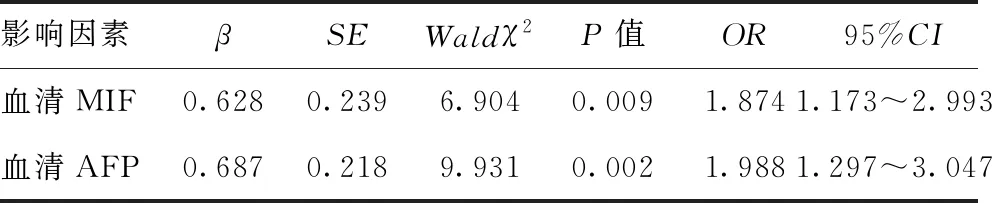
表3 入院时血清MIF、AFP水平与原发性肝癌腹腔镜术治疗预后的Logistic回归分析
2.4预测效能分析:ROC曲线显示,入院时血清MIF、AFP预测原发性肝癌腹腔镜肝切除术治疗预后的截断值分别为80.40 ng/ml、352.66 ng/ml,敏感度分别为78.12%、78.12%,特异度分别为87.50%、77.50%。见表4和图1。
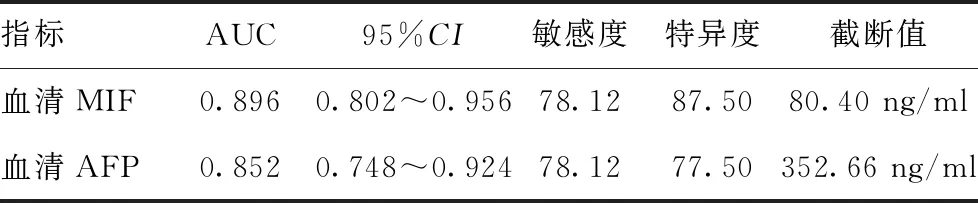
表4 ROC曲线参数

图1 血清AFP、MIF的ROC曲线
3 讨论
原发性肝癌的发病率较高且预后较差,近年来,随着我国医疗技术的发展,原发性肝癌患者的生存率明显提高。但该疾病的发病率仍处于逐年增长的状态,故原发性肝癌的生存率未能显着改善。目前其主要的治疗方式是手术切除,多数患者术后易复发,不仅对患者生命健康和生存质量造成严重威胁,还造成了巨大的医疗资源消耗[5]。因此,能够对原发性肝癌术后预后进行准确的评估和预测对患者的治疗、预后和延长生存期限都具有十分重要的意义。
此前有学者提出,乙型肝炎病毒和丙型肝炎病毒是原发性肝癌的主要病因[6]。本次研究结果显示,肝炎病史与原发性肝癌患者腹腔镜术后治疗预后效果关系密切。相关研究表明,积极控制肝炎可降低原发性肝癌发病率,有利于早期原发性肝癌的预防和诊治[7]。本次研究表明肿瘤直径和肿瘤数目是影响原发性肝癌患者术后预后的因素。此前有研究表明,单发肿瘤较多发肿瘤拥有更理想的预后[8],这与本次研究结果相符。除此之外,本次研究还发现包膜完整性、肿瘤分化程度、血管侵犯和TNM分期均是影响原发性肝癌肝切除术治疗预后的单因素。
MIF是由单核细胞、T淋巴细胞等免疫细胞产生的非糖基化蛋白质类物质,可抑制巨噬细胞游走,进而阻碍其吞噬细胞功能[9]。近年来有学者提出,MIF具有促使肿瘤进展的作用[10]。该物质可使机体抑癌基因p53失活[11],机体对肿瘤细胞的抑制作用减弱,同时肿瘤细胞不断再生促进肿瘤形成,此外,该物质还通过对环氧合酶-2的调节进而发挥对同源T细胞的抑制作用,故MIF在肿瘤发展中具有明显的促进作用。陈其冰等学者提出,在肿瘤环境下,肿瘤细胞也可产生MIF[12]。本次研究结果表明预后不良组MIF水平显着高于预后良好组,可能是由于MIF对肿瘤细胞具有促进作用,其水平升高预示着肿瘤细胞增殖速度处于高水平,肿瘤发生转移、血管浸润等可能性增大,故预后较差。经Logistic回归分析可知入院时MIF水平是原发性肝癌肝切除术治疗预后的独立影响因素,且经ROC曲线显示,AUC为0.896,截断值为80.40 ng/ml,提示原发性肝癌患者腹腔镜肝切除术后预后越高MIF水平越低,当患者入院血清MIF超过80.40 ng/ml时,临床应引起高度重视。除此之外,MIF水平还可诱导产生IL-8,进而加重机体免疫变态反应,对机体预后十分不利[13]。
AFP是一种糖蛋白,在胚胎发育过程中,肝细胞会产生大量AFP,胎儿出生后,AFP合成即停止,其含量会随胎儿的生长逐渐减少,故生理状态下正常人血清AFP水平不超过20 ng/ml[14]。当肝细胞或生殖细胞发生癌变时,肝细胞会出现“返祖现象”,合成AFP的能力被激活[15],当AFP水平超过400 ng/ml时,提示极有可能发生原发性肝癌[16]。AFP是诊断原发性肝癌的特异性临床指标,与肝癌的发生密切相关。此前有学者[17]表明,AFP不仅能促进肿瘤细胞增殖,还能改变T淋巴细胞亚群的分泌水平,进而抑制免疫系统,故血清中AFP呈高水平提示原发性肝癌肿瘤的病情较严重且术后复发可能性极大。本次研究结果显示原发性肝癌患者腹腔镜肝切除术后预后越好,AFP水平越低。经Logistic回归分析可知入院时AFP水平可独立影响原发性肝癌肝切除术治疗的预后情况,且ROC曲线显示AUC为0.852,截断值为352.66 ng/ml,可用于早期评估原发性肝癌患者腹腔镜肝切除术治疗预后情况,为早期治疗提供参考依据。在临床治疗中,对于MIF和AFP异常升高的原发性肝癌患者,在行腹腔镜肝切除术前,应积极行保肝护肝对症治疗,待上述指标降低并控制在平稳状态下,再行手术切除治疗,有助于改善患者肝切除治疗预后水平。
综上所述,入院时血清MIF、AFP水平与原发性肝癌腹腔镜肝切除术后预后情况关系密切,可用于早期对该疾病患者进行预后评估,对提高患者生存率和改善患者预后具有重要意义。



