杨涌涛 金戈 李鑫 郑方硕 黄莹 展群岭
摘要:目的 探讨急性缺血性卒中患者静脉溶栓后脂质代谢与出血转化的关系。方法 回顾性分析2016年3月~2019年1月我院神经内科收治的急性缺血性卒中重组组织型纤溶酶原激活剂(rt-PA)静脉溶栓患者57例。溶栓后2 h和24 h分别行颅脑CT检查,收集患者的人口学资料(性别、年龄等)及脂质代谢相关指标。单因素分析是否发生出血转化患者上述指标的差异,利用ROC曲线将单因素分析中有意义的影响因素作为溶栓后出血转化预测因素进行分析。结果 ①接受静脉溶栓治疗后12例患者发生出血性转化,45例未发生出血转化,出血性转化发生率为21.05%;②单因素分析结果显示,出血转化患者静脉溶栓前基线血清脂蛋白a水平未发生出血转化患者,差异有统计学意义(P<0.05);③血清脂蛋白a预测出血转化的ROC曲线分析提示溶栓后发生出血转化的最佳分割点是114.50 mg/L,敏感性为64.40%,特异性为75.00%,曲线下面积为0.701(95%CI:0.555~0.847),入院时Lp(a)水平≥ 114.50 mg/L的患者出血转化率(9.38%)低于Lp(a)水平在0~114.50 mg/L的患者(36.00%),差异有统计学意义(P<0.05)。结论 缺血性脑卒中rt-PA 静脉溶栓前基线血清脂蛋白a水平降低是出血转化的危险因素,针对血脂成分合理用药,调整脂代谢异常,预防和减少脑梗死后静脉溶栓出血转化的发生。
关键词:脑梗死;溶栓;出血转化;危险因素;脂蛋白a
中图分类号:R743.3 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.14.024
文章编号:1006-1959(2019)14-0075-03
Abstract:Objective To investigate the relationship between lipid metabolism and hemorrhagic transformation after intravenous thrombolysis in patients with acute ischemic stroke.Methods A retrospective analysis of 57 patients with acute ischemic stroke and recombinant tissue plasminogen activator (rt-PA) intravenous thrombolysis was performed in our department of neurology from March 2016 to January 2019. CT scans were performed at 2 h and 24 h after thrombolysis, and demographic data (gender, age, etc.) and lipid metabolism related indicators were collected. Univariate analysis was performed to determine whether there was a difference in the above-mentioned indicators in patients with hemorrhagic transformation. The ROC curve was used to analyze the significant influencing factors in the single factor analysis as predictors of hemorrhagic transformation after thrombolysis. Results ①After intravenous thrombolysis, hemorrhagic transformation occurred in 12 patients, and 45 patients did not undergo hemorrhagic transformation. The incidence of hemorrhagic transformation was 21.05%.②Univariate analysis showed that patients with hemorrhagic transformation had no statistically significant changes in baseline serum lipoprotein a levels before intravenous thrombolysis (P<0.05).③The ROC curve analysis of serum lipoprotein a predicting hemorrhagic transformation suggests that the optimal segmentation point for hemorrhagic transformation after thrombolysis is 114.50 mg/L,sensitivity is 64.40%, specificity is 75.00%, and the area under the curve is 0.701 (95%CI):0.555~0.847), the bleeding conversion rate (9.38%) of patients with Lp(a) level ≥ 114.50 mg/L at admission was lower than that of patients with Lp(a) level between 0 and 114.50 mg/L (36.00%),the difference was statistically significant (P<0.05).Conclusion The decrease of serum serum lipoprotein a level in rt-PA before thrombolysis is a risk factor for hemorrhagic transformation. It is a rational use of blood lipid components to regulate abnormal lipid metabolism and prevent and reduce the conversion of intravenous thrombolytic hemorrhage after cerebral infarction.
Key words:Cerebral infarction;Thrombolysis;Hemorrhagic transformation;Risk factors; Lipoprotein a
脑卒中(cerebral stroke)的全球发病率约为258/10万,目前已成为全球范围的首要致残原因和第二大致死原因[1]。急性缺血性卒中(acute ischemic stroke,AIS)占全部卒中的60%~80%[2],重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓是脑梗死患者的临床首选治疗措施,出血转化(hemorrhagic transformation,HT)是溶栓治疗后一种常见并发症,一般发病于溶栓后24 h内,对患者临床疗效及预后效果均造成了不利影响,严重者可加重脑梗死病情并导致患者死亡[3]。脑梗死后出血转化患者血脂异常的发生率较高,说明脂代谢异常会增加脑梗死后发生出血转化的可能性[4]。目前溶栓后出血转化与脂质代谢的关系研究较少,是否存在相关性并不明确。本文将探索血脂水平在预测急性脑梗死患者rt-PA静脉溶栓后发生HT的应用价值。
1资料与方法
1.1一般资料 回顾性分析2015年12月~2019年1月于中国科学院大学重庆仁济医院/重庆市第五人民医院神经内科收治的AIS患者57例,均接受rt-PA静脉溶栓治疗。本研究经我院伦理委员会审批通过,患者或患者家属签署知情同意书。纳入标准:①首次出现AIS;②静脉溶栓前行颅脑CT检查排除颅内出血;③符合2017年中国卒中学会关于AIS静脉溶栓治疗入选标准[5]。排除标准:①舒张压>100 mmHg,收缩压>180 mmHg;②发病时间>4.5 h;③桥接机械取栓等血管内治疗的患者。
1.2方法 对符合入选标准的急性脑梗死患者予以0.9 mg/kg的rt-PA静脉溶栓治疗,其中10%在1~2 min内静脉推注,其余90%于60 min内持续静脉滴注。溶栓后2 h和24 h分别行颅脑CT检查,根据有无HT将其分为出血转化和未发生出血转化患者。收集如下临床资料:①人口学资料(性别、年龄等);②实验室指标:溶栓前基线甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C),血清脂蛋白a [Lp(a)]。比较患者上述指标的差异,利用ROC曲线对溶栓后出血转化预测因素进行分析。
1.3统计学方法 本次实验数据采用SPSS 19.0统计学软件分析数据,计数资料使用[n(%)]进行描述,比较采用?字2检验或Fisher精确检验;计量资料以M(Pmin,Pmax)或者(x±s)描述,采取t检验或秩和检验。利用ROC曲线对单因素分析中有意义的影响因素作为溶栓后出血转化预测因素进行分析,使用Youden 指数(灵敏度+特异度-1)选择最佳分割点,以该最佳分割点为界对患者进行分割,?字2检验比较两组预后良好的比率。P<0.05为差异有统计学意义。2 结果
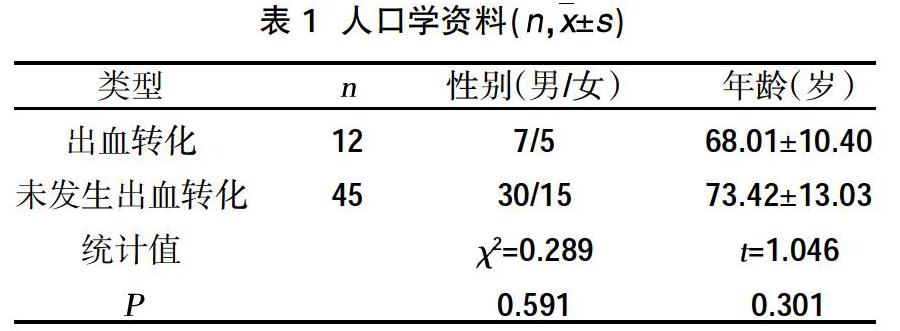
2.1人口学资料 57例脑梗死患者接受静脉溶栓治疗后发生出血性转化12例,未发生出血转化45例,出血性转化发生率为21.05%。其中转化与未发生出血转化患者性别、年龄比较,差异无统计学意义(P>0.05),见表1。
2.2单因素分析 出血转化患者TG、TC、LDL-C、HDL-C与未发生出血转化患者比较,差异无统计学意义(P>0.05);溶栓前基线Lp(a)数据呈非正态分布,出血转化患者Lp(a)水平较未发生出血转化患者低,差异有统计学意义(P<0.05),见表2。
2.3 Lp(a)预测溶栓后出血转化的ROC曲线分析 入院时基线Lp(a)水平预测溶栓后发生HT的最佳分割点是114.50 mg/L,敏感性为64.40%,特异性为75.00%,曲线下面积为0.701(95%CI:0.555~0.847)。入院时Lp(a)水平≥ 114.50 mg/L的患者出血转化率(9.38%)低于Lp(a)水平在0~114.50 mg/L的患者(36.00%)(?字2=5.986,P=0.022),见图1。
3讨论
众所周知,高脂血症是脑血管病重要的危险因素,但溶栓后出血转化与脂质代谢的相关性并不明确。张冠壮[6]研究表明,脑梗死后出血转化组LDL-C水平较非转化组明显降低。越来越多的研究[7]证明,血脂过低,尤其是LDL-C水平过低会增加脑出血风险。目前LDL-C低水平引起脑出血的机制尚不明确,推测低水平的低密度脂蛋白导致血管内皮功能降低,继而引起中层平滑肌的坏死,血管壁抗破裂强度下降[8]是引起脑出血的原因。
Lp(a)是一种特殊的LDL,包括1个LDL-C核心和1个载脂蛋白(a),两者之间通过载脂蛋白B100连接而成[9]。Hong XW[10]等研究发现急性缺血性卒中患者NHISS得分、梗死面积均与Lp(a)相关,且卒中再发患者中Lp(a)显着升高。Beheshtian A[11]等提出Lp(a)血清水平升高是中青年缺血性卒中的独立危险因素。与此研究类似,有Meta分析[12]提出Lp(a)是缺血性卒中的独立危险因素,且这种相关性在年轻人群(<55岁)中更为明显,与卒中亚型相关,是否受到性别的影响尚不明确,有待后续更多的数据分析。目前认为Lp(a)能通过氧化磷脂发挥较强的致动脉粥样硬化作用[13]。除此之外,Lp(a)内部的载脂蛋白(a)成分能竞争性抑制纤维蛋白原与纤维蛋白结合,抑制纤维蛋白原的激活,抑制血块溶解,还能促进血小板聚集,刺激内皮细胞释放纤溶酶原激活物抑制剂,促进血栓形成;通过组织因子途径抑制物的作用,促进外源性凝血[14]。樊敬峰[15]研究结果显示脑梗死静脉溶栓前Lp(a)即处于很高水平,提示高Lp(a)血症为脑梗死的独立危险因素。此外,还有研究发现脑梗死rt-PA静脉溶栓后1 h、2 h时Lp(a)即明显升高,静脉溶栓后24 h Lp(a)较溶栓后1 h、2 h 明显下降,但依然高于静脉溶栓前水平。其可能机制为Lp(a)中的载脂蛋白A,结构上与纤溶酶原高度相似,可与纤维蛋白原竞争结合。Rt-PA、纤溶酶原和Lp(a)相互作用,血Lp(a)水平即明显增高,提示静脉溶栓影响脂质代谢过程[9]。
本研究结果显示,Lp(a)在发生出血转化的患者中表达较未发生出血转化患者中低,以114.50 mg/L作为最佳分割点,当Lp(a)<114.50 mg/L时出血转化率明显增加,提示随着Lp(a)水平降低,溶栓后出血转化的风险相应增加。推测其发生的机制如下:脑梗死静脉溶栓后rt-PA药物、凝血系统、纤溶系统以及脂质代谢四者相互作用,均发生了一定的变化。此时Lp(a)与纤维蛋白原竞争结合,影响了凝血和纤容系统的平衡,可能是导致出血的原因,有待进一步的大样本及多中心研究加以证实。
本研究存在的不足之处:①本研究的研究对象仅有少量患者发病时检测了载脂蛋白A和载脂蛋白B的变化,所以并未收集到完整的脂质代谢的相关数据,在以后的研究中需要增加这两项指标的检测;②本研究属于单中心、回顾性研究,样本量相对有限,因此需要未来开展多中心的大样本研究来对进一步证实以上的结论。
综上所述,溶栓前基线Lp(a)是发生出血转化的危险因素之一,可以用来预测脑梗死溶栓后出血转化的风险。对于Lp(a)<114.50 mg/L的患者应严格掌握静脉溶栓时机及适应证,密切观察患者静脉溶栓治疗后出血情况,以降低出血性转化发生率。
参考文献:
[1]Küpper C,Heinrich J,Müller K,et al.Acute stroke[J].MMW Fortschr Med,2019,161(Suppl 1):22-31.
[2]华孙英,袁菲菲,朱金京.流程再造在急性缺血性脑卒中救治体系中的应用[J].中国卫生标准管理,2018,9(13):38-42.
[3]赵振国,赵晓晖,隋海晶,等.不同时间窗脑梗死溶栓后颅内出血及对预后的影响[J].昆明医科大学学报,2014,35(5):74-77,84.
[4]蔡洁丹,唐万兵,郑楚忠,等.脑梗死患者溶栓治疗前后血脂和凝血功能参数变化[J].中国医药科学,2016,6(7):29-33.
[5]中国卒中学会科学声明专家组.急性缺血性卒中静脉溶栓中国卒中学会科学声明[J].中国卒中杂志,2017(12):267-284.
[6]张冠壮.脑出血转化与总胆固醇、低密度脂蛋白及高密度脂蛋白的相关性[J].实用临床医药杂志,2016,20(11):18-20.
[7]孙俊启,汪青松,范崇桂,等.血脂代谢状况对缺血性卒中患者脑出血转化的影响[J].广东医学,2015,53(11):1717-1719.
[8]陈育华,张丽娜,许力,等.出血性转化对急性缺血性卒中患者转归的影响[J].国际脑血管病杂志,2010,18(9):650-653.
[9]Hoover-Plow J,Huang M.Lipoprotein(a)metabolism:potential sites for therapeutic targets[J].Metabolism,2013,62(4):479-491.
[10]Hong XW,Wu DM,Lu J,et al.Lipoprotein(a)as a predictor of early stroke recurrence in acute ischemic stroke[J].Mol Neurobiol,2016,53(1):1-9.
[11]Beheshtian A,Shitole SG,Segal AZ,et al.Lipoprotein(a) level,apolipoprotein(a) size,and risk of unexplained ischemic stroke in young and middle-aged adults[J].Atherosclerosis,2016(253):47-53.
[12]Nave AH,Lange KS,Leonards CO,et al.Lipoprotein(a)as a risk factor for ischemic stroke: a meta-analysis[J].Atherosclerosis,2015,242(2):496-503.
[13]Tsimikas S,Witztum JL.The role of oxidized phospholipids in mediating lipoprotein(a) atherogenicity[J].Curr Opin Lipidol,2008,19(4):369-377.
[14]Kiechl S,Willeit J.The mysteries of lipoprotein(a)and cardiovascular disease revisited [J].J Am Coll Cardiol,2010,55(19):2168-2170.
[15]樊敬峰.静脉溶栓对脑梗死患者血浆[脂蛋白(a)],D-二聚体水平变化影响的研究[J].河北医学,2018,24(4):564-567.
收稿日期:2019-5-29;修回日期:2019-6-10
编辑/成森



