胡静 钟晓波 朱士胜

摘要:目的 鉴定颞下颌关节骨关节病(TMJOA)患者关节液中蛋白质表达情况,筛选出生物标志物,并初步探讨其发病机制。方法 选择2019年5~10月22例于我院行颞下颌关节玻璃酸钠注射治疗的TMJOA患者作为实验组,收集同期10名健康志愿者作为健康对照组,采集两组受试者关节液标本,应用同位素标记相对和绝对定量(iTRAQ)-LC-MS/MS检测和鉴定差异蛋白,对差异表达的蛋白进行生物信息学分析。结果 共鉴定出蛋白370个,与健康对照组相比,实验组中差异表达蛋白82个,其中上调蛋白35个,下调蛋白47个(差异倍数≥1.5 或≤0.67,P≤0.05)。差异蛋白主要参与的生物学过程有:cellular process,metabolic process,biological regulation,response to stimulus等;主要涉及的分子功能包括:binding,catalytic activity,enzyme regulator activity等;差异蛋白主要富集在PPAR signaling pathway通路。结论 iTRAQ-LC-MS/MS技术成功筛选到多个与TMJOA发病相关的蛋白,C4BPA、CD5L、PRDX2、CAH1可作为TMJOA诊断的候选生物标志物和潜在治疗靶点。
关键词:颞下颌关节骨关节病;关节液;蛋白质组学;同位素标记相对和绝对定量(iTRAQ);生物标志物
Abstract:Objective To identify the protein expression in the joint fluid of patients with temporomandibular joint osteoarthropathy (TMJOA), screen out biomarkers, and initially explore the pathogenesis.Methods Between May 2019 to October 2019, 22 TMJOA patients treated with sodium hyaluronate injection in our hospital were selected as the experimental group, and 10 healthy volunteers were collected as the healthy control group during the same period. The synovial fluid specimens were detected and identified by differential isotope labeling relative and absolute quantification (iTRAQ) -LC-MS/MS, and differentially expressed proteins were bioinformatically analyzed.Results A total of 370 proteins were identified.Compared with the healthy control group, there were 82 differentially expressed proteins in the experimental group, including 35 up-regulated proteins and 47 down-regulated proteins (fold≥1.5 or ≤0.67, P≤0.05). Differential proteins are mainly involved in cellular process,metabolic process,biological regulation,response to stimulus, etc.; the main molecular functions involved include: binding,catalytic activity,enzyme regulator activity, etc.; differential proteins are mainly rich set in PPAR signaling pathway.Conclusion iTRAQ-LC-MS / MS technology successfully screened multiple proteins related to TMJOA pathogenesis. C4BPA, CD5L, PRDX2, and CAH1 can be used as biomarkers and potential therapeutic targets for TMJOA diagnosis.
Key words:Temporomandibular joint osteoarthropathy;Jointfluid;Proteomics;isotope labeling relative and absolute quantification (iTRAQ);Biomarkers
颞下颌关节骨关节病(temporomandibular joint osteoarthropathy,TMJOA)是发生在关节软骨和关节下骨的非炎症性退行性疾病,以进行性关节软骨丧失为主,伴有软骨修复和软骨下骨重塑或硬化为主要病理表现[1]。青少年及以上年龄段人群均可发病,发病率随年龄增大而升高[2]。主要临床表现为关节区捻发音或破碎音,可有开口受限或下颌运动障碍,当出现关节区疼痛症状时,定义为颞下颌关节骨关节炎[3]。另外可伴随着头痛、耳部症状、颈部症状以及全身症状,严重影响患者的生活质量。目前其病因不明,临床诊断主要依靠病史、临床表现及影像学检查,缺乏实验室诊断方法[4]。蛋白质组学可阐明生物体全部蛋白质的表达模式及功能模式,已广泛用于肿瘤、心血管、神经系统等疾病状态下的特异表达蛋白的鉴定,疾病标志物筛选、发病机制研究、新药开发等[5]。因此,蛋白质组学可能为TMJOA的诊断及病因探讨带来新突破。2004年美国应用生物系统公司(ABI)开发的多肽体外同位素标记相对和绝对定量技术(iTRAQ)可同时对多达8种样品进行绝对和相对定量研究[6]。其对低丰度蛋白检测的灵敏度高,分离能力强,可定性定量同步进行,与质谱技术联用,可高效筛选出差异表达蛋白。目前,基于该技术的蛋白质组学已经在膝关节等大关节疾病的标志物筛选和机制探讨研究中广泛开展[7,8]。为此,本研究通过iTRAQ技术对颞下颌关节液进行检测,旨在探索该病患者关节液中的差异表达蛋白,并结合生物信息学技术分析,筛选出该疾病的潜在生物学标志物,并从分子学水平探讨其可能发病机制。
1资料与方法
1.1一般资料 于2019年5~10月选择重庆医科大学附属口腔医院22例行颞下颌关节玻璃酸钠注射治疗的TMJOA患者作为实验组,其中男2例,女20例,均符合Schiffman E等[9]的诊断标准。另外收集同期10名健康志愿者作为健康对照组,其中男1名,女9名。本研究经本单位人体试验伦理委员会的审查批准[2019年伦审(63)号]并符合2013版赫尔辛基宣言,已取得患者及其家属的知情同意并签署知情同意书。
1.2纳入及排除标准 纳入标准:①可有关节弹响史及间断性关节绞索史;②关节捻发音;③可有开口型异常或开口受限;④关节区无明显疼痛;⑤CBCT显示存在关节病变:髁突骨皮质模糊或不连续,骨质小凹陷缺损和破坏,包括松质骨在内的硬化性骨质增生、囊样变、骨质破损或磨短扁平,骨赘形成。排除标准:①MJ外伤史、感染史、肿瘤等颞下颌关节疾患者;②患有甲状腺和甲状旁腺功能亢进、肝肾疾病、糖尿病等影响骨代谢疾病;③近1年接受过颞下颌关节腔内注射药物及其他治疗者;④有严重的系统性疾病者;⑤孕妇及哺乳期妇女;⑥有中、重张口受限者;⑦有明显的精神或心理问题者;⑧资料不全者。
1.3方法
1.3.1标本采集 受试者取半仰卧位于45°牙科治疗椅上,常规皮肤消毒铺巾,嘱其大张口,穿刺点为耳屏中点至外眦连线上、耳屏前1 cm处,用5号注射器向前上内刺入颞下颌关节间隙水平面,抵关节结节后斜面,刺入关节腔,回抽无血后注射2%利多卡因1.5 ml,反复灌洗5次后抽尽液体,再注入透明质酸钠(施沛特)1 ml。注射完毕后,嘱患者紧密咬合,用消毒纱布压迫针刺点2~3 min,避免局部出血。健康志愿者无注射透明质酸钠步骤。采集的关节液低温保存下尽快送往实验室,离心(4 ℃,2000 r/min,10 min),分装到EP管,-80 ℃保存。
1.3.2蛋白质定量 Bradford法测定蛋白浓度,根据标准曲线和蛋白样品稀释倍数计算出蛋白样品的浓度。
1.3.3 iTRAQ联合液相色谱串联质谱(LC-MS/MS)鉴定 取两组适量样品进行蛋白质提取。用100 mmol/L TEAB将蛋白溶液稀释5倍,按1:50的质量比例(胰酶:蛋白)加入胰蛋白酶,37 ℃酶解过夜。酶解后的肽段用C18柱脱盐。iTRAQ-8标试剂盒(SCIEX)对各肽段进行标记(N:114,OA:115),并均匀混合。将混合后的肽段运用Ultimate 3000 HPLC系统(Thermo DINOEX,USA)对肽段样品进行分级分离。色谱柱使用的是Durashell C18柱(5 μm,100 ,4.6×250 mm)。利用碱性条件下逐渐升高的ACN浓度实现肽段的分离,流速为1 ml/min,每分钟收集1管。将标记后的多肽样品加到C18捕获柱(5 μm,100 μm×20 mm)上,并以90 min时间梯度,300 nl/min的流速在C18分析柱(3 μm,75 μm×150 mm)上用缓冲液A(2%乙腈/0.1%甲酸/ 98%H2O)和缓冲液B(98%乙腈/0.1%甲酸/2% H2O)进行梯度洗脱。使用TripleTOF 5600plus质谱仪检测肽段信号,以250 ms的离子累积时间进行一级质谱图的扫描,并以50 ms的离子累积时间采集30个前体离子的二级质谱图。在350~1500 m/z的范围内采集MS1光谱,并在100~1500 m/z的范围内采集MS2光谱。将前体离子动态排除时间设置为15 s。
1.3.4数据分析 对于鉴定到的肽段,设置可信度水平在95%以上。仅保留至少包含一个唯一肽段且可信的肽段进行蛋白质定量。当差异倍数≥1.5或≤0.67,且经过显着性统计检验其P值≤0.05时,认为该蛋白存在表达差异。应用DAVID富集分析平台对初步鉴定的差异表达蛋白功能富集分析,选择G0分析生物过程、细胞组分和分子功能注释对差异蛋白分类,选择KEGG通路数据库对差异蛋白所涉及的代谢通路进行分析。通过STRING数据库以及Cytoscape3.6.1软件进行蛋白质-蛋白质互作(PPI)网络分析。
1.4统计学方法 差异蛋白的P值计算采用Proteinpilot软件内置算法获得的,由与蛋白质匹配的所有谱图的差异倍数经过单样本Student's t检验获得的。最后根据差异倍数和Pvalue来筛选显着差异蛋白。当差异倍数达到1.5倍及以上(即up_regulate≥1.5和down_regulate≤0.67),且经过显着性统计检验其P≤0.05时,视为显着差异蛋白。
2结果
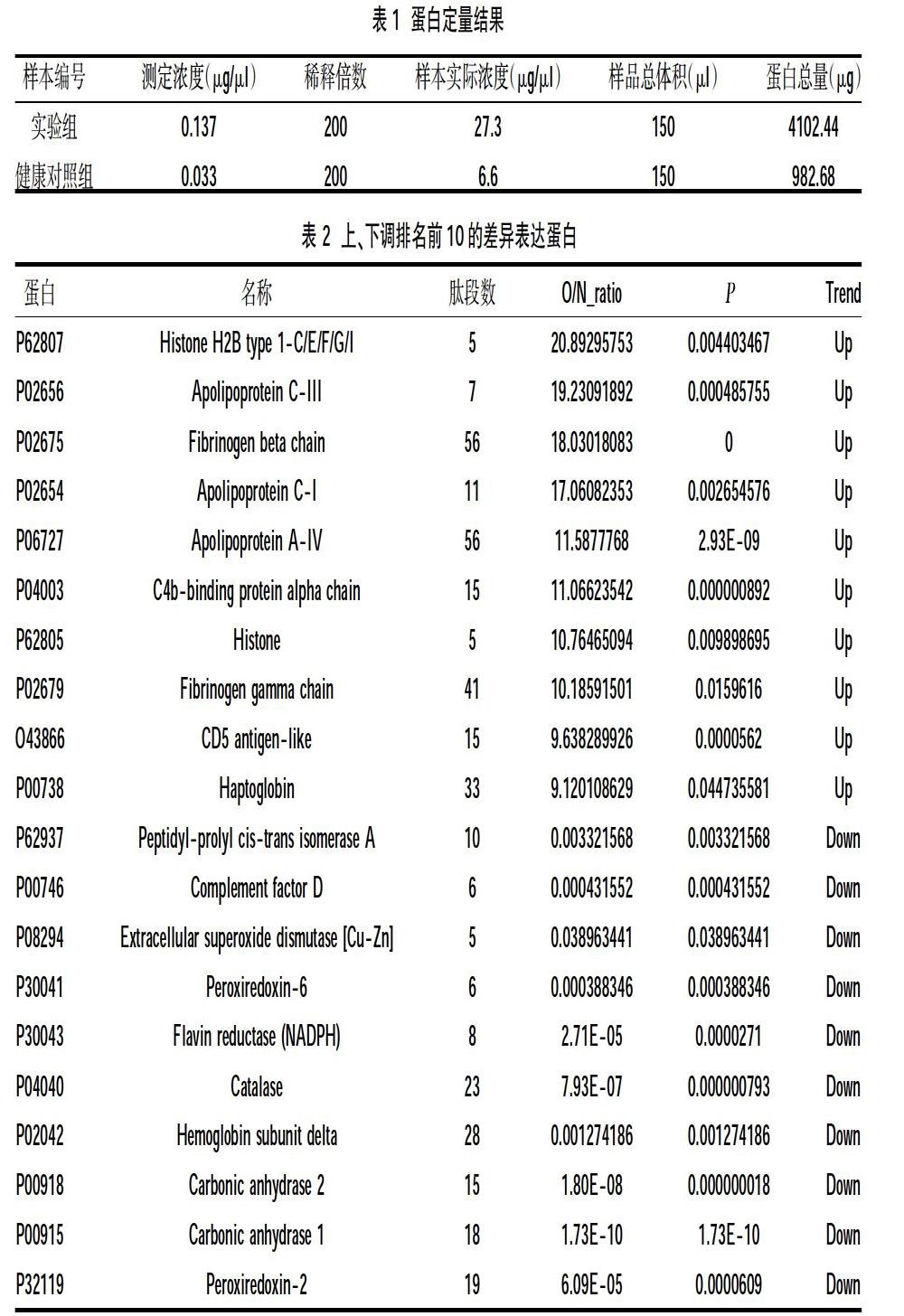
2.1总蛋白质定量信息 从定量信息结果来看,关节液样本蛋白总量满足上机标准,两组蛋白浓度见表1。
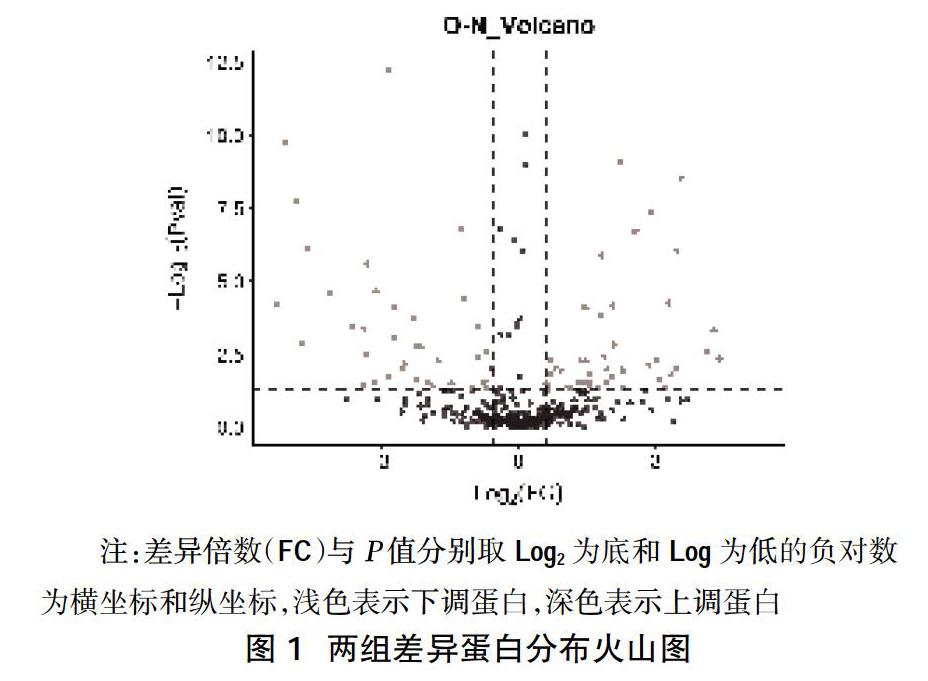
2.2两组差异表达蛋白 共鉴定出370种蛋白,共鉴定出蛋白370个,与健康对照组相比,实验组中差异表达蛋白82个,其中上调蛋白35个,下调蛋白47个(差异倍数≥1.5 或≤0.67,P≤0.05),差异蛋白的火山图见图1。其中排名上、下调前10的差异蛋白见表2。
2.3生物信息学分析 GO注释结果显示,差异蛋白主要参与的生物学过程包括cellular process,metabolic process,biological regulation,response to stimulus等。主要涉及的分子功能包括binding,catalytic activity,enzyme regulator activity等,且这些差异蛋白大多数属于extracellular region part成分。见图2。KEGG信号富集分析显示,前20条通路中PPAR signaling pathway通路的富集程度最高,而complement and coagulation cascades通路中包含差异表达蛋白数量最多(13个),其次为systemic lupus erythematosus通路(10个),见图3。
[21]Wilson R,Golub SB,Rowley L,et al.Novel Elements of the Chondrocyte Stress Response Identified Using an in Vitro Model of Mouse Cartilage Degradation[J].J Proteome Res,2016,15(3):1033-1050.
[22]Rao Z,Wang S,Wang J.Peroxiredoxin 4 inhibits IL-1β-induced chondrocyte apoptosis via PI3K/AKT signaling[J].Biomed Pharmacother,2017(90):414-420.
[23]Arriga R,Pacifici F,Capuani B,et al.Peroxiredoxin 6 Is a Key Antioxidant Enzyme in Modulating the Link between Glycemic and Lipogenic Metabolism[J].Oxid Med Cell Longev,2019(2019):9685607.
[24]Ji MJ,Hong JH.An overview of carbonic anhydrases and membrane channels of synoviocytes in inflamed joints[J].J Enzyme Inhib Med Chem,2019,34(1):1615-1622.
[25]Liao W,Li Z,Li T,et al.Proteomic analysis of synovial fluid in osteoarthritis using SWATH mass spectrometry[J].Mol Med Rep,2018,17(2):2827-2836.
[26]Li Z,Zhong L,Du Z,et al.Network Analyses of Differentially Expressed Genes in Osteoarthritis to Identify Hub Genes[J].Biomed Res Int,2019(2019):8340573.
编辑/成森



