白玉芬 徐洪涛 尹太勇 丁冬胜 李琳 聂国明 邹敏书

摘要:目的 研究维生素D(VitD)在系统性红斑狼疮(SLE)治疗中的作用机制。方法 将6只C57/B6小鼠随机分为两组(组1、2),12只MRL/lpr小鼠随机分为四组(组3~6),每组3只,其中组1、6不做处理,组2:C57/B6小鼠+VitD[10 ng/(kg·d)];组3:MRL/lpr小鼠+VitD[10 ng/(kg·d)];组4:MRL/lpr小鼠+VitD[30 ng/(kg·d)];组5:MRL/lpr小鼠+VitD[10 ng/(kg·d)]+PA (0.8 μg/kg,3/W)。灌胃6周后处死小鼠,收集Peyer小结,流式细胞仪测定活化及凋亡的Tfh细胞百分率,B淋巴细胞及浆细胞百分率,趋化因子CCL12、CXCL13、CCL19、CCL21的表达;Real-Time PCR测定IL-21、IL-4mRNA的表达;Western Blot测定IL-21、IL-4、Bcl-6、Blimp-1、XBP-1、Pax-5、BAFF蛋白的表达。结果 与SLE鼠组相比,给予VitD可以降低Tfh细胞百分率但不能明显改变Tfh细胞的活化,减少细胞凋亡,降低B淋巴细胞和浆细胞百分率。同时可以下调IL-21、IL-4、Blimp-1、XBP-1、BAFF蛋白,细胞因子IL-21、IL-4mRNA和趋化因子CCL12、CXCL13、CCL19、CCL21的表达,上调Bcl-6、Pax-5蛋白的表达,且呈剂量依赖性,与PA联用效果更佳。结论 VitD与其受体结合可能通过抑制Tfh细胞、相关因子及微环境、抑制自身免疫抗体的生成,从而对SLE产生治疗作用。
关键词:维生素D;SLE;滤泡辅助性T细胞;Peyer小结
中图分类号:R692.3 文献标识码:A DOI:10.3969/j.issn.1006-1959.2020.13.014
文章编号:1006-1959(2020)13-0049-05
The Effect of Vitamin D on the Microenvironment of Tfh Cells
in Peyer's Nodules of Systemic Lupus Erythematosus
BAI Yu-fen,XU Hong-tao,YIN Tai-yong,DING Dong-sheng,LI Lin,NIE Guo-ming,ZOU Min-shu
(Department of Pediatrics,Central War Theater General Hospital,Wuhan 430070,Hubei,China)
Abstract:Objective To study the mechanism of vitamin D (VitD) in the treatment of systemic lupus erythematosus (SLE).Methods Six C57/B6 mice were randomly divided into two groups (groups 1 and 2), and 12 MRL/lpr mice were randomly divided into four groups (groups 3 to 6), with 3 mice in each group, of which groups 1 and 6 without treatment, Group 2: C57/B6 mice + VitD[10 ng/(kg·d)]; Group 3: MRL/lpr mice+VitD[10 ng/(kg·d)]; Group 4: MRL /lpr mice+VitD[30 ng/(kg·d)]; Group 5: MRL/lpr mice+VitD[10 ng/(kg·d)]+PA (0.8 μg/kg, 3/W). After 6 weeks of gavage, the mice were sacrificed, Peyer nodules were collected, flow cytometry was used to determine the percentage of activated and apoptotic Tfh cells, B lymphocytes and plasma cells, and the expression of chemokines CCL12, CXCL13, CCL19, CCL21; Real-Time PCR measured the expression of IL-21 and IL-4 mRNA; Western Blot measured the expression of IL-21, IL-4, Bcl-6, Blimp-1, XBP-1, Pax-5 and BAFF protein.Results Compared with the SLE mice group, the administration of VitD can reduce the percentage of Tfh cells but can not significantly change the activation of Tfh cells, reduce apoptosis, and reduce the percentage of B lymphocytes and plasma cells. At the same time, it can down-regulate the expression of IL-21, IL-4, Blimp-1, XBP-1, BAFF protein, cytokines IL-21, IL-4mRNA and chemokines CCL12, CXCL13, CCL19, CCL21, and up-regulate Bcl-6,the expression of Pax-5 protein is dose-dependent, and it is more effective in combination with PA.Conclusion The binding of VitD to its receptor may have a therapeutic effect on SLE by inhibiting Tfh cells, related factors and microenvironment, and inhibiting the production of autoimmune antibodies.
Key words:Vitamin D;SLE;Follicular helper T cells;Peyer's summary
系统性红斑狼疮(SLE)是一种慢性系统性自身免疫性疾病,主要是自身抗体产生、补体活化和免疫复合物沉积,对青中年妇女影响最大[1]。近年来,随着SLE诊断和治疗方法的改善,其发病率和死亡率有所下降,但仍高于一般人群。有流行病学表明[2],遗传因素与环境的相互作用,会增加患SLE的风险,例如暴露于晶体二氧化硅、吸烟、使用口服避孕药等,但饮酒反而会降低患病几率。同时也有研究表明[3,4],SLE风险与接触农业杀虫剂、重金属、空气污染、紫外线、某些感染和疫苗接种也有关联。滤泡辅助性T细胞(Tfh)是一种定位于淋巴滤泡、CD4+T细胞亚型,能够对B细胞增殖及分化起辅助作用[5-7]。其对免疫球蛋白类别转换的作用能够调控体液免疫应答,在类风湿性关节炎(RA)及SLE等自身免疫性疾病发病机制中有重大影响[8,9]。维生素D(VitD)是一种主要由人体皮肤在紫外线照射下合成的激素,能够调节钙和磷酸盐水平的循环,从而影响骨骼代谢[10-12]。除了可以在骨代谢中的起作用外,VitD还具有显着的免疫调节功能,增强单核巨噬细胞的杀菌能力和下调T淋巴细胞产生的炎症细胞因子。当VitD缺乏会导致许多健康问题,包括免疫介导的疾病,如自身免疫性疾病[13-15]。研究表明[16],VitD不足往往与免疫紊乱和传染病有关,而越来越多的证据表明,全球人口的VitD状况不佳。迄今为止,大多数关于补充维生素D的人类炎症和免疫疾病的干预研究结论尚存在争议[17]。本研究观察了VitD对SLE鼠Peyer小结Tfh细胞及其相关因子的影响,探讨VitD治疗SLE的作用机制,以期为今后科学合理的治疗SLE提供了新的方向。
1材料与方法
1.1材料 SPF级16周 C57/B6及MRL/lpr小鼠,由武汉华联科生物科技公司提供。在温度22℃~24℃、湿度60%~70%屏障系统中饲养。本实验通过解放军中部战区总医院实验动物福利伦理委员会通过[武总动(福)第2014012号]。
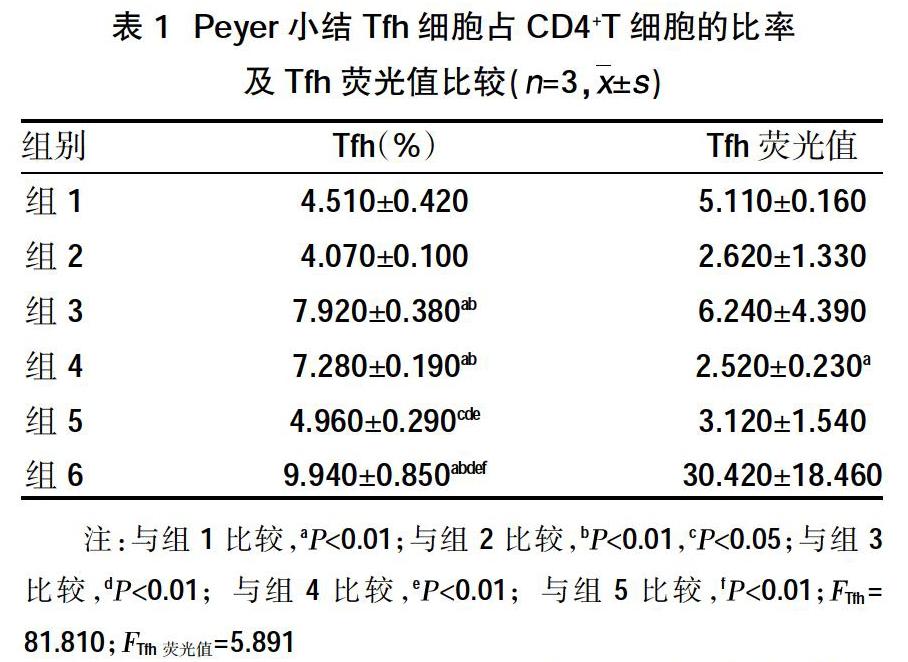
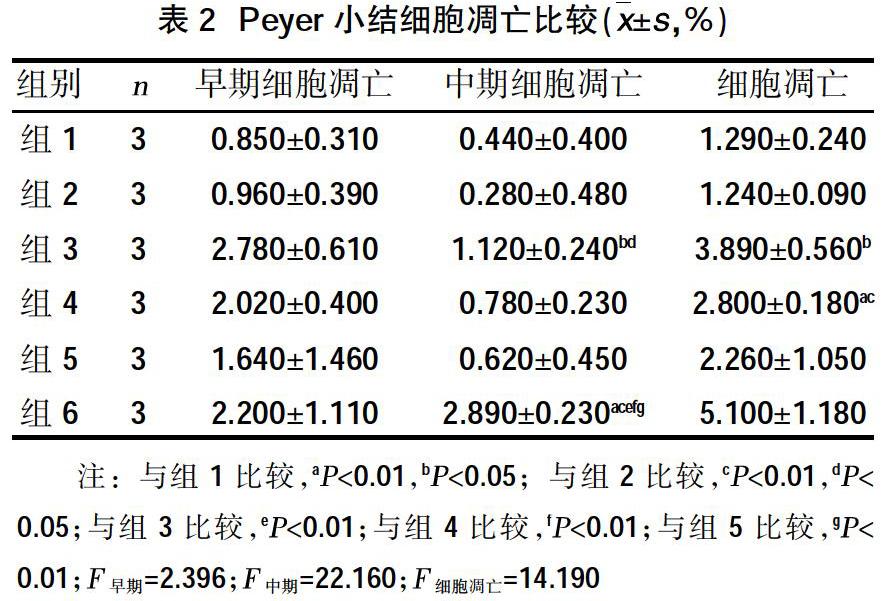
1.2方法 将C57/B6小鼠随机分为两组,每组3只。组1:C57/B6小鼠组,每天给予100 μl丙二醇溶液灌胃;组2:C57/B6小鼠+ViD组:给予1,25(OH)2D溶于100 μl丙二醇溶液中,按10 ng/(kg·d)灌胃。将MRL/lpr小鼠随机分为四组,每组3只。随机分组如下:组3:1,25(OH)2D溶于100 μl丙二醇溶液中,按10 ng/(kg·d)灌胃;组4:1,25(OH)2D溶于100 μl丙二醇溶液中,按30 ng/(kg·d)灌胃;组5:1,25(OH)2D溶于100 μl丙二醇溶液中,按30 ng/(kg·d)+帕立骨化醇(PA)(0.8 μg/kg,3/W)灌胃;组6:MRL/lpr小鼠;每天给予100 μl丙二醇溶液灌胃。均持续6周,6周后消毒小鼠腹壁毛发及皮肤,四肢伸展固定于超清手术台上,用无菌剪刀于腹中线剪开皮肤,分离小肠,去除脂肪,用生理盐水反复冲洗肠腔,小弯剪将附着于小肠壁集合淋巴滤泡即Peyer 小结分离清洁,放入RPMI1640 培养液,转入100 目不锈钢筛网上碾磨,RPMI1640培养液冲洗,将Peyer小结匀浆液转入试管中,离心,去上清液,加PBS洗涤备用。
1.3指标测定 流式细胞仪(BECKMAN公司FC500 MCL)测定活化及凋亡的Tfh细胞百分率(AnnexinV-FITC/PI 凋亡检测试剂盒购自bioswamp公司),B淋巴细胞及浆细胞百分率,趋化因子CCL12、CXCL13、CCL19、CCL21的表达;Real-Time PCR测定IL-21、IL-4mRNA的表达;Western Blot测定IL-21、IL-4、Bcl-6、Blimp-1、XBP-1、Pax-5、BAFF蛋白的表达。
1.4统计学方法 使用SPSS 17.0统计软件包分析,数据用(x±s)表示,多组比较用one-way ANOVA方差分析,两两比较方差齐者用LSD 法,方差不齐者用Dunnetts T3 检验。两组比较用独立样本t 检验,采用Pearson 相关分析法。P<0.05为差异有统计学意义。
2结果
2.1 VitD对MRL/lpr小鼠Peyer小结Tfh细胞的影响 MRL/lpr小鼠Peyer小结Tfh细胞百分率较C57/B6小鼠显着增加(P<0.01),而二者活化的Tfh细胞荧光值比较,差异无统计学意义(P>0.05);VitD不能明显降低C57/B6小鼠Tfh细胞、活化的Tfh比率水平。与MRL/lpr小鼠相比,小剂量VitD可降低Tfh细胞百分率,大剂量VitD可显着降低Tfh细胞百分率,但对Tfh细胞的活化无明显影响;VitD与PA联用使Tfh细胞百分率降至最低(P<0.01),但不能明显改变Tfh细胞的活化,见表1。
2.2 VitD对MRL/lpr小鼠Peyer小结细胞凋亡的影响 MRL/lpr小鼠Peyer小结细胞凋亡百分率较C57/B6小鼠显着增加(P<0.01);给予VitD并未降低C57/B6小鼠细胞凋亡水平。与MRL/lpr小鼠相比,给予小剂量VitD可降低细胞凋亡水平;给予大剂量VitD进一步降低细胞凋亡百分率;VitD与VDR激动剂PA联用使细胞凋亡百分率降至最低,见表2。
2.3 VitD对MRL/lpr小鼠Peyer小结B淋巴细胞百分率的影响 MRL/lpr小鼠Peyer小结前B淋巴细胞(B220+IgM-B)百分率较C57/B6小鼠显着降低,而未成熟B淋巴细胞(B220-IgM+B)、成熟B淋巴细胞(220+IgD+B)百分率较较C57/B6小鼠显着升高(P<0.01);VitD可降低C57/B6小鼠未成熟B淋巴细胞(B220-IgM+B)百分率,对B淋巴细胞(B220+IgM-B)、成熟B淋巴细胞(220+IgD+B)百分率无明显影响。与MRL/lpr小鼠相比,给予小剂量VitD可降低未成熟B淋巴细胞(B220-IgM+B)百分率;给予大剂量VitD进一步降低未成熟B淋巴细胞(B220-IgM+B)、成熟B淋巴细胞(220+IgD+B)百分率;VitD与VDR激动剂PA联用使前B淋巴细胞(B220+IgM-B)百分率升至最高,未成熟B淋巴细胞(B220-IgM+B)、成熟B淋巴细胞(220+IgD+B)百分率降低,见表3。
2.4 VitD对MRL/lpr小鼠Peyer小结浆细胞百分率的影响 MRL/lpr小鼠Peyer小结前体百分率较C57/B6小鼠无明显增加,而浆细胞百分率较C57/B6小鼠显着增加。在C57/B6小鼠中,VitD对浆细胞前体、浆细胞百分率无明显影响。与MRL/lpr小鼠相比,给予小剂量VitD对浆细胞前体细胞百分率无明显改变,而可降低浆细胞百分率;给予大剂量VitD进一步增加浆细胞前体细胞百分率,降低浆细胞百分率;VitD与VDR激动剂PA联用使浆细胞前体细胞百分率升至最高,浆细胞百分率降至最低,见表4。
2.5 MRL/lpr小鼠Peyer小结Tfh相关细胞因子及转录因子蛋白的表达 1组与2组IL-21、IL-4、Bcl-6、Blimp-1、XBP-1、Pax-5、BAFF蛋白表达比较,差异无统计学意义(P>0.05);MRL/lpr小鼠IL-4、Blimp-1、BAFF蛋白表达较C57/B6小鼠显着增加,而Bcl-6表达明显下降。小剂量VitD可上调Bcl-6的表达;大剂量VitD可下调IL-21、IL-4、Blimp-1、XBP-1、BAFF表达,上调Bcl-6、Pax-5的表达。VitD与PA联用进一步下调MRL/lpr小鼠IL-21、IL-4、Blimp-1、XBP-1、BAFF的表达,上调Bcl-6、Pax-5的表达,见表5。
2.6 Peyer小结Tfh相关细胞因子IL-21、IL-4 mRNA的表达 C57/B6小鼠Peyer小结IL-21、IL-4基因表达较MRL/lpr小鼠显着升高(P<0.05);VitD可降低C57/B6小鼠IL-21基因的表达,对IL-4 mRNA的表达无明显影响;与MRL/lpr小鼠相比,给予小剂量VitD及大剂量VitD均可显着降低IL-21、IL-4 mRNA的表达;VitD与VDR激动剂PA联用使IL-21 mRNA的表达降至最低。与单用VitD相比,VitD与PA联用可显着降低IL-21 mRNA的表达(P<0.01),而二者对IL-4 mRNA的表达影响的比较,差异无统计学意义(P>0.05),见表6。
2.7 Peyer小结趋化因子的表达 VitD对C57/B6小鼠CCL12、CXCL13、CCL19、CCL21的表达无明显影响。MRL/lpr小鼠CCL12、CXCL13、CCL19、CCL21的表达较C57/B6小鼠升高。与MRL/lpr小鼠相比,小剂量及大剂量VitD均可显着降低CCL12、CXCL13、CCL19、CCL21的表达,但仅CCL19的下降统计学意义显着;VitD与VDR激动剂PA联用使CCL12、CXCL13的表达进一步降低,但无差异统计学意义(P>0.05),见表7。
3讨论
SLE是一种病因未明,由自身免疫应答异常活化介导的炎症性结缔组织病。其致病机制十分复杂,其中尤以多克隆B细胞高度活化、免疫球蛋白增多和多种自身抗体生成及细胞内外免疫反应低下为主要特征。而通过本研究发现VitD与PA联用可以显着降低Tfh细胞的百分率和细胞凋亡的百分率,同时可以升高浆细胞和B淋巴细胞前体细胞的百分率,从而降低浆细胞和B淋巴细胞的百分率。为了进一步了解VitD对SLE的作用机制,本研究对相关因子进行了更深入地分析。
B细胞激活因子(BAFF)属于TNF超家族,是一种B淋巴细胞刺激器,能影响B细胞存活和分化。BAFF通过上调抗凋亡蛋白来保证B细胞的存活和浆细胞分化。研究证明[18],当BAFF浓度升高时,SLE患者疾病活动程度增强。B淋巴细胞诱导成熟蛋白-1(Blimp-1)调控B细胞向浆细胞转化,是浆细胞分化的启动元件,在浆细胞分化、维持及产生抗体过程中有着举足轻重的作用。Blimp-1正常表达时,可促进B细胞向浆细胞分化,而Blimp-1表达缺陷时,浆细胞成熟出现障碍。B细胞淋巴瘤-6(Bcl-6)是一种转录调控因子,可调控初始T细胞成长为T细胞。其表达在B细胞和T化细胞的生发中心(GC),其过度表达可抑制CD4+Th细胞亚群的分化,在GC中也仅有10%左右的T细胞表达Bcl-6;而Bcl-6缺乏会严重影响GC的形成,T细胞不能发育为Tfh细胞,影响机体正常的免疫应答,无法生成抗体。Bcl-6/Blimp-1平衡是调控抗体分泌的关键因子,但两者相互拮抗,当其平衡被破坏时,抗体的分泌影响极大[19-21]。在研究中,VitD通过上调Bcl-6和下调Blimp-1的表达来破坏Bcl-6/Blimp-1的平衡,以此减少抗体分泌,在一定程度上对SLE产生作用。
白细胞介素-21(IL-21)主要由T细胞分泌产生,作用于B细胞表面的IL-21R上,启动一系列可以促进Blimp-1表达的信号通路,T细胞对B的作用可促进B细胞分化形成浆细胞,增加抗体的分泌。本研究通过实验发现VitD可以显着降低IL-21mRNA的表达,抑制IL-21的分泌可以降低B细胞活化和浆细胞形成,导致自身抗体浓度降低,同时,中性粒细胞和单核细胞数目也会减少,进一步改善狼疮小鼠的症状,这与现有研究结论一致[22,23]。
白细胞介素-4(IL-4)主要由Th2细胞分泌,可以促进B细胞增殖,促进体液免疫,但是会抑制Thl细胞因子的分泌,降低细胞免疫。此外,IL-4也可以促进B细胞CD40、FcεRⅡ/CD23和MHCⅡ类抗原的表达,增强呈递抗原的能力,促进免疫应答[22-24]。
能使细胞产生趋化运动的细胞因子被称为趋化因子,对淋巴细胞、嗜中性粒细胞、单核细胞等均有作用。在肿瘤、自身免疫性疾病等数种疾病中均有趋化因子及其受体的发挥作用[25]。CXC趋化因子配体13 (CXCL13)作为CXC趋化因子家族的一员,主要由次级淋巴器官(包括脾、淋巴结、Peyer's结)中的树突状细胞和巨噬细胞产生,通过与其受体CXC趋化因子受体5(CXCR5)相结合,对B淋巴细胞移动、寻靶和诱导次级淋巴组织中GC的形成中发挥重要作用[26,27]。研究表明其在多种自身免疫性疾病如SLE、RA和干燥综合征(SS)中发挥重要的作用[28]。CCL12最初是从有过敏性炎症反应的小鼠肺中分离出来,主要在淋巴结中表达,能明显诱导活化巨噬细胞表达。纯化的重组CCL12蛋白对外周血单核细胞有较强的趋化作用。在高剂量时对嗜酸性粒细胞活性弱,对中性粒细胞无活性,具有CC趋化因子的特点[29-31]。CCL19和CCL21是CC类趋化因子家族成员,是内环境稳定性趋化因子,在气管内高表达,调节炎症细胞的迁移和功能,与呼吸系统多种疾病的发生发展有关[32,33]。本研究对这些趋化因子进行分析时发现VitD可以显着降低CCL12、CXCL13、CCL19、CCL21的表达,在各种组织器官和外周血中减弱淋巴细胞和炎症细胞的功能,减少其他并发症的发生,提升SLE患者的生活质量。
综上所述,对狼疮小鼠模型使用VitD可以明显下调IL-4,IL-21,XBP-1,BAFF的表达,影响Bcl-6/Blimp-1的平衡,降低趋化因子CCL12、CXCL13、CCL19、CCL21的表达。从而降低Tfh细胞比率,减少细胞凋亡,降低成熟B淋巴细胞和浆细胞的数量,达到抑制抗体分泌,治疗SLE的作用。
参考文献:
[1]曹平,赵玉,王静.系统性红斑狼疮分子病因研究进展[J].中国免疫学杂志,2013,29(6):657-661.
[2]滕菲,关尚琪,梅轶芳,等.系统性红斑狼疮相关肺动脉高压的发病机制及治疗研究进展[J].中华医学杂志,2018,98(17):1371-1373.
[3]Pedro EM,Flor DRFSL,Scavuzzi BM,et al.Trace Elements Associated with Systemic Lupus Erythematosus and Insulin Resistance[J].Biological Trace Element Research,2019,191(1):34-44.
[4]Dhar JP,Essenmacher L,Dhar R,et al.The Effect of History of Abnormal Pap Smear or Preceding HPV infection on the Humoral Immune Response to Quadrivalent Human Papilloma virus(qHPV)Vaccine in Women with Systemic Lupus Erythematosus[J].Human Vaccines&Immunotherapeutics, 2018,14(9):2318-2322.
[5]吴芳.滤泡辅助性T细胞参与实验性自身免疫性脑脊髓炎的初步研究[D].第四军医大学,2014.
[6]陈升,李杨磊,王元元.滤泡辅助性T细胞的研究进展[J].蚌埠医学院学报,2019,44(1):138-141.
[7]高筱斐,赵明.microRNA-21对系统性红斑狼疮滤泡样辅助T细胞异常分化的调控作用[C]//第十三届全国免疫学学术大会摘要汇编.2018.
[8]褚阳.滤泡辅助性T细胞在类风湿关节炎滑膜中的表达及鉴定[D].苏州大学,2014.
[9]蔡茂文,张晶,周彬.类风湿关节炎与系统性红斑狼疮患者甲状腺功能的比较分析[J].实用医院临床杂志,2013,10(3):80-82.
[10]石娴,石年,解翠林,等.特应性皮炎患者血清VitD、tIgE、IL-4和IL-6水平检测及临床意义[J].检验医学与临床,2017,14(24):3605-3606.
[11]Amir E,Cecchini RS,Ganz PA,et al.25-hydroxy vitamin D(VitD)and associated variables as predictors of breast cancer(BC)risk and tamoxifen benefit in NSABP-P1[J].Breast Cancer Research&Treatment,2012,135(3):923-923.
[12]Tuomainen TP,Virtanen JK,Voutilainen S,et al.Glucose Metabolism Effects of Vitamin D in Prediabetes:The VitDmet Randomized Placebo-Controlled Supplementation Study[J].J Diabetes Res,2015(2015):672653.
[13]孟庆军,华青,戴婷婷.儿童血清25(OH)VitD与骨代谢标志物水平的相关性研究[J].海南医学院学报,2015,21(10):1390-1392.
[14]沈佩芳,田军,丁晓玲.血清维生素D水平与支气管哮喘患儿病情严重程度的相关性[J].浙江临床医学,2018,20(7):1190-1192.
[15]王颖,卢美萍,滕丽萍,等.血清25羟维生素D3水平与幼年特发性关节炎的关系[C]//2015年浙江省医学会儿科学分会学术年会暨儿内科疾病诊治新进展国家级继续教育学习班.2015.
[16]吴冬梅,刘培成.维生素D与老年骨质疏松[J].中国骨质疏松杂志,2015(5):634-637.
[17]维生素D受体在炎性肌病的发病作用及维生素D的干预研究[D].南开大学,2014.
[18]Vincent FB,Morand EF,Schneider P,et al.The BAFF/APRIL system in SLE pathogenesis[J].Nature Reviews Rheumatology,2014,10(6):365-373.
[19]段春巧,杨雯雯,雷玲彦,等.Bcl-6/Blimp-1/IL-21在原发性干燥综合征中的致病作用[J].中国免疫学杂志,2015(3):384-388,392.
[20]Zhang XY,Ma ZP,Cui WL,et al.Potential mechanism and prognostic value of promoter methylation of PRDM1 gene in diffuse large B cell lymphoma[J].Chinese Journal of Pathology,2016,45(12):831-837.
[21]Yeol SG,Won YS,Kim YI,et al.Decreased Bcl-6 and increased Blimp-1 in the peritoneal cavity of patients with endometriosis[J].Clinical&Experimental Obstetrics&Gynecology,2015,42(2):156.
[22]Chaves AC,Cerávolo IP,Gomes JA,et al.IL-4 and IL-13 regulate the induction of indoleamine 2,3-dioxygenase activity and the control of Toxoplasma gondii replication in human fibroblasts activated with IFN-gamma[J].European Journal of Immunology,2015,31(2):333-344.
[23]An LF,Zhang XH,Sun XT,et al.Unexplained infertility patients have increased serum IL-2,IL-4,IL-6,IL-8,IL-21,TNFα,IFNγ and increased Tfh/CD4 T cell ratio: increased Tfh and IL-21 strongly correlate with presence of autoantibodies[J].Immunological Investigations,2015,44(2):1-10.
[24]Botti E,Boca AN,Spallone G,et al.The Role of IL-21 in Chronic Inflammatory Skin Diseases[J].Current Dermatology Reports,2013,2(1):11-17.
[25]孙青,吴昌平,蒋敬庭.趋化因子及其受体在肿瘤免疫中调节作用的新进展[J].中国医药生物技术,2015,10(4):294-296.
[26]Jiang BC,Cao DL,Zhang X,et al.CXCL13 drives spinal astrocyte activation and neuropathic pain via CXCR5[J].Journal of Clinical Investigation,2016,126(2):745-761.
[27]Wu B,Wang W,Zhan Y,et al.CXCL13,CCL4,and sTNFR as circulating inflammatory cytokine markers in primary and SLE-related autoimmune hemolytic anemia[J].Journal of Translational Medicine,2015,13(1):112.
[28]艾汐汐.CD5+B细胞在类风湿关节炎、系统性红斑狼疮、干燥综合征患者外周血中表达的临床意义的探讨[D].中国医科大学,2015.
[29]Mills SC,Howell L,Beekman A,et al.Rac1 plays a role in CXCL12 but not CCL3-induced chemotaxis and Rac1 GEF inhibitor NSC23766 has off target effects on CXCR4[J].Cellular Signalling,2017(42):88-96.
[30]Deleon-Pennell KY,Iyer RP,Ero OK,et al.Periodontal-induced chronic inflammation triggers macrophage secretion of Ccl12 to inhibit fibroblast-mediated cardiac wound healing[J].Jci Insight,2017,2(18):e94207.
[31]Marazioti A,Kairi C A,Spella M,et al.Beneficial Impact of CCL2 and CCL12 Neutralization on Experimental Malignant Pleural Effusion[J].PloS One,2013,8(8):e71207.
[32]蔡文芝.趋化因子CCL19和CCL21及其受体CCR7与冠心病的关联研究及功能分析[J].中国循环杂志,2014(z1):29-29.
[33]Hansen M,Ozcan Met,Larsen NB,et al.Autocrine CCL19 blocks dendritic cell migration toward weak gradients of CCL21[J].Cytotherapy,2016,18(9):1187-1196.
收稿日期:2020-04-09;修回日期:2020-04-28
编辑/肖婷婷
基金项目:国家自然科学基金面上项目(编号:81373179)
作者简介:白玉芬(1968.3-),女,湖北宜昌人,本科,主治医师,主要从事免疫和生长发育疾病的诊疗工作
通讯作者:邹敏书(1971.8-),男,湖北大冶人,博士,副主任医师,主要从事儿童肾脏病及生长发育疾病的诊疗工作



