章 胜,王昌会,方 浩,陈大年
(合肥市蜀山区安徽医科大学第一附属医院心内科二病区,安徽 合肥 230000)
心房颤动(atrial fibrillation,AF)简称房颤,是临床最常见的心律失常类型之一。目前全球房颤患病率约为0.5%,亚洲人群患病率较西方人群略低,为0.2%~7.9%,且房颤的发病率随年龄的增加而增加,同时由于房颤诊疗技术的发展及人口老龄化进程,房颤的发病率仍处于不断上升趋势[1-3]。血栓脱落造成的卒中及血栓栓塞事件是房颤最严重的并发症,与无房颤患者相比较,房颤患者的卒中及血栓栓塞风险升高约5 倍,房颤导致的卒中占所有卒中患者的20%~30%[4,5]。左心耳因其特殊的结构及功能特点成为心房中血栓最易形成的部位,有57%的瓣膜病房颤及90%的非瓣膜病房颤血栓来源于左心耳[6]。经食道超声心动图(TEE)检查是目前诊断左心耳血栓的金标准[7-9]。TEE 检查作为一项侵入型临床操作,价格相对昂贵,难以被部分患者所接受,在大多数基层医院受限于设备成本及技术人员缺乏等原因亦难以开展,因此寻找与房颤患者卒中及血栓栓塞事件相关的更加特异性的危险因素及开发出更有效的风险预测模型指导临床抗凝治疗具有非常重要的意义。基于此,本研究主要探讨非瓣膜性房颤患者左心耳血栓形成及血栓形成前期相关的临床危险因素,以期为临床治疗提供参考,现报道如下。
1 资料及方法
1.1 一般资料 回顾性分析2018 年7 月-2020 年9月安徽医科大学第一附属医院行TEE 检查连续性住院的663 例非瓣膜病房颤患者作为研究对象,纳入标准:①均符合非瓣膜病房颤的诊断标准(无风湿性二尖瓣狭窄、机械或生物瓣膜、二尖瓣修复状况下发生的房颤,包括首诊房颤、阵发性房颤、持续性房颤及永久性房颤);②行TEE 检查前抗凝治疗,包括按指南要求的3 周以上的抗凝与非正规抗凝(<3周)或未用抗凝药物,抗凝药物为华法林或利伐沙班;排除标准:①心脏瓣膜疾病(包含风湿性心脏病),心脏彩超检查示重度瓣膜反流、狭窄及曾接受瓣膜修补、置换的患者;②先天性心脏病患者;③病程中存在感染状态的患者;④实验室检查示血红蛋白(Hb)<90 g/L 的中重度贫血患者;⑤合并血液系统疾病患者;⑥研究资料不完善的患者。
1.2 方法
1.2.1 资料收集 查阅安徽医科大学第一附属医院病历系统收集所有研究对象的一般性临床资料(年龄、性别、身高、BMI、充血性心力衰竭史、高血压史、血管疾病史、糖尿病史、既往卒中史)、实验室检查结果[血尿酸(UA)、肾小球滤过率(eGFR)、血肌酐(Cr)、Hb、红细胞宽度标准差(RDW-SD)、血小板计数(PLT)、血小板分布宽度(PDW)、白细胞计数(WBC)、国际标准化比值(INR)、活化部分凝血酶原时间(APTT)、纤维蛋白原含量(FIB)]。①根据收集到的临床资料计算患者CHADS2、CHA2DS2-VASc 评分分值。CHADS2、CHA2DS2-VASc 评分均采用已经公布的标准计算(表1)。②高血压:未使用降压药物的情况下非同日3 次测量诊室收缩压≥140 mmHg 和(或)收缩压≥90 mmHg;患者既往有高血压病史,目前正在使用降压药物,血压虽然低于140/90 mmHg,亦诊断为高血压。③充血性心力衰竭:根据2016 年欧洲急慢性心力衰竭诊治指南提出的新的分类方法定义为:射血分数降低心衰(HFrEF):存在心衰的症状和(或)体征、左心射血分数(LVEF)<40%;射血分数中间值心衰(HFmrEF):存在心衰的症状和(或)体征、LVEF 40%~49%、存在相关结构性心脏病(左室肥厚/左房扩大)和(或)舒张功能障碍;射血分数保留心衰(HFpEF):存在心衰的症状和(或)体征、LVEF≥50%、存在相关结构性心脏病(左室肥厚/左房扩大)和(或)舒张功能障碍。④血管性疾病:既往心肌梗死病史、心绞痛、经皮冠状动脉介入治疗或冠状动脉搭桥治疗术后,间歇性跛行,曾行腹主动脉或下肢血管外科手术或介入治疗,动脉和(或)静脉血栓形成。
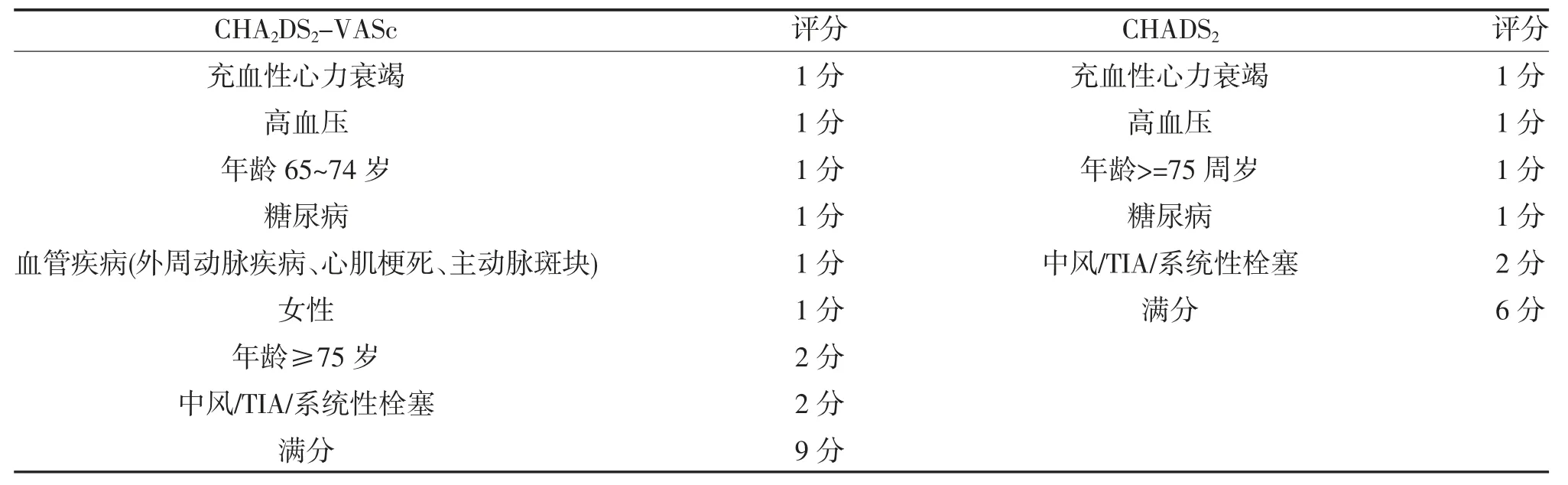
表1 CHADS2、CHA2DS2-VASc 评分均的标准计算
1.2.2 TEE 检查 于心脏彩超室行TEE 检查,采用装有X7-2t 探头(Philips Ultrasound Transducer Bothell,WA 98021 USA Made in USA of Domestic and Foreign Parts)的飞利浦EPIQ7c 超声诊断系统。检查前清除受检者口腔和食管内所有活动性异物,受检者采取左侧卧位。一般采取局部麻醉,充分麻醉咽部或食管,插送TEE 探头及后续检查由本院心脏彩超室主治及以上具有丰富检查操作经验的医生完成。左心耳血栓形成被定义为在TEE 检查过程中由多个平面轴检测到的高回声非肌肉和非心内膜肿块,左心耳血栓形成前期被定义为在整个心动周期中持续存在的具有特征性旋转运动的烟雾状物质,否则报告左心耳内未见血栓形成。根据TEE 检查结果,左心耳血栓形成及左心耳血栓形成前期患者纳入左心耳异常组,未见左心耳血栓形成患者纳入左心耳正常组。
1.3 观察指标 比较两组一般临床资料,依据统计分析结果确定对左心耳异常有独立预测价值的危险因素,评估各危险因素预测能力,将有独立预测价值的危险因素添加到CHADS2、CHA2DS2-VASC 评分中开发新的预测评分,比较各评分的预测价值。
1.4 统计学方法 使用SPASS 26.0 统计软件进行数据分析,计量资料均进行正态性检验(单样本K-S检验),非正态分布的计量资料以[M(P25,P75)]表示,采用Mann-Whitney 秩和检验;计数资料以(n)或(%)表示,采用χ2检验。采用单因素及多因素Logistic 回归分析左心耳异常相关的影响因素,并进一步应用MedCalc19.4.1 统计软件绘制ROC 曲线,以Youden 指数最大确定诊断截断值(Cut-off 值),根据ROC 曲线确定诊断的敏感性及特异性。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组临床资料比较 TEE 检查出左心耳异常者30 例,左心耳正常者633 例。两组年龄、UA、eGFR、RDW-SD、INR、APTT、FIB 及充血性心力衰竭史、高血压史、CHADS2及CHA2DS2-VASc 评分比较,差异有统计学意义(P<0.05);两组性别、身高、体重、BMI、Cr、Hb、PLT、PDW、WBC、血管疾病史、糖尿病史、既往卒中史比较,差异无统计学意义(P>0.05),见表2。
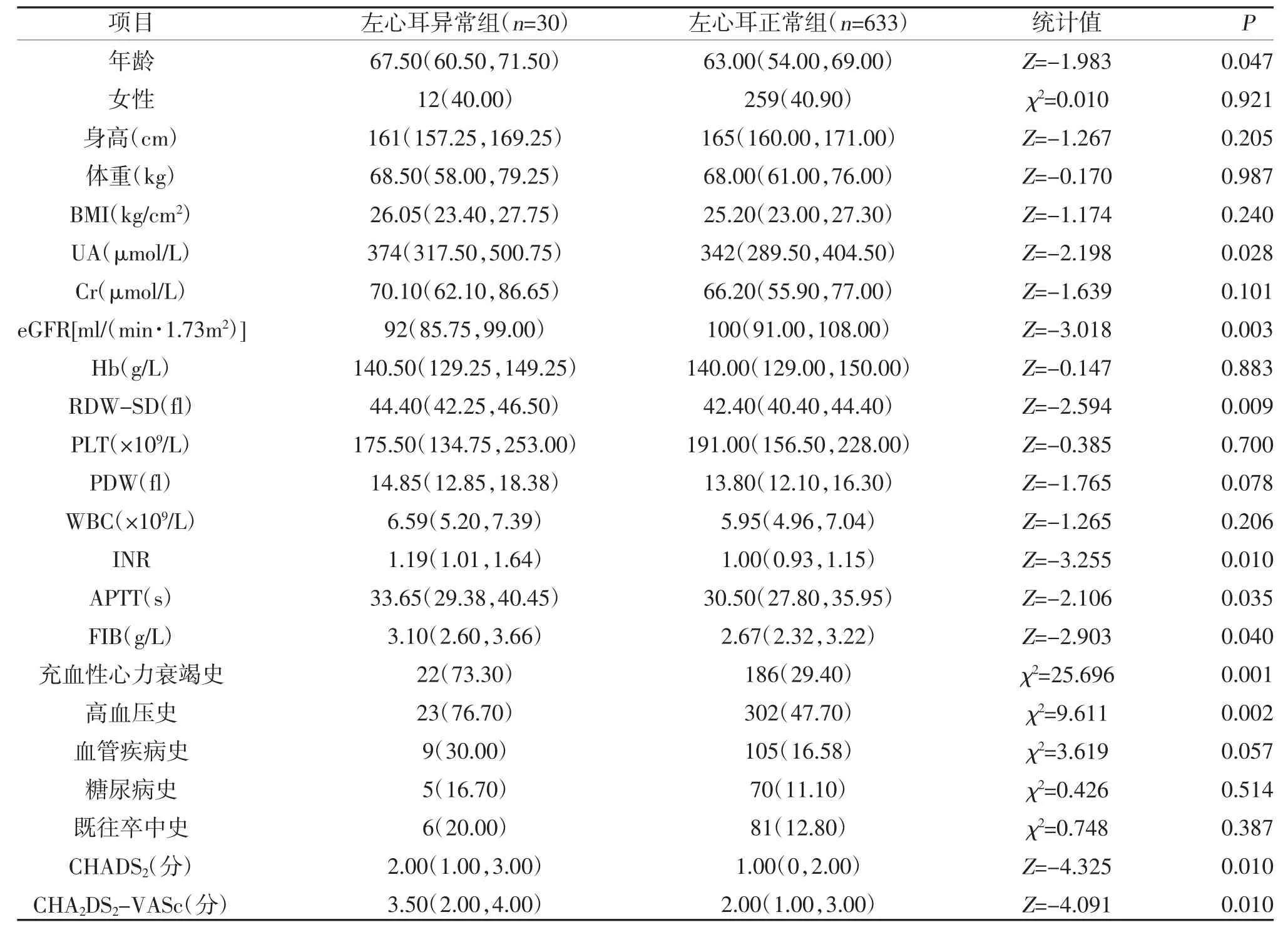
表2 两组临床资料差异性比较[M(P25,P75),n(%)]
2.2 单因素Logistic 回归分析 对两组间有统计学差异的指标进行单因素Logistic 回归分析,结果显示构成CHADS2、CHA2DS2-VASc 评分的危险因素中只有心衰及高血压是左心耳异常的预测因子,其他临床资料中UA 水平、eGFR、RDW-SD 也是左心耳异常的预测因子,见表3。
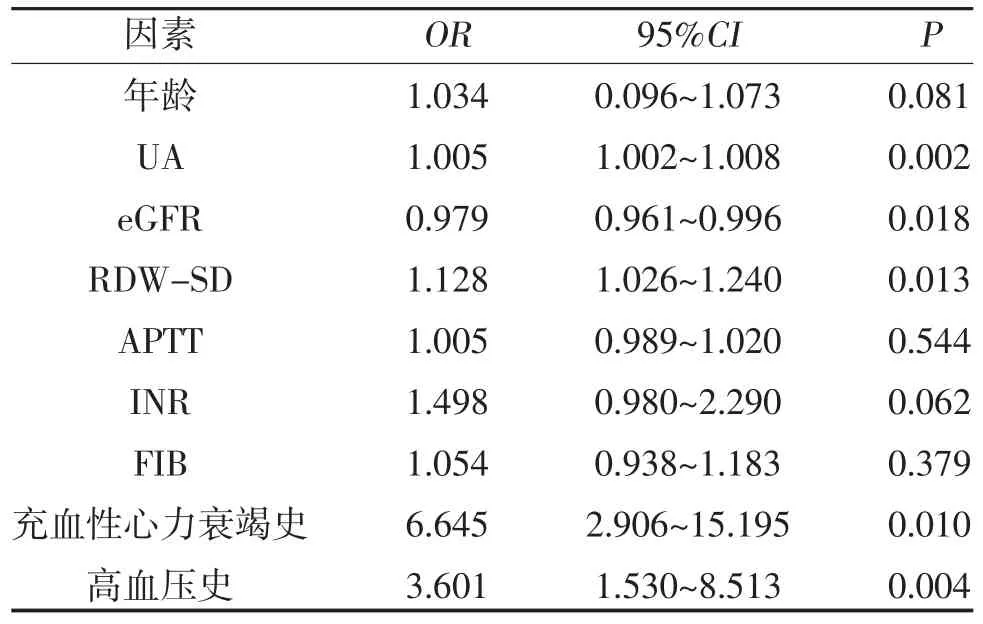
表3 两组临床资料的单因素Logistic 回归分析
2.3 多因素Logistic 回归分析 根据单因素Logistic回归筛选出与左心耳异常相关的试验指标,在校正UA 水平、eGFR、充血性心力衰竭史、高血压史、RDW-SD 等因素后,多因素Logistic 分析显示,RDW-SD、充血性心力衰竭史及高血压史是左心耳异常的独立预测因子,见表4。
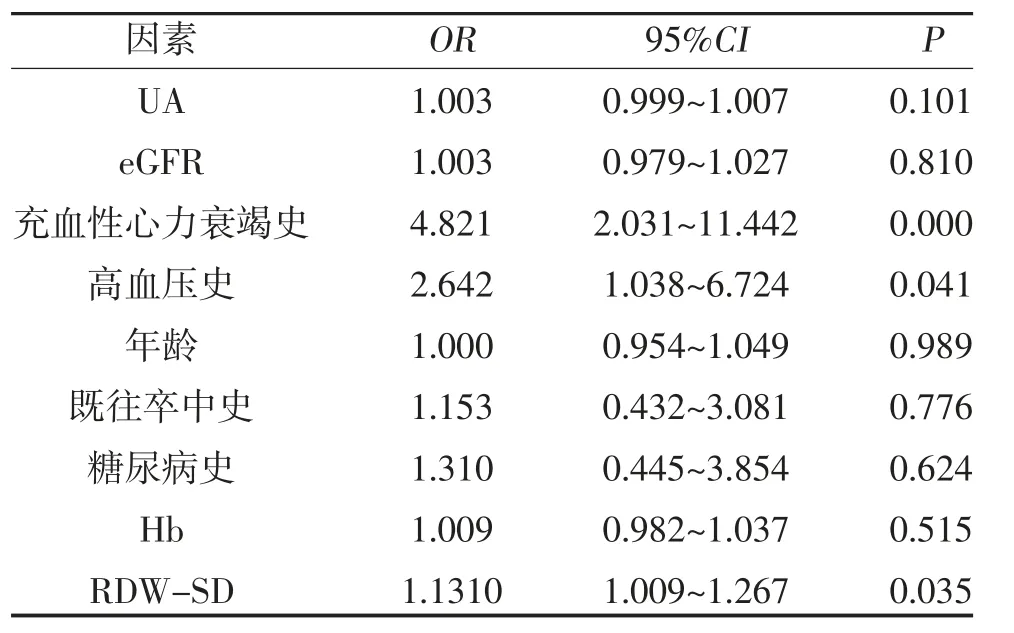
表4 两组临床资料的多因素Logistic 回归分析
2.4 ROC 曲线分析 以RDW-SD 和是否存在左心耳异常绘制ROC 曲线,得到曲线下面积(AUC)为0.640(95%CI:0.602~0.677,P=0.014),进一步计算出RDW-SD 的Youden 指数为0.2951,此时RDW-SD=43.8 fl,即当RDW-SD=43.8 fl 时,诊断患者存在左心耳异常的敏感性为69.51%,特异性为60.00%,见图1。
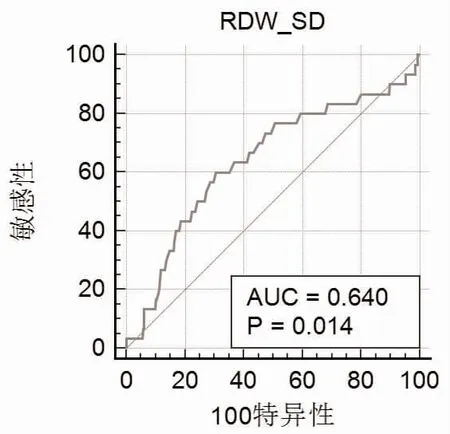
图1 RDW-SD 的ROC 曲线分析图
2.5 RDW-SD≥43.8 fl 的单因素、多因素Logistic 回归分析及ROC 曲线分析 以RDW-SD=43.81 fl 为诊断截断值(Cut-off 值),单因素Logistic 回归分析显示,RDW-SD≥43.8 fl 是左心耳异常的预测因子(OR=3.121,95%CI:1.481~6.624,P=0.003);进一步校正UA、eGFR、充血性心力衰竭史、高血压史、年龄、既往卒中史、糖尿病史、Hb 等因素后,多因素Logistic 回归显示,RDW-SD≥43.8 fl 也是左心耳异常的独立预测因子(OR=2.938,95%CI:1.271~6.790,P=0.012)。以RDW-SD≥43.8 fl 赋值1 分,RDWSD<48.3 fl 赋值0 分,将RDW-SD 添加到CHADS2、CHA2DS2-VASc 评分中构建新的房颤患者卒中及血栓形成预测评分RDW-CHADS2、RDW-CHA2DS2-VASc,绘制各评分的ROC 曲线见图2。
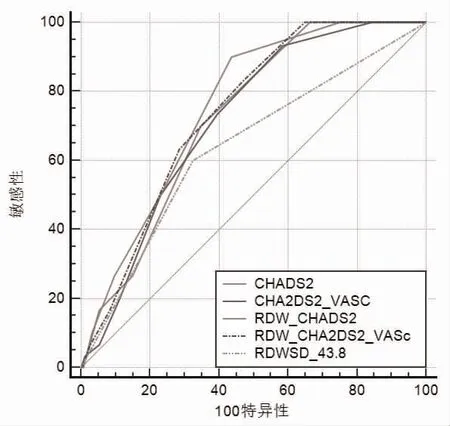
图2 RDW-SD≥43.8 fl 的ROC 曲线图
2.6 各评分ROC 曲线比较 CHADS2、CHA2DS2-VASc评分和新的RDW-CHADS2、RDW-CHA2DS2-VASc评分在诊断房颤患者左心耳异常方面均能表现出良好的预测价值,其中RDW-CHADS2评分的AUC 达到最大值0.756,但是RDW-CHADS2评分AUC 最大值和CHA2DS2-VASc 评分AUC 最小值比较,差异无统计学意义(面积之间的差异为0.0393,标准差为0.0313,95%CI:-0.022~0.101,Z=1.275,P=0.2088),见表5、表6。
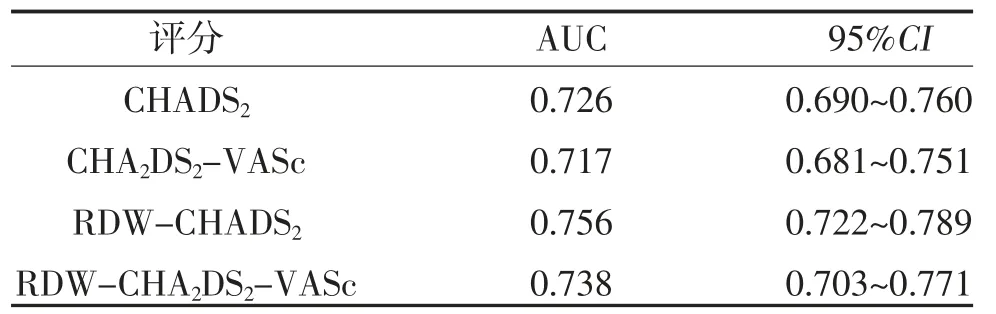
表5 各评分的ROC 曲线下面积(AUC)

表6 ROC 曲线成对比较的P 值
2.7 各评分敏感性及特异性比较 CHADS2、CHA2DS2-VASc、RDW-CHADS2评分为0 或RDWCHA2DS2-VASc 评分>1 分时,其敏感性均为100.00%,且RDW-CHA2DS2-VASc 评分特异性最大,达到35.23%,见表7。
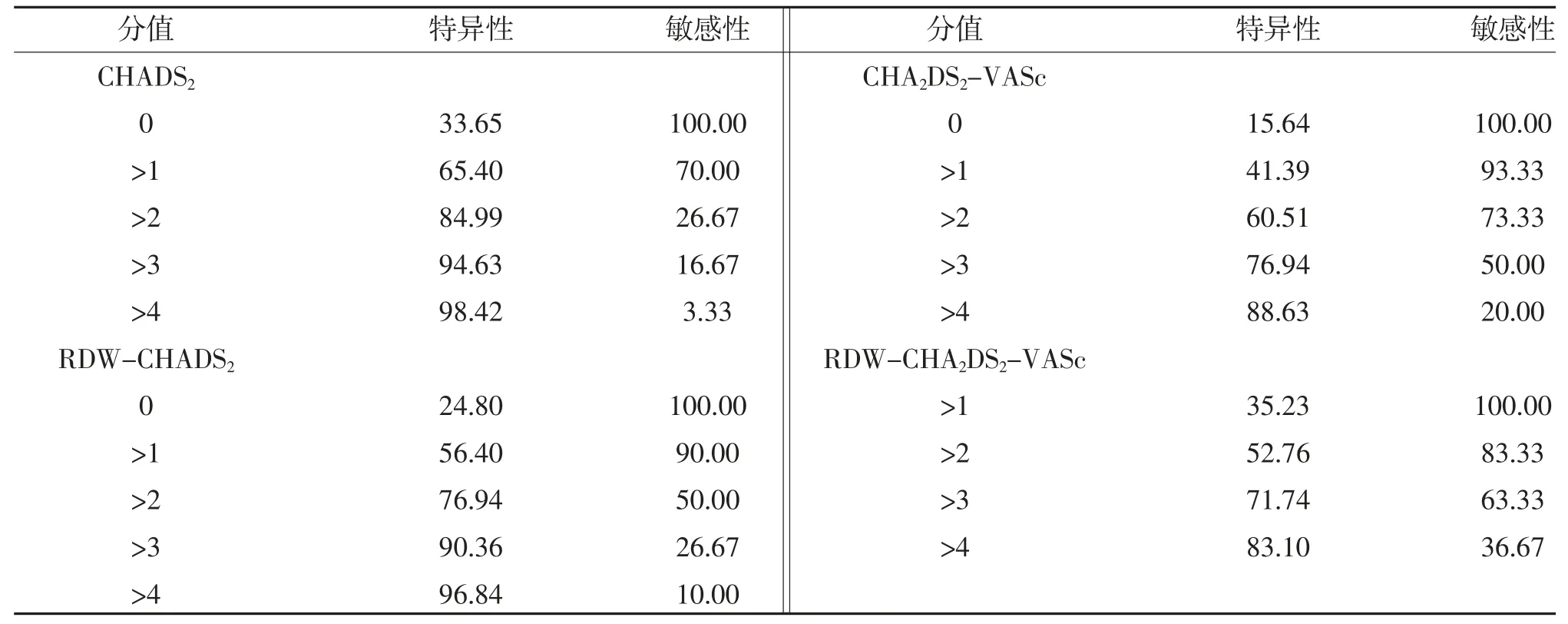
表7 各评分敏感性及特异性比较(%)
3 讨论
RDW 是反映外周血红细胞体积大小异质性程度的参数,既往主要用于血液系统疾病的诊断及鉴别诊断。RDW 增高多见于各种贫血、造血功能异常或先天性红细胞异常疾病。近年来临床研究发现RDW 与心血管系统疾病的发生、发展、严重程度及预后相关。
本研究中单因素Logistic 回归分析显示,RDWSD 是房颤患者左心耳异常的独立预测因子(OR=1.120,95%CI:1.007~1.245,P=0.037),房颤与RDWSD 水平升高的原因可能为:①RWD-SD 水平升高提示红细胞体积异质性大,变形能力低下,导致血液粘滞及红细胞破坏增加,进一步使血液携氧能力下降,组织器官缺氧增加心血管系统疾病风险,同时缺氧导致心肌细胞凋亡,心房的机械重构及电重构,最终促进房颤的发生、发展及不良事件出现[10,11];②房颤导致机体炎症反应被激活,炎症因子如肿瘤坏死因子(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)释放增加,而炎症刺激及释放的炎症因子除可以直接损伤成熟红细胞外,TNF-α、IL-1 等还可通过抑制促红细胞生成素(EPO)的合成抑制红细胞成熟过程[12,13];此外,IL-6 可以导致炎症性低铁血症[14],上述原因共同导致RDW-SD 水平升高;③房颤与机体的氧化应激相关[15],氧化应激除直接导致成熟红细胞损伤外,还可通过损伤生物大分子物质,如蛋白质、核酸等影响红细胞的生成及成熟过程,导致RDW-SD 水平升高。
目前CHA2DS2-VASc 评分针对大多数房颤患者危险分层及指导抗凝治疗是有效的,但该评分中仅包含一般性临床危险因素,近年来多项研究发现肌酐清除率、房颤类型、eGFR、高敏肌钙蛋白(cTnⅠ及cTnT)、D-二聚体、BNP、蛋白尿等生物学标记物是左心耳血栓形成的独立预测因子[16-21],基于上述危险因素开发的R2CHADS2评分、CHA2DS2-VASc-AFR评分、ATRIA 评分及ABC 评分较CHA2DS2-VASc 评分具有一定的临床应用优势。除血清学标记物外,Maheshwari A 等[22]研究发现,不正常的P 波电轴是不依赖于CHA2DS2-VASc 评分而增加患者缺血性卒中风险的因素,基于此开发出的P2-CHA2DS2-VASc评分较CHA2DS2-VASc 评分可更好地预测房颤相关缺血性卒中。另有研究证实[23-26],菜花形左心耳、左心耳分叶数、左心耳血流速度(LAAV)、左心耳壁运动速度(LAAWV)及左心耳射血分数(LAAEF)的降低等左心耳结构及功能指标是血栓形成的独立危险因素。房颤患者左心耳血栓形成受多种临床危险因素影响,寻找更加特异性的临床危险因素对指导房颤患者抗凝决策及判断预后具有重要的意义[27]。本研究通回顾性分析663 例非瓣膜病房颤患者的一般性临床资料及血清学指标,结果发现RDW-SD≥43.8 fl 是左心耳异常的预测因子,通过将RDW-SD添加到CHADS2及CHA2DS2-VASc 评分中构建出新的临床预测评分RDW-CHADS2和RDW-CHA2DS2-VASc,ROC 曲线提示CHADS2、CHA2DS2-VASc 评分和新的RDW-CHADS2、RDW-CHA2DS2-VASc 评分在诊断房颤患者左心耳异常方面均能表现出良好的预测价值,其中RDW-CHADS2评分的AUC达到最大值0.756;当诊断特敏感性为100.00%时,RDW-CHA2DS2-VASc 评分表现出的诊断特异性最高为35.23%,提示RDW -SD 在CHADS2及CHA2DS2-VASc 评分预测房颤患者的血栓形成中具有重要重要。
综上所述,RDW-SD 是非瓣膜病房颤患者左心耳异常的独立预测因子,RDW-SD 稍微提高了CHADS2及CHA2DS2-VASc 评分对房颤患者的血栓形成的预测能力。



