余 露,胡汉金
(安徽医科大学附属安庆医院影像科,安徽 安庆 246003)
乳腺癌(breast cancer)是全世界最常见的癌症之一,在女性恶性肿瘤中发病率高居首位,病死率位居第2,严重威胁女性健康[1]。乳腺癌具有高度异质性,因基因表型的多样性,使其临床生物学行为有较大差异。目前主要通过手术或穿刺活检获取部分肿瘤组织,用免疫组化方法来判定分子亚型,但由于肿瘤生长过程中存在时间和空间的异质性,该部分组织并不能完全代表肿瘤的生物学行为。且该类方法有创,易引起其他并发症,如手术后可能会引起感染、血肿、缝合脓肿等[2]。MRI 具有无创、多方位、多角度及多功能成像的优点,目前利用乳腺癌MRI 影像特征预测肿瘤的分子亚型及远期预后已成为国内外研究的热点[3-5]。本研究旨在探讨MRI 影像学特征与乳腺癌不同分子分型的相关性,期望通过MRI 影像特征间接区分分子亚型,为乳腺癌的早期诊断、个性化治疗以及预后评估提供一定的参考。
1 资料与方法
1.1 一般资料 回顾性分析2019 年1 月-2021 年4月就诊于安徽医科大学附属安庆医院160 例乳腺癌患者的临床资料,均为女性、单侧乳腺单发病灶,年龄30~74 岁,平均年龄(51.58±8.35)岁。纳入标准:①均经手术证实为乳腺癌,且具有完整的免疫组化结果;②在手术前行乳腺MRI 检查,所有扫描参数一致;③MRI 检查前未行穿刺活检等有创检查及任何治疗。排除标准:①MRI 图像质量差,如伪影较大,不能进行图像分析;②哺乳期或月经期患者。
1.2 MRI 图像采集 采用西门子MAGNETOM SKYRO 3.0T 超导磁共振扫描系统和乳腺专用四通道相控阵线圈。患者取俯卧位,双乳自然悬垂定位于专用线圈内。常规MRI 扫描序列包括:SE 序列T1WI,FSE 序列T2WI,脂肪抑制T2WI及DWI-EPI 序列。DCE-T1WI 采用乳腺容积成像动态增强扫描(volume imaging for breast assessment,VIBRANT)技术,对比剂采用Gd-DTPA,注射剂量0.2 mmol/kg,速度为2.5 ml/s,对比剂注入后用生理盐水溶液20 ml 以2 ml/s 速度冲洗导管。注射造影剂前扫描一次获得蒙片,开始注射30 s 后重复扫描5 期,单期扫描时间为1 min。
1.3 图像分析 将图像传送到后处理工作站(德国Siemens 3.0 T MRI Verio),由2 名高年资医师进行阅片,并根据BI-RADS MRI(2013 版)标准分析病灶成像特征,意见不一时商讨后达成一致。①乳腺背景实质强化程度(background parenchymal enhancement,BPE):极少、轻度、中度、显着;②形态学特征:病灶大小、类型(非肿块或肿块样)、肿块样病灶的形态、边缘和内部强化方式;③瘤周水肿和血管异常:当患病侧乳内血管长度≥3 cm 或最大径≥2 mm 时,作为有意义的异常血管[6];④绘制时间-信号强度曲线(time-signal intensity curve,TIC)计算早期强化率(early enhancement rate,EER),TIC 分为渐进型、平台型、廓清型;EER=(SIpost-SIpre)/SIpre×100%,其中SIpost 为增强后第1 期的病灶信号强度,SIpre 为增强前的信号强度;⑤表观扩散系数(apparent diffusion coefficient,ADC)值测量:于ADC 图(b=800 s/mm2)上勾画形状、大小(15~35 mm2)均匀一致的感兴趣区(region of interest,ROI),避免囊变坏死区及血管等结构,重复测量3 次取平均值。
1.4 病理检查 对所有患者的组织标本进行免疫组织SP 法检测并记录雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)和增殖标记物Ki-67的表达情况。判断标准:①ER/PR 阳性定义为阳性肿瘤细胞核≥1%,<1%为ER/PR 阴性;②HER-2 阳性定义为HER-2 表达评分(+++),(-)和(+)为HER-2 阴性,(++)为不确定病例,需要进一步行荧光原位杂交(fluorescence in situ hybridization,FISH)基因检测来判断HER-2 是否存在扩增,若基因扩增记为阳性,不扩增则为阴性;③Ki-67 采用20%作为判断高低的界值。参照2017 年St.Gallen 乳腺癌国际会议专家共识标准[7],将乳腺癌分为Luminal A 型、Luminal B 型、HER-2 过表达型及三阴性型。
1.5 统计学方法 采用SPSS 25.0 统计学软件进行数据分析。计数资料以(n,%)表示,比较采用χ2检验或Fisher 确切概率法;相关性分析采用交叉列联表,并依据Cramer's V 系数的值进行判断,当Cramer's V值<0.25 时为不相关,0.25~0.5 为低度相关,0.5~0.8为中度相关,>0.8 时为高度相关。计量资料以()表示,比较采用单因素方差(ANOVA)分析;采用受试者工作特征曲线(receiver operating characteristic,ROC)进一步分析其诊断乳腺癌分子分型的价值。以P<0.05 表示差异有统计学意义。
2 结果
2.1 基本情况 160 例患者中119 例为乳腺浸润性癌(非特殊类型),23 例为乳腺浸润性癌(特殊类型)伴导管原位癌,8 例导管原位癌、6 例浸润性小叶癌、其他病理类型4 例(黏液癌1 例、浸润性乳头状癌2例、鳞状细胞癌1 例)。Luminal A 型44 例(27.50%)、Luminal B 型66 例(41.25%)、HER-2 过表达型26 例(16.25%)、三阴性型24 例(15.00%)。
2.2 乳腺癌分子分型与临床病理特征的关系 不同分子分型乳腺癌患者年龄、绝经状态及病理类型分布比较,差异无统计学意义(P>0.05);不同分子分型乳腺癌患者淋巴结情况比较,差异有统计学意义(P<0.05),其中Luminal B 型较Luminal A 型淋巴结转移率高,见表1。
表1 不同分子分型乳腺癌患者临床病理资料比较[,n(%)]
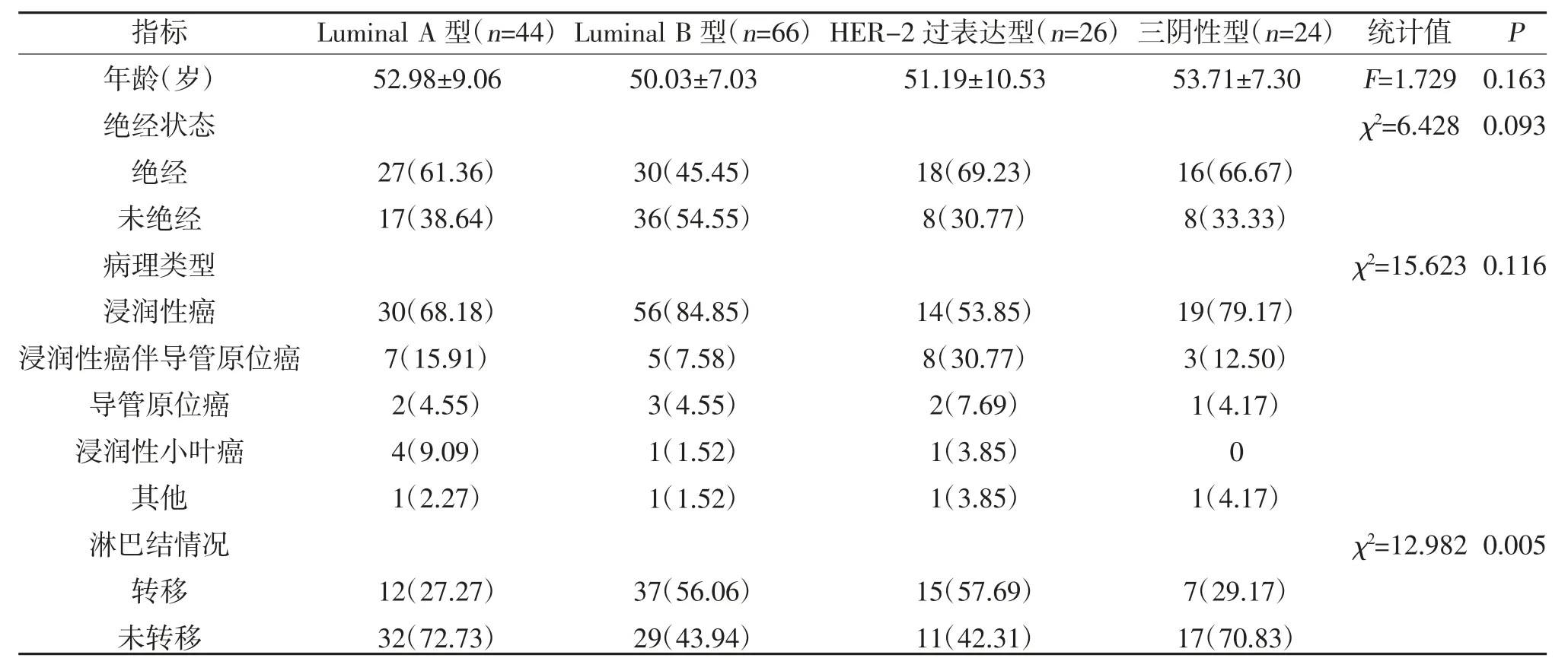
表1 不同分子分型乳腺癌患者临床病理资料比较[,n(%)]
2.3 乳腺癌分子分型与MRI 形态学特征的关系 不同分子分型乳腺癌患者病灶大小、病灶类型、肿块样病灶的形态、边缘及内部强化方式、瘤周水肿及瘤周血管异常比较,差异有统计学意义(P<0.05),其中Luminal A 型病灶大小多≤2 cm,其所占比例高于HER-2 过表达型、三阴性型;非肿块样强化更常见于HER-2 过表达型;三阴性型较Luminal A 型和Luminal B 型多表现为圆形肿块,边缘常清晰,以环形强化为主;三阴性型及HER-2 过表达型乳腺癌常伴随瘤周水肿及异常血管(图1、图2),而Luminal A型较少出现以上征象,见表2。
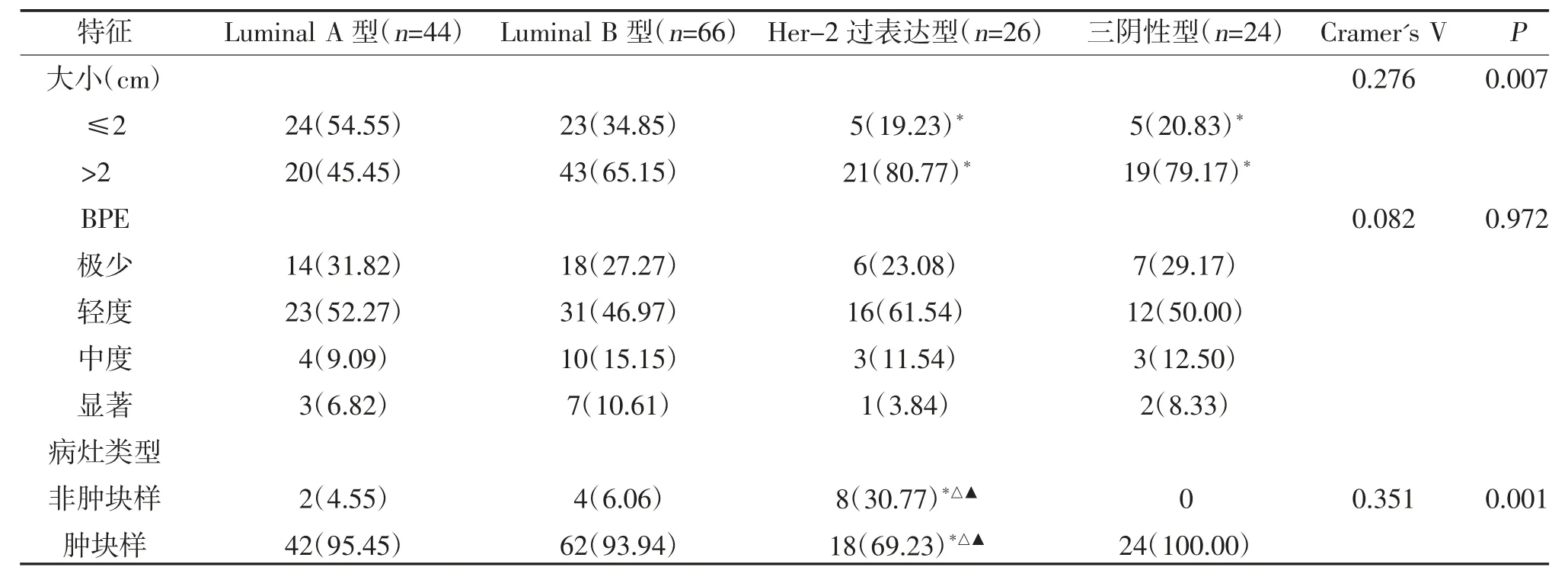
表2 不同分子分型乳腺癌患者MRI 影像特征比较[n(%)]
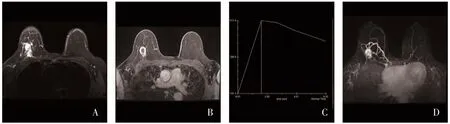
图1 三阴性型乳腺癌的MRI 影像学特征
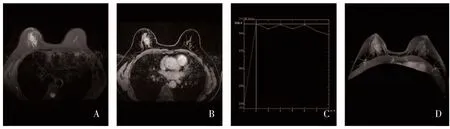
图2 HER-2 过表达型乳腺癌的MRI 影像学特征
2.4 乳腺癌分子分型与ADC 值、EER 值的关系 经单因素方差分析发现,不同分子分型乳腺癌ADC 值及EER 值比较,差异有统计学意义(P<0.05),其中HER-2 过表达型的ADC 值及EER 值高于Luminal A 型、Luminal B 型及三阴性型,见表3。通过绘制ROC 曲线,ADC及EER 两者联合诊断HER-2 过表达型乳腺癌的效能较单一ADC 值、EER 值的效能高,其ROC 曲线下面积最大(AUC=0.835),其特异性及准确率均高于两者单独诊断,见表4、图3。

图3 ADC、EER及两者联合鉴别HER-2过表达型乳腺癌的ROC 曲线
表3 不同分子分型乳腺癌的MRI 参数比较()

表3 不同分子分型乳腺癌的MRI 参数比较()
注:与Luminal A 型比较,*P<0.05;与Luminal B 型比较,△P<0.05;与三阴性型比较,▲P<0.05
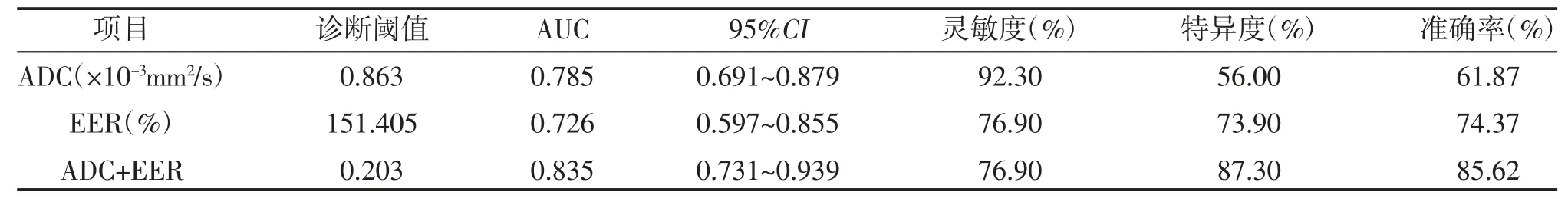
表4 ADC、EER及两者联合对HER-2 过表达型乳腺癌的诊断价值

表2(续)
3 讨论
乳腺癌的每种分子亚型在基因表达模式、临床特征、治疗反应和预后方面存在较大差异。Luminal A型乳腺癌复发风险较低、预后最好,对内分泌治疗反应良好;而Luminal B 型增殖性更强,组织学分级更高,且与早期复发风险更高和无病生存率更低相关,对内分泌治疗有效,但对化疗敏感性易变;HER-2过表达型有腋窝淋巴结转移倾向,恶性程度高,对分子靶向治疗反应良好;三阴性型乳腺癌与BRCA 1 功能障碍相关,预后通常较差,对化疗敏感[8]。
肿瘤大小及淋巴结转移是影响预后评估及全身治疗的重要因素。本研究中乳腺癌患者总的淋巴转移率约为44.37%,Luminal B 型和HER-2 过表达型淋巴结转移率较高,与国外文献报道一致[5],这可能与其侵袭性较高有关。乳腺癌TNM 分期中区分T1、T2期的指标主要是肿块最大径是否超过2 cm,本研究≤2 cm的病变中Luminal A 型所占比例最高,可能与其高生存率和低复发风险相关。
MRI 影像表现可能提示乳腺癌不同的分子亚型,例如与其他亚型相比,HER-2 过表达型易表现为非肿块样强化。有文献报道[9],HER-2 阳性乳腺癌早期易伴随导管内原位癌(ductal carcinoma in situ,DCIS),呈典型的小叶生长模式,而DCIS 具有弥散性生长特点,MRI 常呈非肿块样强化。此外,多项研究发现[10,11],三阴性型乳腺癌比其它亚型更多表现出圆形、清晰的肿块边界和边缘强化等良性形态学特征,其它亚型以不均匀强化为主。本研究也发现三阴性型较较Luminal A 型和Luminal B 型多表现为圆形肿块,边缘常清晰,以环形强化为主,可能与三阴性乳腺癌恶性度高、中心易坏死,而病灶边缘微血管密度高易纤维增生有关[12]。Luminal A 型、Luminal B 型肿块边缘多不清晰或呈毛刺样改变,可能与ER 表达阳性有关。有文献指出[13],ER 阳性表达与乳腺癌毛刺状边缘呈正相关。本研究中TIC 曲线与分子亚型间无统计学差异,与大部分研究结果一致[4,10]。此外,在不同分子分型乳腺癌中BPE 并无明显差异,可能与未根据患者年龄、月经周期分组有关。
既往研究发现[14],乳腺局灶性水肿与肿瘤恶性程度相关联,其产生机制与新生的肿瘤血管通透性增加及肿瘤周围细胞因子释放有关。本研究中HER-2 过表达型和三阴性型较Luminal A 型容易出现瘤周水肿及血管异常。洪又佳等[15]通过对187 例乳腺癌患者MRI 特征进行研究发现,HER-2 过表达型和三阴性型血管增多所占的比例是Luminal A 型的3.5 倍及4.3 倍,符合其侵袭性强、恶性程度高、预后差的临床特征。
理论上,乳腺癌侵袭性或恶性程度越高,肿瘤细胞增殖旺盛、细胞外间隙小、水分子扩散受限、ADC值减低。但本研究中具有侵袭性特征的HER-2 过表达型乳腺癌的ADC 值及EER 值均高于其它亚型,且经组间多重比较,差异有统计学意义(P<0.05),而预后较好的Luminal A 型乳腺癌的ADC 值及EER 值相对较低,与多项研究结果相似[16-18],其原因可能是HER-2 可诱导血管内皮生长因子使血管生成增加,导致总的细胞外液量及癌灶内微循环灌注增加,其增加程度超过肿瘤实质细胞增加的程度,因此ADC 值相对增高;此外,新生血管通透性增加使对比剂流入速率增快,交换增加,故EER 高[17-20]。另有研究发现[21],ER 阳性表达能够降低血管内皮生长因子的水平,阻滞肿瘤血管生成,降低微血管灌注,分子扩散相对受限,ADC 值降低。通过ROC 曲线分析发现,ADC 值联合EER 值在预测HER-2 过表达型乳腺癌的AUC、特异性及准确率上均高于两者,提示两者联合诊断对HER-2 过表达型有一定评估价值。本研究存在一定的局限性,因非肿块样强化总病例数较少且组间分布不均衡,分析ADC及EER 时将非肿块样及肿块样统一研究,可能会造成一定的偏倚,今后将扩大非肿块样样本量,进一步深入研究。
综上所述,不同分子亚型乳腺癌MRI 影像表现具有一定特征性,根据MRI 影像特征及ADC 值、EER 值有助于鉴别乳腺癌分子亚型。



