倪胜南,陈一鸣
(江苏省泗阳康达医院检验科,江苏 泗阳 223700)
扩张型心肌病(dilated cardiomyopathy,DCM)是临床上较为常见的心肌病,其是一种以左心室或双心室收缩功能障碍为特征的原发性心肌疾病,通常与心脏舒张功能密切相关[1]。流行病学调查发现[2],DCM 在成人中的患病率约为1/2500,是导致心力衰竭的常见原因,并且其患病率存在明显的年龄和地域差异。据报道[3],DCM 患者随访52 个月的死亡率为42.24%。DCM 的发病机制包括导致细胞结构和功能异常的基因突变、导致肌肉收缩力产生和传递缺陷的错误信号通路[4,5]。除此之外,血流动力学超负荷增加、心室肌重塑、过度神经体液刺激、肌细胞钙循环异常、心肌能量不足和炎症反应也会导致DCM[6]。但有研究认为[7,8],DCM 是一种家族性遗传倾向疾病,与遗传密切相关,对患者亲属进行相关基因检测,有利于潜在的DCM 患者识别。然而,目前DCM 的发病机制仍不明确,但较多的研究证据表明DCM 的致病涉及多种生理过程,包括凋亡、坏死和自噬等[9,10],而在这些生物学过程中,自噬在DCM 的致病过程中发挥着至关重要的作用。虽然研究发现DCM 致病与自噬有相关性,但其具体的作用机制仍尚不明确。基于此,本研究利用生物信息学方法,通过分析来自GEO 数据库中的GSE3586 数据集,探索DCM 自噬相关基因的差异表达,对差异性表达的自噬相关基因利用蛋白质-蛋白质相互作用(PPI)、相关分析、基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路富集分析,从基因转录的层面分析自噬与DCM 的致病关系,为DCM 的治疗及理论研究提供参考。
1 材料与方法
1.1 自噬相关基因数据集和微阵列数据 通过人类自噬数据库(http://www.autophagy.lu/index.html)检索获得67 个自噬基因。从GEO(http://www.ncbi.nlm.nih.gov/geo/)数据库下载GSE3586 数据集中样本为室间隔的mRNA 表达谱数据,其中包含13 个DCM室间隔样本和15 个正常人群室间隔样本。
1.2 自噬相关基因的差异表达分析 利用R 语言通过GEOquery 包从GEO 数据库中下载GSE3586 数据,同时去除掉一个探针对应多个分子的探针,当遇到对应同一个分子的探针时,仅保留信号值最大的探针。过滤后的数据将使用R 语言“sva”包的Com-Bat 函数去除批间差。然后,通过PCA 图查看样本分组间聚类情况,接着利用“limma”包进行两组的差异分析,用于识别自噬相关差异基因。P值<0.05 和绝对倍数变化值>0.25 的基因被认为是差异表达的基因。利用R 软件的“heatmap”和“ggplot2”包绘制热图、火山图和箱线图。
1.3 自噬相关差异基因的PPI 分析和相关分析 将自噬相关差异基因上传到STRING 数据库(http://string-db.org)构建PPI 网络,并通过R 语言“igraph”包、“ggraph”包对自噬相关差异基因的PPI 网络进行分析。差异表达的自噬相关基因的相关性通过“ggraph”包进行Spearman 相关性分析。
1.4 自噬相关差异基因的GO 和KEGG 通路富集分析 利用R 软件中的“ggplot2”包、“clusterProfiler”包、“GOplot”包、“org.Hs.eg.db”包对自噬相关差异基因进行GO 和KEGG 通路富集分析,并绘制相关气泡图、柱状图、弦图等,其中包括生物过程(BP)、细胞成分(CC)、分子功能(MF)。
2 结果
2.1 DCM 自噬相关差异表达基因的分析 通过主成分分析(PCA)对数据集GSE3586 中组内数据重复性进行分析,结果表明数据集中的数据重复性良好,见图1A。从以上数据集中共检索得到15 494 个与DCM 相关的基因并与人类自噬数据库检索得到的67 个自噬基因可视化绘制韦恩图,见图1B。对两者的155 个交集基因以|LogFC|>0.25和P<0.05 为标准分析筛选得到21 个DCM 自噬相关表达差异基因,其中15 个上调基因和6 个下调基因。用R 软件对GSE3586 数据集进行分析,同时以火山图和热图的形式对DCM 组和对照组之间DCM 自噬相关差异表达的21 个基因进行可视化展示,见图1C 和图1D。此外,通过箱线图对DCM 组和正常样本之间自噬相关表达差异的21 个基因进行显示,见图2。

图1 DCM 和对照组差异表达的自噬相关基因

图2 DCM 和正常样本中21 个差异表达的自噬相关基因的箱线图
2.2 DCM 自噬相关差异表达基因的PPI 网络及相关性分析 通过PPI 网络分析确定DCM 差异表达的自噬相关基因之间的相互作用,结果表明DCM自噬相关差异表达基因之间存在相互作用,见图3A,并且对每个差异基因的相互作用数目进行统计,其中21 个自噬相关蛋白中HSPA8 和BCL2L1与其他蛋白的相互作用最强,有10 个节点,见图3B。通过Spearman 相关性分析探索DCM 自噬相关差异表达基因的相关性,结果显示GSE3586 数据集中21 个DCM 自噬相关差异表达基因之间的相互关系,见图4。
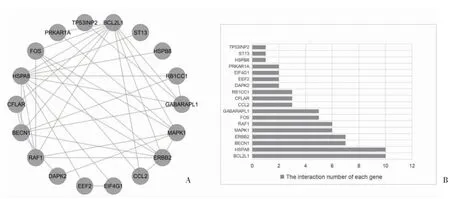
图3 21 个差异表达的自噬相关基因PPI 网络及分析

图4 29 个差异表达的DCM 自噬相关基因的Spearman 相关分析
2.3 DCM 自噬相关差异表达基因的GO 和KEGG 富集分析 GO 和KEGG 富集分析DCM 自噬相关差异表达基因的潜在生物学功能,GO 富集分析表明,细胞自噬通过自噬、利用自噬机制的过程、对表皮生长因子的反应和细胞对细胞外刺激的反应参与DCM的生物过程,通过自噬体、伪足、伴侣复合体和膜筏的过程参与细胞组成成分,同时通过泛素蛋白连接酶结合、泛素样蛋白连接酶结合、β-微管蛋白结合和分子适配器活性参与分子功能,见图5。KEGG 通路富集分析显示,DCM 自噬相关差异基因主要通过参与自噬、凋亡和内分泌抵抗等通路参与DCM 的致病过程,见图6、表1。

表1 KEGG 通路分析表格

图5 21 个差异表达的自噬相关基因的GO 富集分析
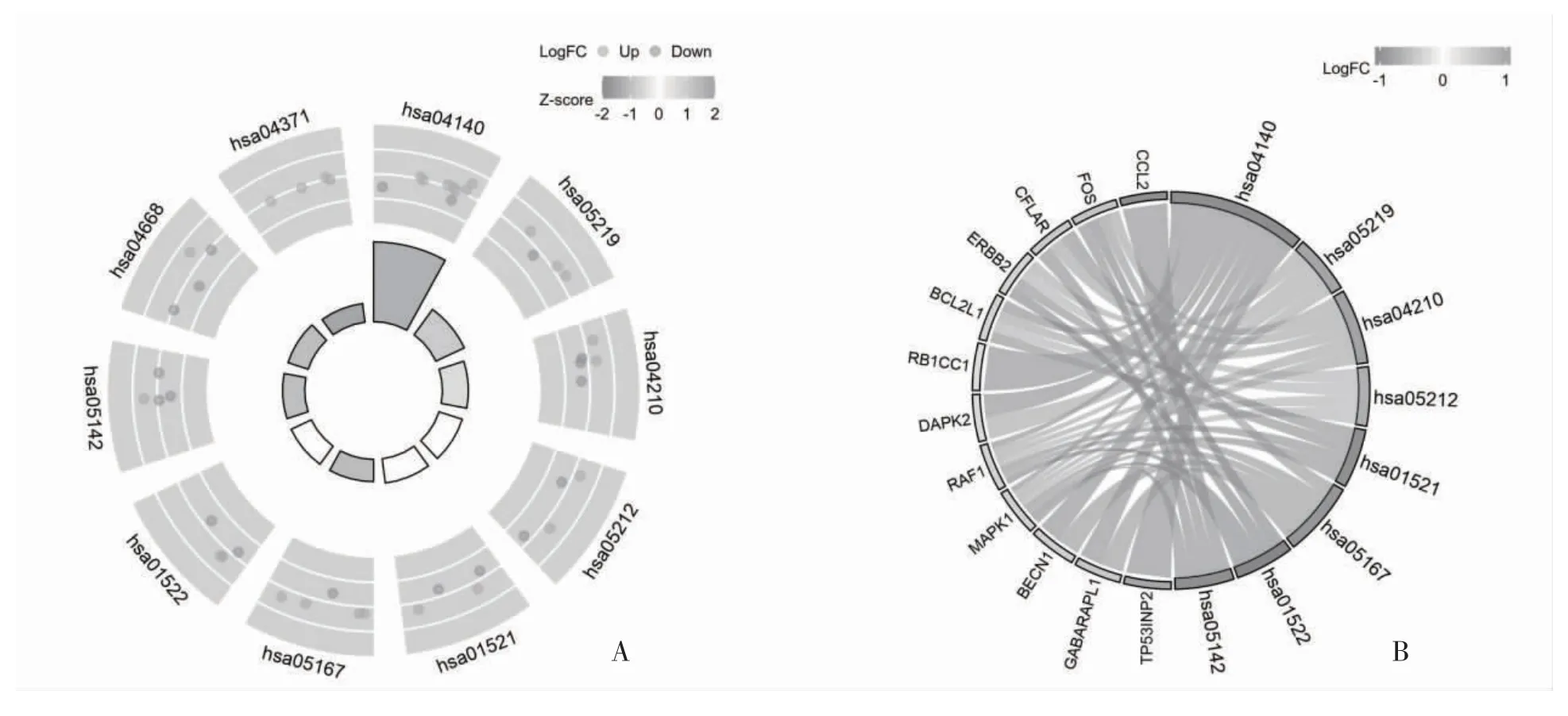
图6 21 个差异表达的自噬相关基因KEGG 通路分析
3 讨论
DCM 的致病机制研究主要涉及遗传、基因突变、血流动力学异常、心肌重塑、神经体液调节、心肌能量代谢异常、炎症及感染、凋亡、自噬等各个方面[11]。自噬是真核生物中生物分子和受损细胞器降解和循环的一个高度进化和高度保守的过程[12],广泛涉及病理生理过程,与癌症以及心血管、神经退行性、代谢、肺、肾脏、感染性、肌肉骨骼和眼部疾病等密切相关[13,14]。
本研究通过生物信息学工具分析得到21 个DCM 致病基因与自噬密切相关。Raf1 是一种丝氨酸/苏氨酸蛋白激酶[15],本研究发现RAF 是扩张型心肌病自噬过程中的重要靶基因。Li S等[16]研究发现,RAF 可以通过Raf1-ERK-Smad 通路促进纤维化。IL1B 和TNF 等炎症因子能促进RAF1 蛋白的表达,过表达RAF1 反之通过RAF1-MAPK1-NF-B信号通路诱导炎症介质的表达和分泌[17]。此外,研究发现[18],MAPK1 可以通过mTOR 信号通路参与细胞自噬。本研究根据PPI 发现,RAF1 与MAPK1 存在相互作用关系,RAF1-ERK/MAPK1-mTOR 信号通路可能是DCM 自噬的潜在信号通路。
蛋白激酶(DAPK)2 是一种钙调蛋白调节蛋白激酶,其与程序性细胞死亡、自噬调节和多种发育过程有关。生物信息学分析发现,DAPK2 是DCM 的核心靶基因之一。Shiloh R等[19]研究发现,APMK 通过磷酸化激活DAPK2,被AMPK 磷酸化激活后可以磷酸化Beclin-1,从而促进自噬。细胞内钙离子超载可以直接调节DAPK2 与mTORC1 相互作用并使mTOR 磷酸化,磷酸化激活的mTOR 可以通过自噬、氧化应激及细胞凋亡发挥作用[20]。而当DAMK2去磷酸化后,可由Ca2+/CaM 信号通路抑制细胞自噬[21]。因此,DAPK2-Ca/CaM-mTOR 信号通路在DCM 病程中发挥着重要作用。
此外,本研究发现BECN1 也是DCM 自噬相关核心基因。BECN1/Beclin1 是一种中心蛋白,它参与组装形成BECN1-PIK3C3-PIK3R4 复合物辅助因子以触发自噬蛋白级联反应,TRIM59-NFKB/TRAF6-BECN1-PIK3C3-PIK3R4 复合物通过触发自噬蛋白级联反应调节自噬,TRIM59 通过负向调节NF-κB通路来调节BECN1 的转录。另一方面,TRIM59 调节TRAF6 诱导的K63 连接的BECN1 泛素化,从而影响BECN1-PIK3C3 复合物的形成[22,23]。另有研究发现[24],炎症因子IL-6 也可通过JAK2/BECN1/PI3KC3复合物轴诱导激活BECN 诱导自噬。因此,IL-6 和NF-κB/TRAF6 通过BECN1-PIK3C3-PIK3R4 复合物信号通路在DCM 的发生和进展中发挥作用。
PI3K-AKT-mTOR 信号通路是自噬的经典通路,Tong X等[25]研究发现,FOS 的持续激活通过PI3K-AKT 信号通路激活自噬,同时FOS 的过表达可以直接激活BECN1/Beclin1 诱导自噬,本研究也得到相同结果,分析认为是FOS 可能通过PI3K-AKT-BECN1/Beclin1 信号通路在DCM 中发挥作用。
HSPA8 和HSPB8 主要参与细胞内蛋白质稳态的维持,两者在自噬中发挥着重要作用。HSPA8 和HSPB8 与BAG3、STUB1/CHIP 蛋白一起形成伴侣辅助选择性自噬(CASA)复合物,CASA 复合物能够识别并结合错误折叠的蛋白质,并将它们沿着微管驱动到微管组织中心(MTOC),以便插入自噬体并随后被溶酶体降解[26]。Qiang L等[27]研究发现,CCL2 转录需要依赖于AMPK-BRAF-MAPK1/3/ERK-激活蛋白1(AP1)通路,而该通路与自噬密切相关。此外,GABARAP 通过正向调节ULK1 活性以及吞噬细胞和自噬体的形成参与自噬过程[28]。而TP53INP2 可以通过促进与LC3B-ATG7 相互作用,进一步在自噬体生物过程中发挥作用[29]。Mavrakis M等[30]研究发现,蛋白激酶A(PRKAR1A)的调节亚基在自噬体成熟过程中发挥着重要作用。而VAMP3 与自噬小体在被识别和被吞噬密切相关[31]。Yamano K等[32]研究发现,EIF4G1 通过调节mTOR 的表达和磷酸化发挥自噬作用,而RA1CC1 通过CALCOCO2-RB1CC1-PRKN 介导的线粒体发挥自噬作用。此外,RB1CC1介导的自噬可以激活成纤维细胞,而抑制RB1CC1后在减轻自噬的同时可以起到抗纤维化的作用[33]。同时,Li F等[34]研究发现,ErbB2-AKT-FoxO3a 轴下调自噬后可以减轻细胞凋亡。因此,上述靶基因通过自噬小体的形成、成熟、识别降解过程在DCM 中发挥作用。
综上所述,自噬通过多靶点、多通路在DCM 疾病发生及进展中发挥作用。



