徐丽丽 郑薇 袁仙仙 马恺文 张浦杨 李光辉

基金项目:国家自然科学基金资助项目(82301916,82171671);北京市卫生健康委员会高层次公共卫生技术人才建设项目培养计划(领军人才-02-02)
引用本文:徐丽丽,郑薇,袁仙仙,等. 孕前正常BMI孕妇孕早期体成分与妊娠期糖尿病关系的研究[J]. 中国全科医学,2024,27(29):3602-3607,3615. DOI:10.12114/j.issn.1007-9572.2024.0023. [www.chinagp.net]
XU L L,ZHENG W,YUAN X X,et al. The relationship between body composition in early pregnancy and gestational diabetes mellitus in a population of normal BMI pregnant women[J]. Chinese General Practice,2024,27(29):3602-3607,3615.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 背景 妊娠期糖尿病(GDM)对母儿的近远期健康造成影响。孕前BMI与GDM密切相关,但BMI无法评估脂肪与脂肪分布情况,因此仅用其评估肥胖存在一定缺陷。隐性肥胖人群[BMI正常但体脂百分比(PBF)>30%]及正常体质量伴中心性肥胖人群[BMI正常但内脏脂肪面积(VFA)≥80 cm2]存在着不同程度的代谢异常,然而在临床中此部分人群常被忽视,关于其与GDM关系的研究相对缺乏。目的 分析孕前正常BMI孕妇孕早期体成分与GDM的相关性并探讨脂肪分布情况与GDM的关系。方法 本研究纳入2018年10月—2022年10月于首都医科大学附属北京妇产医院产科门诊建档,孕早期自愿接受营养评价并定期产前检查至妊娠24~28周的单胎孕妇1 938例。研究对象于孕早期(6~16周)进行人体成分检测、妊娠24~28周行口服葡萄糖耐量试验(OGTT)。根据OGTT结果,将研究对象分为GDM组(n=382)和正常组(n=1 556)。采用二元Logistic回归分析探究孕早期体成分及体脂分布与GDM的关系。结果 GDM组孕妇体脂量(BFM)、VFA、PBF、脂肪质量指数(FMI)均高于正常组(P<0.05)。二元Logistic回归分析结果显示,孕早期BFM、VFA、PBF、FMI升高(OR=1.044,95%CI=1.012~1.078;OR=1.007,95%CI=1.002~1.012;OR=1.041,95%CI=1.012~1.070;OR=1.138,95%CI=1.043~1.241)(P<0.05)和中心性肥胖即VFA≥80 cm2(OR=1.396,95%CI=1.101~1.770,P<0.05)是GDM发生的危险因素。Spearman秩相关分析显示,BFM、VFA、PBF、FMI与OGTT各时点血糖呈正相关(P<0.05)。结论 在孕前正常BMI孕妇中,孕早期BFM、VFA、PBF、FMI是GDM发生的危险因素,中心性肥胖即VFA≥80 cm2可以独立预测GDM的发生。产检时需要关注孕妇的脂肪分布,对于中心性肥胖人群加强孕期管理。
【关键词】 妊娠期糖尿病;妊娠初期;体成分;体脂百分比;内脏脂肪面积;中心性肥胖;影响因素分析
【中图分类号】 R 714.256 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2024.0023
The Relationship between Body Composition in Early Pregnancy and Gestational Diabetes Mellitus in a Population of Normal BMI Pregnant Women
XU Lili,ZHENG Wei,YUAN Xianxian,MA Kaiwen,ZHANG Puyang,LI Guanghui*
Division of Endocrinology and Metabolism,Department of Obstetrics,Beijing Obstetrics and Gynecology Hospital,Capital Medical University,Beijing 100026,China
*Corresponding author:LI Guanghui,Chief physician/Professor;E-mail:liguanghui@ccmu.edu.cn
【Abstract】 Background Gestational diabetes mellitus(GDM) is closely related to the short-term and long-term health outcomes of the mothers and offspring. Pre-pregnancy BMI is strongly associated with GDM,nevertheless,it does not distinguish between body fat content and fat distribution. Only using it to assess obesity is flawed. Normal weight obesity(normal BMI but body fat percentage above 30%) and normal weight with central obesity(normal BMI but visceral fat area above 80 cm2)
show different degree of metabolic dysregulation. However,those population are usually overlooked in clinical practice and there is a paucity of research on those population and GDM. Objective To explore the correlation between body composition in early pregnancy and GDM in a population of normal pre-pregnancy BMI,and to investigate the relationship between fat distribution and GDM. Methods We performed a study that included 1 938 singleton pregnant women registered in the obstetric out-patient clinic of Beijing Obstetrics and Gynecology Hospital,Capital Medical University from October 2018 to October 2022. They voluntarily underwent nutritional assessment in early pregnancy and had regular pregnancy check-ups until 24-28 weeks of gestation,who underwent body composition testing in early pregnancy(6-16 weeks)and oral glucose tolerance test(OGTT) at 24-28 weeks. According to the OGTT results,the study population were divided into the GDM group(n=382) and the normal group(n=1 556). We estimated the relationship between body composition and fat distribution with GDM in early pregnancy with binary Logistic regression. Results Body fat mass(BFM),visceral fat area(VFA),percentage body fat(PBF),and fat mass index(FMI)in the GDM group were higher than in the normal group(P<0.05). BFM,VFA,PBF,FMI(OR=1.044,95%CI=1.012-1.078;OR=1.007,95%CI=1.002-1.012;OR=1.041,95%CI=1.012-1.070;OR=1.138,95%CI=1.043-1.241)(P<0.05) and central obesity(VFA≥80 cm2)(OR=1.396,95%CI=1.101-1.770,P<0.05) associated with a significant increased risk for GDM with binary Logistic regression analysis. Spearman rank correlation analysis showed that BFM,VFA,PBF,FMI and blood glucose of the OGTT test were positively correlated(P<0.05). Conclusion Among normal pre-pregnancy BMI women,BFM,VFA,PBF,and FMI in early pregnancy were the risk factors of GDM. Central obesity(VFA≥
80 cm2) could independently predict the development of GDM. It is necessary to pay attention to fat distribution during pregnancy check-ups and to strengthen the pregnancy management for central obesity women.
【Key words】 Gestational diabetes mellitus;Pregnancy trimester,first;Body composition;Percentage of body fat;Visceral fat area;Central obesity;Root cause analysis
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期特有的代谢障碍性疾病,全球GDM发生率约为14%,不同国家之间发生率存在较大差异[1],我国GDM患病率达14.8%~19.7%[2],且呈逐年上升趋势。GDM对母儿的近远期健康会造成不良影响,易造成母亲子痫前期、早产、巨大儿[3-4]等不良妊娠结局,并增加患2型糖尿病(T2DM)及心血管疾病风险[5-6];增加新生儿黄疸及呼吸系统疾病风险[4-5],子代发生肥胖、T2DM[7-9]风险亦增加。孕前超重或肥胖会增加GDM发生的风险[10-11],孕前BMI每增加1 kg/m2,GDM患病率就增加0.92%[12]。国外有学者认为隐性肥胖人群,即:体质量、BMI正常,体脂百分比(percentage body fat,PBF)>30%[13],会增加代谢风险,如血脂异常、糖尿病,并且容易发生中心性肥胖[14]。正常体质量伴中心性肥胖同样会导致糖脂代谢异常[15]。有研究表明在相同的BMI情况下,亚洲人有着更高的PBF[16],内脏脂肪同时也有堆积的倾向[17]。而BMI无法辨别脂肪及脂肪分布情况,存在缺陷[18],如果单纯使用BMI评估肥胖,可能会低估肥胖的患病率[19]。在产检过程中,正常BMI孕妇中的特殊肥胖亚型常被忽视,并且对其具体情况及与GDM发生的关系尚不清楚。因此本研究聚焦孕前正常BMI人群,使用生物电阻抗法(bioimpedance analysis method,BIA)探究孕早期体成分、脂肪分布情况与GDM的关系,旨在为临床肥胖人群的识别提供
依据。
1 对象与方法
1.1 研究对象
选取2018年10月—2022年10月于首都医科大学附属北京妇产医院产科门诊建档,孕早期(6~16周)自愿接受营养评价并定期产前检查至妊娠24~28周的单胎孕妇。纳入标准:年龄18~40岁、孕前BMI正常(18.5~<24.0 kg/m2)[20]、单胎妊娠、孕早期进行人体成分检测、孕中期(24~28周)行口服葡萄糖耐量试验
(oral glucose tolerance test,OGTT)、基线资料及病史完整。排除标准:孕前或孕早期已诊断为糖尿病或妊娠期有其他代谢性疾病(肾脏疾病、自身免疫性疾病及结缔组织病等)。根据纳入、排除标准,最终有1 938例孕妇符合条件。本研究经首都医科大学附属北京妇产医院伦理委员会批准(2018-ky-009-01)。
1.2 基本资料收集
收集孕妇临床资料、OGTT结果及体成分数据,分析在正常BMI下孕妇体成分与GDM之间的关系。
1.2.1 体成分检测仪器及方法:采用InBody770型营养分析仪,依据生物电阻抗分析原理测量并记录孕妇体成分指标。测量前3 h不可进食或运动,测量前24 h不可摄入大量酒精及大量咖啡因。具体方法如下:孕妇排空膀胱、去除金属饰品,站立约5 min,脱掉鞋袜,穿着轻便衣物,湿纸巾擦拭手脚,光脚平行站立于足形电极上,脚后跟与脚部电极齐平,两手自然下垂,测量体质量;确认个人信息无误后,双手握住分析仪手柄,大拇指放在椭圆形电极上,双臂伸直,不与身体其他部位接触,保持放松,直到测试完成。检测时间1~2 min,全程均在经过培训的护士指导下进行。
1.2.2 资料收集:通过临床电子病历采集系统收集孕妇的年龄、出生日期、末次月经、孕产次、文化程度、OGTT时的体质量、既往史(包括糖尿病、肾脏疾病、自身免疫病等)、家族史;体格检查资料包括:孕前身高及体质量,以孕前体质量(kg)/身高2(m2)计算孕前BMI;体成分资料包括:细胞内液量(intracellular water,ICW)、细胞外液量(extracellular water,ECW)、蛋白质(protein)、矿物质(minerals)、体脂肪量(body fat mass,BFM),其衍生指标包括:身体总水量(total body water,TBW)、去脂体质量(free fat mass,FFM)、肌肉量(soft lean mass,SLM)、骨骼肌量(skeletal muscle mass,SMM)、骨骼肌质量指数(skeletal muscle mass index,SMI)、PBF、脂肪质量指数(fat mass index,FMI)、无脂肪质量指数(fat-free mass index,FFMI)、内脏脂肪面积(visceral fat are,VFA)[21]。
为进一步探究脂肪分布与GDM的关系,根据孕早期PBF将孕妇分为PBF参照(PBF<30%)和隐性肥胖(PBF≥30%);再根据孕早期VFA将孕妇分为VFA参照(VFA<80 cm2)和中心性肥胖(VFA≥
80 cm2)[13,22]。辅助检查资料包括:孕早期空腹血糖(fasting plasma glucose,FPG)、三酰甘油(triglyceride,TG);孕中期检测OGTT结果。
1.2.3 妊娠期糖尿病诊断标准:妊娠24~28周行OGTT试验,具体如下:口服含75 g葡萄糖(无水葡萄糖粉)的液体300 mL,分别抽取服糖前及服糖后1、2 h
的静脉血(从开始饮用葡萄糖水计算时间),放入含有氟化钠的试管中,采用葡萄糖氧化酶法测定血浆葡萄糖水平,空腹及口服葡萄糖后1、2 h的血糖阈值分别为5.1、10.0、8.5 mmol/L,任何一个时间点血糖值达到或超过上述标准即诊断为GDM[23]。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。非正态分布的计量资料采用M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;计数资料以相对数表示,组间比较采用χ2检验。将单因素分析中差异有统计学意义的体成分指标纳入二元Logistic回归分析,分析体成分与GDM之间的关系。采用Spearman秩相关分析探究体成分指标与空腹及口服葡萄糖后1、2 h血糖水平的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 两组研究对象的一般情况及体成分指标比较
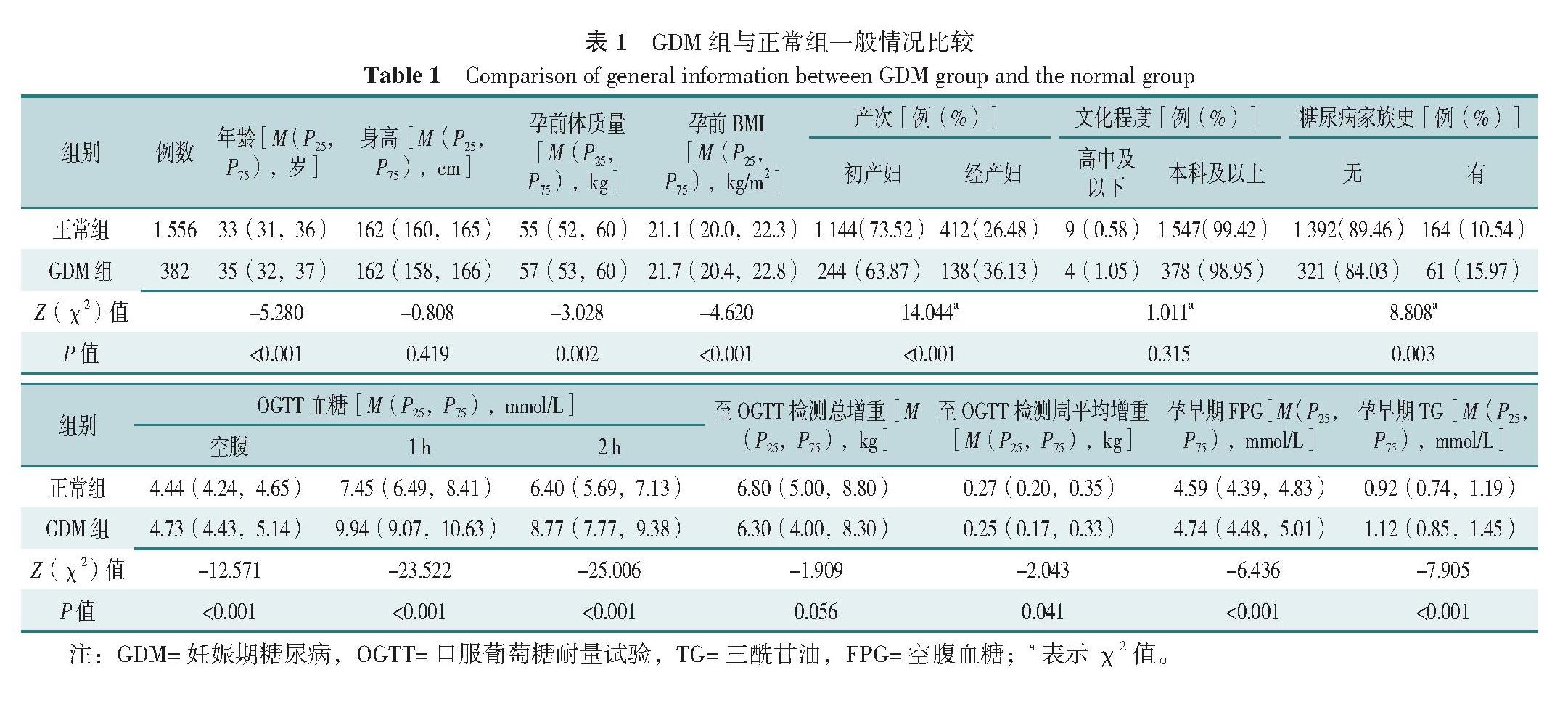
根据纳入与排除标准,共1 938例孕妇最终进入本研究,其中GDM组孕妇382例(19.71%),正常组孕妇1 556例(80.29%)。GDM组孕妇年龄、孕前体质量、孕前BMI、孕早期FPG、孕早期TG水平、OGTT试验各时点血糖及经产妇、糖尿病家族史所占比例均高于正常组,至OGTT检测周平均增重小于正常组,差异均有统计学意义(P<0.05);两组身高、文化程度、至OGTT检测总增重比较,差异均无统计学意义(P>0.05),见表1。
GDM组孕妇BFM、VFA、PBF、FMI均高于正常组,差异有统计学意义(P<0.05);两组ICW、ECW、TBW、protein、minerals、SLM、SMM、FFM、FFMI、SMI比较,差异均无统计学意义(P>0.05),见表2。
2.2 正常BMI孕妇孕早期体成分与GDM相关性的二元Logistic回归分析
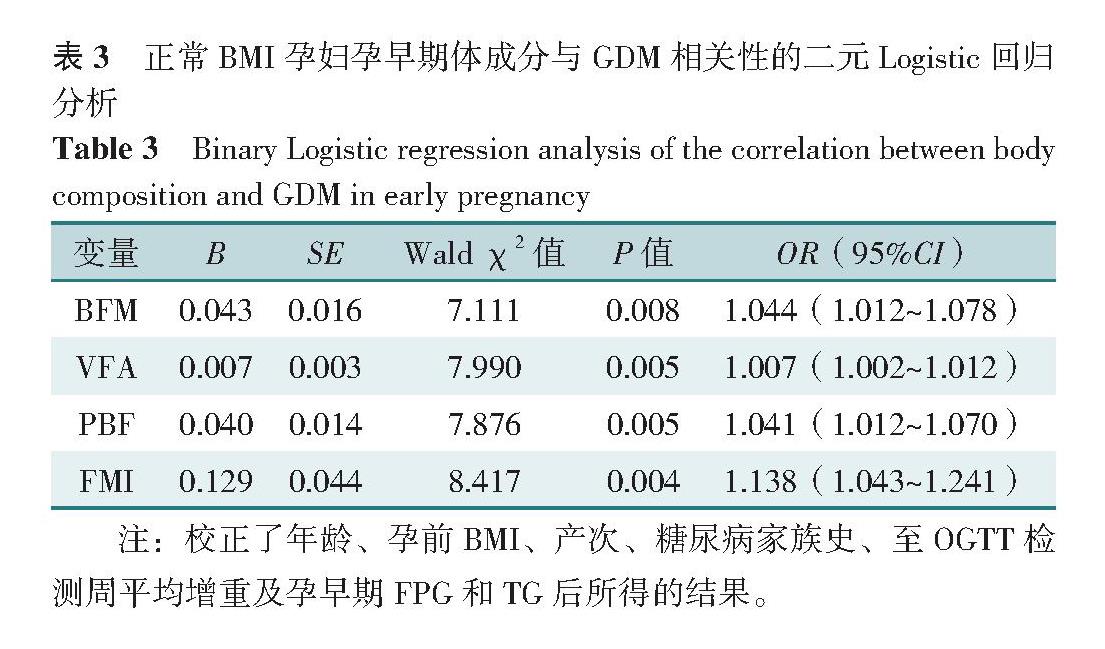
以是否发生GDM为因变量(赋值:是=1,否=0),以BFM、VFA、PBF、FMI为自变量(赋值为实测值),进行二元Logistic回归分析。在未调整任何变量的情况下,结果显示,BFM、VFA、PBF、FMI均为正常BMI孕妇发生GDM的影响因素(OR=1.067,95%CI=1.035~1.099;OR=1.011,95%CI=1.006~1.016;OR=1.062,95%CI=1.034~1.090;OR=1.216,95%CI=1.120~1.320)(P<0.05)。在调整了孕妇年龄(赋值为实测值)、孕前BMI(赋值为实测值)、产次(赋值:经产妇=1,初产妇=0)、糖尿病家族史(赋值:是=1,否=0)、至OGTT检测周平均增重(赋值为实测值)及孕早期FPG(赋值为实测值)和TG(赋值为实测值)后,BFM、VFA、PBF、FMI与正常BMI孕妇发生GDM的相关性仍然存在(OR=1.044,95%CI=1.012~1.078;OR=1.007,95%CI=1.002~1.012;OR=1.041,95%CI=1.012~1.070;OR=1.138,95%CI=1.043~1.241)(P<0.05),见表3。
2.3 脂肪分布对GDM发生的影响
1 938名孕前正常BMI孕妇人群中,隐性肥胖GDM发生率为13.62%(264/1 938),中心性肥胖GDM发生率为11.92%(231/1 938)。GDM组隐性肥胖及中心性肥胖所占比例均高于正常组,差异有统计学意义(P<0.05),见表4。
在正常组中,PBF、VFA均正常者588例(37.79%),PBF及VFA均异常者共735例(47.24%);在GDM组中PBF、VFA均正常者共111例(29.06%),PBF及VFA均异常者共225例(58.90%)。
以是否发生GDM为因变量(赋值:是=1,否=0),以PBF分组(赋值:≥30%=1,<30%=0)及VFA分组为自变量(赋值:≥80 cm2=1,<80 cm2=0),控制混杂因素:孕妇年龄、孕前BMI、产次、糖尿病家族史、至OGTT周平均增重及孕早期FPG和TG,进行多因素Logistic回归分析,结果显示,中心性肥胖即VFA≥80 cm2是孕前正常BMI孕妇发生GDM的独立危险因素(OR=1.396,95%CI=1.101~1.770,P<0.05),而PBF≥30%不是GDM的独立危险因素(OR=1.090,95%CI=0.826~1.439,P>0.05)。
2.4 正常BMI孕妇孕早期体成分各项指标与OGTT血糖各时点的相关性分析
Spearman秩相关分析结果显示,孕早期BFM、VFA、PBF、FMI与OGTT空腹血糖及口服葡萄糖后1、2 h血糖均呈正相关(P<0.001),见表5。
表3 正常BMI孕妇孕早期体成分与GDM相关性的二元Logistic回归分析
Table 3 Binary Logistic regression analysis of the correlation between body composition and GDM in early pregnancy
变量 B SE Wald χ2值 P值 OR(95%CI)
BFM 0.043 0.016 7.111 0.008 1.044(1.012~1.078)
VFA 0.007 0.003 7.990 0.005 1.007(1.002~1.012)
PBF 0.040 0.014 7.876 0.005 1.041(1.012~1.070)
FMI 0.129 0.044 8.417 0.004 1.138(1.043~1.241)
注:校正了年龄、孕前BMI、产次、糖尿病家族史、至OGTT检测周平均增重及孕早期FPG和TG后所得的结果。
3 讨论
本研究发现在孕前正常BMI孕妇人群中,年龄、糖尿病家族史、孕前BMI、至OGTT检测周平均增重及孕早期FBG和TG是GDM的危险因素;在孕早期体成分方面,BFM、PBF、VFA、FMI是GDM的独立危险因素;在脂肪分布方面,中心性肥胖即VFA≥80 cm2是GDM的独立危险因素。
年龄、糖尿病家族史、孕前BMI是GDM公认的重要发病危险因素[24]。近来随着我国生育政策的改变,高龄产妇有所增加,发生妊娠期合并症、并发症的可能性亦增加。GDM和T2DM病理生理学上有相似之处,有研究表明有GDM史的孕妇发生T2DM的风险是正常人的10倍[5],候选基因和全基因组关联研究已经确定了GDM和T2DM之间存在共同的易感基因[25]。妊娠期增重同样影响GDM的发病,与其他研究不同[26],本研究GDM人群至OGTT筛查时的总增重及周平均增重均低于正常人群。这可能是由于GDM组高龄孕妇比例较高且总体脂肪量较高,孕早期行饮食、运动等妊娠期宣教所致。孕早期血糖对预测GDM的发生有一定价值[27],但目前尚无统一的最佳阈值。
在体成分分析中,GDM组的BFM、VFA、PBF、FMI高于正常组女性,二元Logistic回归分析结果显示其均为GDM发生的独立危险因素(P<0.05),并且与OGTT血糖值呈正相关。2021年一项回顾性队列将早孕人群分为孕前BMI<24 kg/m2及≥24 kg/m2两组,发现当BMI<24 kg/m2时,GDM组孕妇的BFM、PBF、内脏脂肪水平(visceral fat level,VFL)与正常组比较有差异[28]。国内另有学者研究不同BMI分组下GDM低危孕妇孕早期PBF、内脏脂肪指数(visceral adiposity index,VAI)及血脂指标与GDM的关系,结果提示孕早期孕妇的PBF、VAI及TG水平均可作为GDM发生的独立预测指标[29],本研究结果与之相似。一项纳入210例孕妇的病例对照研究发现孕早期PBF≥30%是GDM的危险因素[30],但在本研究中其并非独立危险因素,这可能是因为本研究对象仅为孕前正常BMI孕妇。
本研究中总体GDM发生率为19.71%,隐性肥胖人群GDM发生率为13.62%,中心性肥胖人群GDM发生率为11.92%;在调整混杂因素后发现VFA≥80 cm2可作为GDM的独立预测指标。BFM、FMI、PBF可理解为描述总体脂肪分布的指标,VFA可理解为描述局部脂肪分布的指标。由此可见,在正常BMI人群中,总体及局部脂肪组织均与GDM相关,孕早期过量的脂肪组织及过量堆积的内脏脂肪是影响GDM重要的因素。脂肪组织可分泌多种细胞因子及炎症因子,参与调节胰岛素敏感性及免疫反应[31]。中心性肥胖的内脏脂肪组织脂解释放大量游离脂肪酸(free fat acid,FFA),这些FFA会沉积在非脂肪组织中,如肝脏、肌肉和胰腺,导致脂肪毒性[32]。FFA还可以激活组织炎症反应,引起多种炎症因子的分泌,如肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白1(MCP-1)和白介素(IL)-6[33],其脂质代谢产物也会造成胰岛素信号传导通路受损[31],最终导致胰岛素抵抗、血脂紊乱、心血管疾病的发生。这也解释了为何孕早期TG影响了GDM的发生。国外有学者对728名孕妇在妊娠第15周和第28周进行了2次体质量、皮褶厚度和体成分分析,发现GDM与体质量增加、总脂肪量增加、平均皮褶厚度增加,尤其是与躯干脂肪增加呈正相关[34]。国内一项前瞻性队列研究发现,当内脏脂肪厚度按4分位数分组,以最低分位组(≤21.70 mm)为参考组,调整混杂因素后发现最高分位组(>29.63 mm)对GDM的发病风险是参考组的3.10倍(OR=3.10,95%CI=1.10~9.50),高内脏脂肪厚度是GDM发生的独立危险因素[35]。另一些研究表明,孕早期中心性肥胖也可能预测GDM的风险[36-37],本研究结果与之相符。过量脂肪造成的不良代谢结局很大程度上取决于脂肪的位置[38],故检测体脂分布,识别特殊肥胖亚型能够帮助在早期筛查GDM高危人群。对此进行针对性管理,或许可成为治疗GDM的新方向。
因受检测方法限制,本研究无皮下脂肪组织脂肪厚度相关数据,因此不能进一步评估外周性肥胖与GDM的相关性;另BIA检测体成分存在一定误差,仅可作为初步评估指标;此外本研究因纳入孕妇多为含有高危因素孕妇,因此GDM发生率高于全国发病率。本研究仅针对孕前BMI正常孕妇,后续研究中可进一步探讨不同BMI下、不同的肥胖亚型与GDM的关系和相互作用。
4 小结
在正常BMI人群中,正常孕妇与GDM孕妇孕早期体成分指标有所差异,BFM、VFA、PBF、FMI是GDM发生的影响因素,而中心性肥胖可以独立预测GDM的发生。因此建议在孕早期进行更全面细致的肥胖评估,而不是简单的BMI评估。加强对特殊肥胖人群的妊娠期管理,通过饮食及运动指导,帮助其合理减少体脂肪,改变不良妊娠结局。
作者贡献:徐丽丽负责研究设计及实施、数据分析和整理及论文撰写;郑薇、袁仙仙提供统计学设计思路、协助编辑与修改;马恺文、张浦杨负责数据收集;李光辉负责研究设计指导及论文修改,对文章整体负责。
本文无利益冲突。
徐丽丽:https://orcid.org/0009-0007-1309-9264
李光辉:https://orcid.org/0000-0003-2290-1515
参考文献
WANG H,LI N H,CHIVESE T,et al. IDF diabetes atlas:estimation of global and regional gestational diabetes mellitus prevalence for 2021 by international association of diabetes in pregnancy study group's criteria[J]. Diabetes Res Clin Pract,2022,183:109050. DOI:10.1016/j.diabres.2021.109050.
隽娟,杨慧霞. 关注妊娠期营养及代谢疾病,铸造健康生命全周期[J]. 中华围产医学杂志,2022,25(10):729-731. DOI:10.3760/cma.j.cn113903-20221012-00888.
YE W R,LUO C,HUANG J,et al. Gestational diabetes mellitus and adverse pregnancy outcomes:systematic review and meta-analysis[J]. BMJ,2022,377:e067946. DOI:10.1136/bmj-2021-067946.
SIMMONS D,IMMANUEL J,HAGUE W M,et al. Treatment of gestational diabetes mellitus diagnosed early in pregnancy[J]. N Engl J Med,2023,388(23):2132-2144. DOI:10.1056/NEJMoa2214956.
VOUNZOULAKI E,KHUNTI K,ABNER S C,et al. Progression to type 2 diabetes in women with a known history of gestational diabetes:systematic review and meta-analysis[J]. BMJ,2020,369:m1361. DOI:10.1136/bmj.m1361.
PARIKH N I,GONZALEZ J M,ANDERSON C A M,et al. Adverse pregnancy outcomes and cardiovascular disease risk:unique opportunities for cardiovascular disease prevention in women:a scientific statement from the American heart association[J]. Circulation,2021,143(18):e902-916. DOI:10.1161/CIR.0000000000000961.
LOWE W L Jr,SCHOLTENS D M,LOWE L P,et al. Association of gestational diabetes with maternal disorders of glucose metabolism and childhood adiposity[J]. JAMA,2018,320(10):1005-1016. DOI:10.1001/jama.2018.11628.
PATRO GOLAB B,SANTOS S,VOERMAN E,et al. Influence of maternal obesity on the association between common pregnancy complications and risk of childhood obesity:an individual participant data meta-analysis[J]. Lancet Child Adolesc Health,2018,
2(11):812-821. DOI:10.1016/S2352-4642(18)30273-6.
BLOTSKY A L,RAHME E,DAHHOU M,et al. Gestational diabetes associated with incident diabetes in childhood and youth:a retrospective cohort study[J]. J De L' association Med Can,2019,191(15):E410-417. DOI:10.1503/cmaj.181001.
WANG M C,SHAH N S,PETITO L C,et al. Gestational diabetes and overweight/obesity:analysis of nulliparous women in the U.S.,2011-2019[J]. Am J Prev Med,2021,61(6):863-871. DOI:10.1016/j.amepre.2021.05.036.
KHAN S S,PETITO L C,HUANG X N,et al. Body mass index,adverse pregnancy outcomes,and cardiovascular disease risk[J]. Circ Res,2023,133(9):725-735. DOI:10.1161/CIRCRESAHA.123.322762.
TORLONI M R,BETR?N A P,HORTA B L,et al. Prepregnancy BMI and the risk of gestational diabetes:a systematic review of the literature with meta-analysis[J]. Obes Rev,2009,10(2):194-203. DOI:10.1111/j.1467-789X.2008.00541.x.
OLIVEROS E,SOMERS V K,SOCHOR O,et al. The concept of normal weight obesity[J]. Prog Cardiovasc Dis,2014,56(4):426-433. DOI:10.1016/j.pcad.2013.10.003.
ROMERO-CORRAL A,SOMERS V K,SIERRA-JOHNSON J,et al. Normal weight obesity:a risk factor for cardiometabolic dysregulation and cardiovascular mortality[J]. Eur Heart J,2010,31(6):737-746. DOI:10.1093/eurheartj/ehp487.
LU X X,WANG Q,LIANG H Y,et al. Contribution of different phenotypes of obesity to metabolic abnormalities from a cross-sectional study in the Northwest China[J]. Diabetes Metab Syndr Obes,2021,14:3111-3121. DOI:10.2147/DMSO.S314935.
DEURENBERG P,DEURENBERG-YAP M,GURICCI S. Asians are different from Caucasians and from each other in their body mass index/body fat per cent relationship[J]. Obes Rev,2002,3(3):141-146. DOI:10.1046/j.1467-789x.2002.00065.x.
BAYS H E,NG J,SICAT J,et al. Obesity Pillars roundtable:obesity and east asians[J]. Obes Pillars,2022,2:100011. DOI:10.1016/j.obpill.2022.100011.
PRILLAMAN M. Why BMI is flawed—and how to redefine obesity[J]. Nature,2023,622:232-233. DOI:10.1038/d41586-023-03143-x.
G?MEZ-AMBROSI J,SILVA C,GALOFR? J C,et al. Body mass index classification misses subjects with increased cardiometabolic risk factors related to elevated adiposity[J]. Int J Obes,2012,36(2):286-294. DOI:10.1038/ijo.2011.100.
中国肥胖问题工作组. 中国成人超重和肥胖症预防与控制指南(节录)[J]. 营养学报,2004,26(1):1-4. DOI:10.3321/j.issn:0512-7955.2004.01.001.
WANG Z M,PIERSON R N Jr,HEYMSFIELD S B. The five-level model:a new approach to organizing body-composition research[J]. Am J Clin Nutr,1992,56(1):19-28. DOI:10.1093/ajcn/56.1.19.
曲伸,陆灏,宋勇峰. 基于临床的肥胖症多学科诊疗共识(2021年版)[J]. 中华肥胖与代谢病电子杂志,2021,7(4):211-226.
中华医学会妇产科学分会产科学组,中华医学会围产医学分会,中国妇幼保健协会妊娠合并糖尿病专业委员会. 妊娠期高血糖诊治指南(2022)[第一部分][J]. 中华妇产科杂志,2022,57(1):3-12. DOI:10.3760/cma.j.cn112141-20210917-00528.
SWEETING A,WONG J,MURPHY H R,et al. A clinical update on gestational diabetes mellitus[J]. Endocr Rev,2022,43(5):763-793. DOI:10.1210/endrev/bnac003.
LOWE W L Jr. Genetics and epigenetics:implications for the life course of gestational diabetes[J]. Int J Mol Sci,2023,24(7):6047. DOI:10.3390/ijms24076047.
TEULINGS N E W D,MASCONI K L,OZANNE S E,et al. Effect of interpregnancy weight change on perinatal outcomes:systematic review and meta-analysis[J]. BMC Pregnancy Childbirth,2019,19(1):386. DOI:10.1186/s12884-019-2566-2.
王薇,黄婵,顾华妍,等. 围孕期空腹血糖对妊娠期糖尿病发生的预测作用及其与不良妊娠结局的关系[J]. 实用妇产科杂志,2023,39(2):142-146.
LI X T,XU D M,ZHANG L,et al. Correlation of body composition in early pregnancy on gestational diabetes mellitus under different body weights before pregnancy[J]. Front Endocrinol,2022,13:916883. DOI:10.3389/fendo.2022.916883.
李晓燕,张庆,张珂,等. 孕早期体脂分析对妊娠期糖尿病的预测价值研究[J]. 中国实用妇科与产科杂志,2021,37(9):964-969. DOI:10.19538/j.fk2021090119.
王燕侠,王文玲,李芳,等. 早孕期体成分与妊娠期糖尿病的关系[J]. 中华围产医学杂志,2019,22(4):261-264. DOI:10.3760/cma.j.issn.1007-9408.2019.04.010.
JIN X,QIU T T,LI L,et al. Pathophysiology of obesity and its associated diseases[J]. Acta Pharm Sin B,2023,13(6):2403-2424. DOI:10.1016/j.apsb.2023.01.012.
OH Y S,BAE G D,BAEK D J,et al. Fatty acid-induced lipotoxicity in pancreatic beta-cells during development of type 2 diabetes[J]. Front Endocrinol,2018,9:384. DOI:10.3389/fendo.2018.00384.
GLASS C K,OLEFSKY J M. Inflammation and lipid signaling in the etiology of insulin resistance[J]. Cell Metab,2012,15(5):635-645. DOI:10.1016/j.cmet.2012.04.001.
SOMMER C,M?RKRID K,JENUM A K,et al. Weight gain,total fat gain and regional fat gain during pregnancy and the association with gestational diabetes:a population-based cohort study[J]. Int J Obes,2014,38(1):76-81. DOI:10.1038/ijo.2013.185.
张振红. 孕早期内脏脂肪厚度对妊娠期糖尿病发病的预测价值研究[D]. 青岛:青岛大学,2021.
MARTIN A M,BERGER H,NISENBAUM R,et al. Abdominal visceral adiposity in the first trimester predicts glucose intolerance in later pregnancy[J]. Diabetes Care,2009,32(7):1308-1310. DOI:10.2337/dc09-0290.
BRISSON D,PERRON P,GUAY S P,et al. The “hypertriglyceridemic waist” phenotype and glucose intolerance in pregnancy[J]. CMAJ,2010,182(15):E722-725. DOI:10.1503/cmaj.100378.
DESPR?S J P,LEMIEUX I,PRUD'HOMME D. Treatment of obesity:need to focus on high risk abdominally obese patients[J]. BMJ,2001,322(7288):716-720. DOI:10.1136/bmj.322.7288.716.
(收稿日期:2024-01-13;修回日期:2024-05-10)
(本文编辑:贾萌萌)



