高帅英,杨慕坤,孙明利,白文佩*
1.100038 北京市,首都医科大学附属北京世纪坛医院妇产科
2.100038 北京市,首都医科大学附属北京世纪坛医院药物一期临床试验研究室
盆底功能障碍性疾病(pelvic floor disorders,PFD)是女性常见的慢性疾病之一,主要包括盆底支持结构退化或损伤导致的包括盆腔脏器脱垂(pelvic organ prolapse,POP)、压力性尿失禁(stress urinary incontinence,SUI)和性功能障碍等一系列疾病,与肥胖、分娩次数、年龄及盆腔手术史等因素相关[1]。SUI在我国女性中的发病率高达18.9%[2],严重影响女性的身心健康及生活质量,甚至会引发抑郁或焦虑状态[3]。研究表明,绝经后PFD患者的羞耻感总分较高,明显高于国内常模水平[4]。盆底肌肉(pelvic floor muscles,PFM)在盆腔器官的支持中起着关键作用,而雌激素对于维持女性盆底肌力起着至关重要的作用。既往研究发现,雌激素缺乏是PFD发生的危险因素之一[5]。有研究提出绝经期激素疗法(menopausal hormone therapy,MHT)可能对PFM功能起作用[6];然而,一些大型试验和系统综述表明,MHT不能缓解尿失禁,甚至会增加应激性和急迫性尿失禁的风险[6-10];并且尿失禁程度还与激素种类及给药途径相关[11]。目前有关PFD治疗和女性激素状态之间关联的文献资料较少,通过盆底三维超声评价MHT对PFM影响的研究较少。本研究旨在探索MHT联合Kegel运动对轻中度SUI患者盆底结构以及临床症状的影响,为女性健康管理提供参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准:(1)40~60岁,绝经状态,绝经时间≤5年;(2)符合SUI诊断标准[12]:在咳嗽、大笑或打喷嚏等腹压增加时出现不自主漏尿,正常情况下无漏尿;(3)经国际尿失禁咨询委员会尿失禁问卷表简表(ICI-Q-SF)[13]评分评估为轻中度SUI;(4)首次诊断绝经综合征,具有药物治疗适应证,入组前3个月无相关更年期用药史;(5)BMI≤28 kg/m2;(6)能够配合并完成所有治疗及检查;(7)对治疗内容知情了解并签署知情同意书;
1.1.2 排除标准:(1)有盆腔手术史如子宫切除术后、阴道手术或尿失禁矫正手术术后;(2)盆底器官脱垂(子宫脱垂、膀胱膨出、直肠膨出);(3)肌肉骨骼疾病或胶原蛋白紊乱;(4)合并高血压、糖尿病、便秘等慢性疾病;(5)合并心、肺、肝、肾器质性病变;(6)各种原因失访、中途退出试验等,无法进行随访;(7)合并精神、智力障碍,交流困难,无法配合检查。
1.2 一般资料
选取2022年就诊于首都医科大学附属北京世纪坛医院更年期门诊的绝经综合征伴轻中度SUI患者75例,按照随机数字表法2∶1比例分为MHT组和对照组(MHT组50例,对照组25例),MHT组再按1∶1比例随机分为替勃龙亚组和雌孕激素联合治疗(estrogen and progestogen therapy,EPT)亚组(替勃龙亚组25例,EPT亚组25例)。研究结束时,MHT组失访7例(其中替勃龙亚组失访5例,EPT亚组失访2例),对照组失访3例;最终共纳入65例。纳入基线指标包括年龄、BMI、分娩次数、分娩方式、用药前后卵泡刺激素(follicle-stimulating hormone,FSH)、雌二醇(estradiol,E2)、改良牛津肌力分级(Modified Oxford Staging,MOS)等指标。本研究经首都医科大学附属北京世纪坛医院伦理委员会批准[批准号:sjtkyll-lx-2021(101)],受试者均已签署知情同意书。
1.3 方法
对照组和MHT组均给予盆底肌训练(pelvic floor muscle training,PFMT)治疗,又称Kegel运动[14]:所有入组患者在门诊进行宣教指导,Kegel运动进行15~30 min/次,2~3次/d,2~3 d/周,连续12个月,每个月进行电话随访监督。
1.3.1 对照组:在PFMT基础上,口服坤泰胶囊(贵阳新天药业股份有限公司生产,国药准字Z20000083,规格:每粒装0.5 g)4粒口服,3次/d,持续治疗12个月。
1.3.2 MHT组:在PFMT基础上,同时给予MHT:EPT包括雌孕激素连续联合、雌孕激素连续序贯疗法,雌孕激素连续联合:给予口服戊酸雌二醇片1 mg(补佳乐,拜耳医药保健有限公司广州分公司生产,批准文号:国药准字J20171038)+地屈孕酮片10 mg(荷兰Abbott Biologicals B.V.生产,注册证号H20130110),1次/d,连续服用不间断。雌孕激素连续序贯疗法:芬吗通(荷兰Abbott Biologicals B.V.生产,注册证号H20150346)12个疗程,口服,1片/d,每28 d为1个疗程。前14 d,口服,1片/d白色片,内含E2 1 mg;后14 d,口服,1片/d灰色片,内含E2 1 mg和地屈孕酮10 mg。替勃龙(华润紫竹药业有限公司,国药准字H20020198,规格2.5 mg/片)口服,2.5 mg/次,1次/d,连续用药12个月。
1.4 检查器械及检查方法
采用美国GE VolusonE8彩色多普勒超声诊断仪进行盆底三维超声检查,在患者进行治疗前1个月、治疗结束1个月复查盆底三维超声;检查流程、所测指标参考值参考2022版《盆底超声检查中国专家共识》[15]。研究检查取双盲法,检查操作人员均有5年以上专科工作经验,且对受检者身体状况及其他检查结果均不知情。检查项目包括尿道旋转角(urethral rotation angel,URA)、逼尿肌厚度(bladder detrusor thickness,BDT)、膀胱尿道后角(posterior vesicourethral angle,PVUA)、肛提肌裂孔面积(levator hiatus area,LHA)。检查前和患者进行充分沟通,向患者解释盆底肌收缩动作及Valsalva动作的要领,以达到诊断目的。盆底肌收缩动作即肛门收缩上提的动作,以盆腔脏器向头腹侧移动或肛提肌裂孔缩小,且持续时间>3 s视为有效的盆底肌收缩动作。Valsalva动作即深吸气后屏气向下用力增加腹压的动作,以盆腔脏器向背尾侧移动或肛提肌裂孔增大,且持续时间≥6 s视为有效Valsalva动作。嘱患者排空膀胱,取膀胱截石位,将探头消毒、涂抹耦合剂后,套无菌探头套,置于会阴部正中矢状切位,以耻骨联合后下缘为标志点,探查受检者尿道、阴道、膀胱颈、子宫颈、肛提肌等多个部位,取静息状态和Valsalva状态的超声图像,记录测量超声参数并分析检测结果。
1.5 观察指标
1.5.1 URA:静息状态下尿道倾斜角与Valsalval动作时的尿道倾斜角的差值,正常<45°,如果增大提示与尿失禁相关;BDT:正常<5 mm,如果增大则可能与逼尿肌过度活动有关;PVUA:正常90°~120°,如果>140°提示膀胱颈(尿道内口)有开放;LHA:正常情况下,最大Valsalva状态下面积≤20 cm2,若裂孔面积≥35 cm2则与中重度脱垂密切相关,并可有脱垂相关的临床症状。
1.5.2 采用改良Kupperman绝经指数评分(KMI)评估患者治疗前及治疗12个月后更年期症状。KMI包括感觉异常、潮热出汗、焦躁、失眠忧郁、头晕、疲倦、头痛、肌肉骨痛、皮肤蚁走感、心悸症状,各项评分相加即为总分,其中症状越严重则得分越高,15~20分为轻度,21~35分为中度,>35分为重度。参照中华医学会泌尿外科分会控尿学组对女性SUI的相关疗效判断标准,治疗前后1个月内患者尿失禁症状和尿垫试验后尿失禁量[12],将临床疗效分为治愈、有效及无效。治愈:患者自觉尿失禁症状基本消失,1 h尿垫试验显示为阴性;有效:患者自觉尿失禁次数症状和治疗前相比明显减少,1 h尿垫试验连续超过3次均显示为阴性;无效:患者尿失禁症状和治疗前相比,没有任何改善,1 h尿垫试验阳性。
1.5.3 SUI评分:采用ICI-Q-SF评分[16],患者根据自身情况回答问卷内容,包括漏尿次数、漏尿量、漏尿对生活的影响及发生漏尿的时间等问题,总分21分,分值越高表明尿失禁症状越严重,其中尿失禁轻度0~7分、中度8~14分及重度15~21分。
1.5.4 治疗前后1 d内血清E2和FSH含量:两组患者于治疗前及结束治疗后1 d内分别取5 mL静脉血,离心处理,取上清液,通过电化学发光法检测E2、FSH水平。
1.5.5 MOS:0级为检查者感觉不到肌肉收缩;1级可感觉到肌肉颤动,但非常弱;2级肌肉张力增加但感觉不到抬举或挤压感;3级可感觉到挤压感;4级收缩良好,可以对抗阻力产生阴道后壁抬高;5级为强有力收缩,可以对抗强大的阻力产生阴道后壁抬高。其中0~2级定为肌力严重损伤[17]。
1.6 统计学方法
采用SPSS 25.0软件进行统计分析,符合正态分布的计量资料采用(±s)表示,两组间比较采用独立样本t检验,治疗前后比较采用配对t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验,治疗前后比较采用配对秩和检验;计数资料采用例(%)表示,组间比较采用χ2检验或Fisher's确切概率法;等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较
65例患者年龄40~60岁,平均年龄(50.1±5.0)岁;其中MHT组共43例,年龄40~60岁,平均年龄(49.8±5.5)岁。对照组22例,年龄42~59岁,平均年龄(50.8±3.6)岁。对照组和MHT组患者年龄、BMI、产次、分娩方式、治疗前和治疗后FSH、E2、MOS分级比较,差异均无统计学意义(P>0.05),见表1。

表1 对照组和MHT组一般资料比较Table 1 Comparison of baseline data between control group and MHT group
2.2 盆底结构超声数据比较
治疗前,MHT组和对照组PUVA、BDT、URA、LHA比较,差异均无统计学意义(P>0.05);治疗1年后,MHT组和对照组PUVA、BDT、URA比较,差异均无统计学意义(P>0.05);MHT组LHA低于对照组,差异有统计学意义(P=0.028)。对照组和MHT组同组治疗前后PUVA、BDT、URA、LHA比较,差异均无统计学意义(P>0.05),见表2。
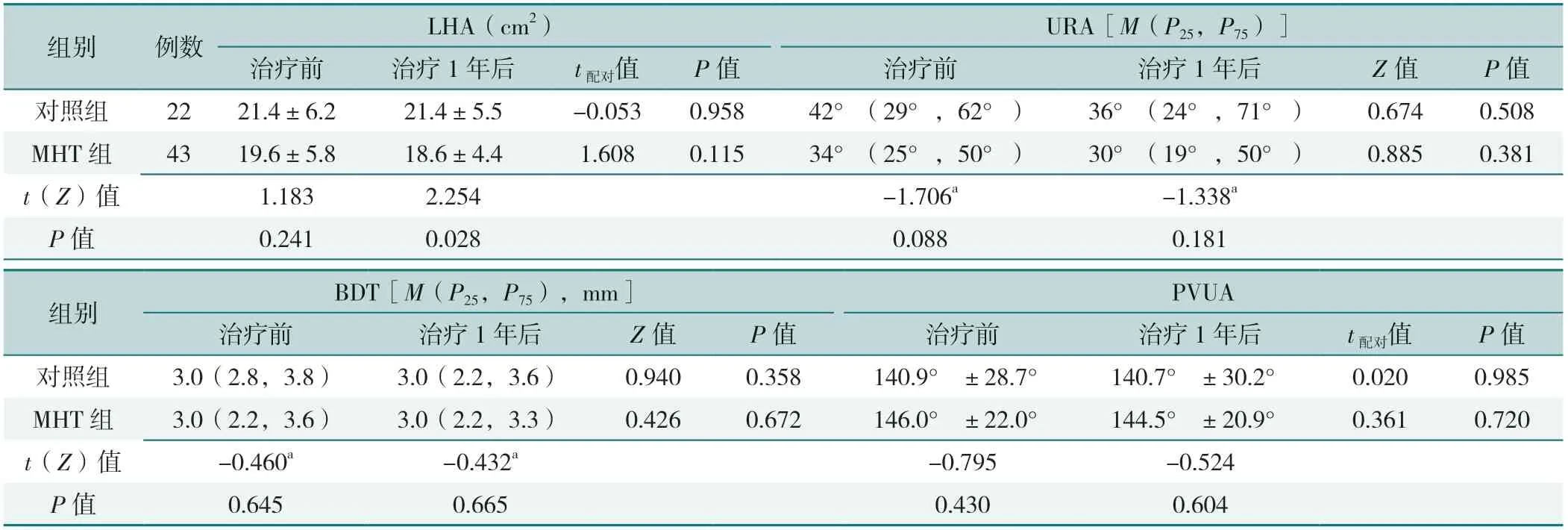
表2 MHT组和对照组治疗前后盆底结构超声指标比较Table 2 Comparison of pelvic floor ultrasonography before and after treatment between MHT group and control group
治疗前,EPT亚组和替勃龙亚组PUVA、BDT、URA、LHA比较,差异均无统计学意义(P>0.05);治疗1年后,EPT亚组和替勃龙亚组PUVA、BDT、URA、LHA比较,差异均无统计学意义(P>0.05)。EPT亚组治疗后LHA低于治疗前,差异有统计学意义(P=0.025);其余指标两亚组同组治疗前后比较,差异均无统计学意义(P>0.05),见表3。
表3 EPT亚组和替勃龙亚组治疗前后盆底结构超声指标比较(±s)Table 3 Comparison of pelvic floor structure ultrasound before and after treatment between EPT subgroup and Tibolone subgroup
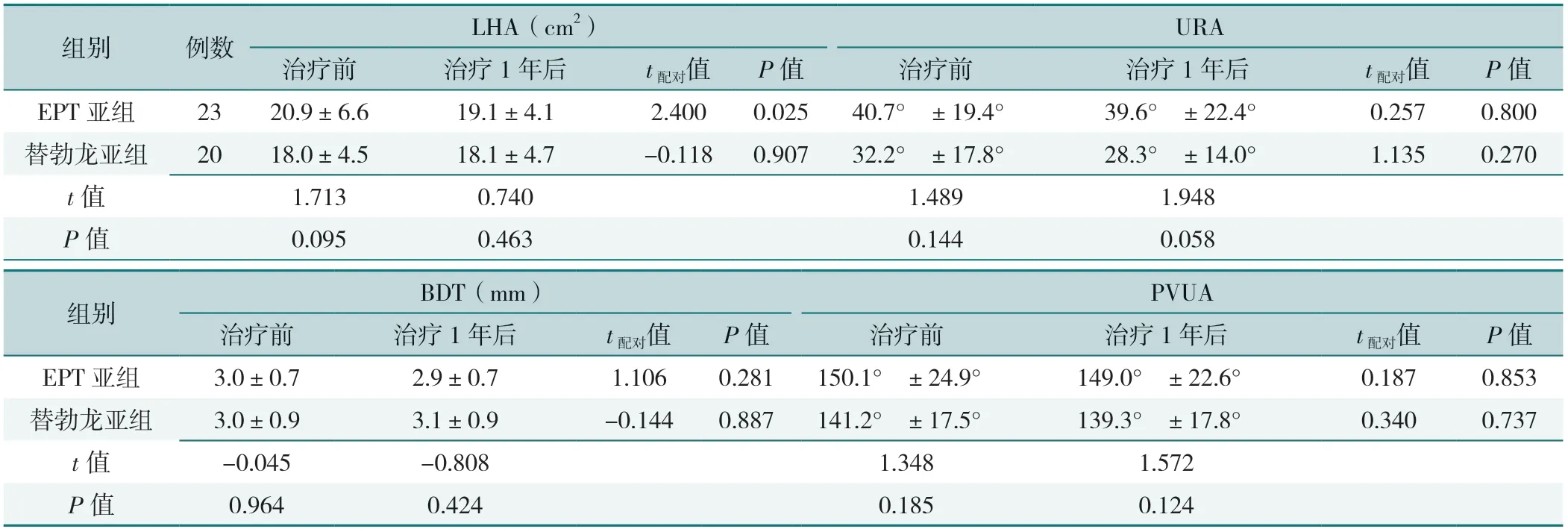
表3 EPT亚组和替勃龙亚组治疗前后盆底结构超声指标比较(±s)Table 3 Comparison of pelvic floor structure ultrasound before and after treatment between EPT subgroup and Tibolone subgroup
注:EPT=雌孕激素联合治疗。
组别例数LHA(cm2)URA治疗前治疗1年后t配对值P值治疗前治疗1年后t配对值P值EPT亚组2320.9±6.619.1±4.12.4000.02540.7°±19.4°39.6°±22.4°0.2570.800替勃龙亚组2018.0±4.518.1±4.7-0.1180.90732.2°±17.8°28.3°±14.0°1.1350.270 t值1.7130.7401.4891.948 P值0.0950.4630.1440.058组别BDT(mm)PVUA治疗前治疗1年后t配对值P值治疗前治疗1年后t配对值P值EPT亚组3.0±0.72.9±0.71.1060.281150.1°±24.9°149.0°±22.6°0.1870.853替勃龙亚组3.0±0.93.1±0.9-0.1440.887141.2°±17.5°139.3°±17.8°0.3400.737 t值-0.045-0.8081.3481.572 P值0.9640.4240.1850.124
2.3 临床疗效比较
对照组和MHT组临床疗效比较,差异有统计学意义(Z=-2.793,P=0.005),见表4;EPT亚组和替勃龙亚组临床疗效比较,差异无统计学意义(Z=-0.349,P=0.727),见表5。

表4 MHT与对照组临床疗效比较[例(%)]Table 4 Comparison of clinical efficacy between MHT group and control group

表5 EPT亚组和替勃龙亚组临床疗效比较[例(%)]Table 5 Comparison of clinical efficacy between EPT subgroup and Tibolone subgroup
2.4 尿失禁量、尿失禁评分、KMI评分比较
治疗前,对照组和MHT组尿失禁量、ICI-Q-SF评分、KMI评分比较,差异均无统计学意义(P>0.05);治疗后,MHT组尿失禁量、ICI-Q-SF评分、KMI评分低于对照组,差异均有统计学意义(P<0.05),见表6。
表6 MHT与对照组治疗前后尿失禁量、ICI-Q-SF评分、KMI评分比较(±s)Table 6 Comparison of urinary incontinence volume,ICI-Q-SF score and KMI score between MHT and control group before and after treatment
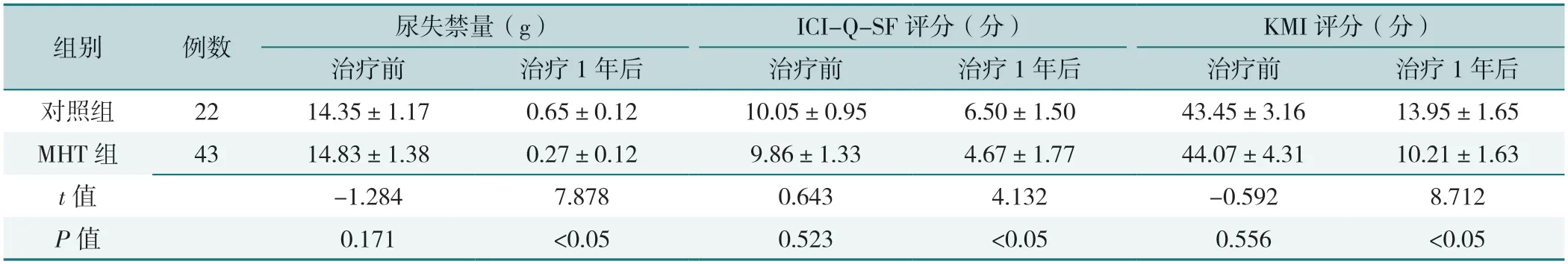
表6 MHT与对照组治疗前后尿失禁量、ICI-Q-SF评分、KMI评分比较(±s)Table 6 Comparison of urinary incontinence volume,ICI-Q-SF score and KMI score between MHT and control group before and after treatment
注:ICI-Q-SF=国际尿失禁咨询委员会尿失禁问卷表简表,KMI=改良Kupperman绝经指数。
组别例数尿失禁量(g)ICI-Q-SF评分(分)KMI评分(分)治疗前治疗1年后治疗前治疗1年后治疗前治疗1年后对照组2214.35±1.170.65±0.1210.05±0.956.50±1.5043.45±3.1613.95±1.65 MHT组4314.83±1.380.27±0.129.86±1.334.67±1.7744.07±4.3110.21±1.63 t值-1.2847.8780.6434.132-0.5928.712 P值0.171<0.050.523<0.050.556<0.05
治疗前和治疗后,EPT亚组和替勃龙亚组尿失禁量、ICI-Q-SF评分、KMI评分比较,差异均无统计学意义(P>0.05),见表7。
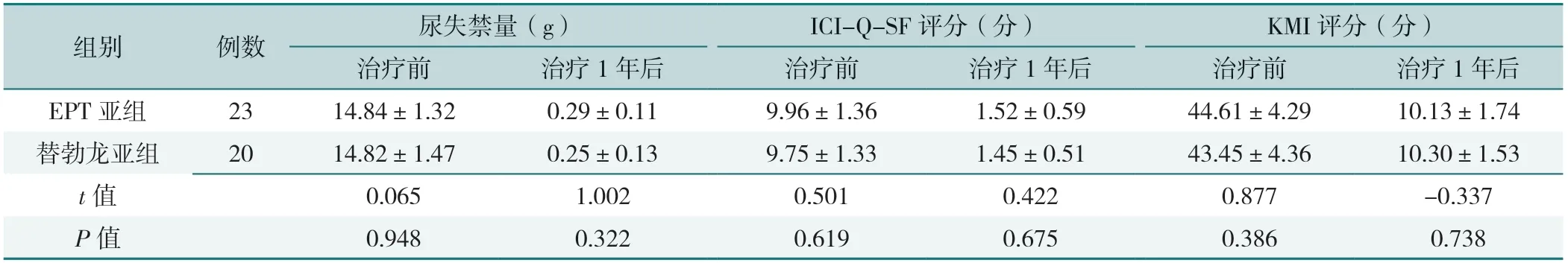
表7 EPT亚组和替勃龙亚组治疗前后尿失禁量、ICI-Q-SF评分、KMI评分比较(x-±s)Table 7 Urinary incontinence volume,ICI-Q-SF score and KMI score of EPT subgroup and Tibolone subgroup before and after treatment
3 讨论
SUI的主要治疗方式包括手术治疗及非手术治疗。在非手术治疗中,PFMT备受关注。既往研究发现,PFMT可以增加PFM的强度、降低尿失禁的患病率和严重程度[18-19]。本研究是一个较长时间的药物加行为干预的前瞻性研究,结果发现进行PFMT的患者尿失禁症状较前明显好转,与KUCUKKAYA等[20]的一项包含64例SUI女性患者的研究结果一致。欧洲泌尿外科协会(European Association of Urology,EAU)和国际尿失禁咨询委员会(International Consultations on Incontinence,ICI)已将PFMT作为尿失禁保守治疗的一线推荐[21]。在最近的一项综述中提出一种新型的监督PFM康复计划(包括移动应用程序、基于Web的程序、阴道设备)要比传统的PFMT有效[22]。
既往研究表明,未接受MHT的女性发生SUI可能与内源性的雌激素下降有关[23],较低的雌激素水平可能是女性发生SUI的危险因素[24]。雌激素是血管活性激素,可以增加血流量[25],亦能影响中枢神经系统的排尿机制[26]。女性的下尿路和生殖道存在E2受体,绝经期体内雌激素产生不足且阴道壁E2受体表达下降[27],导致绝经期女性容易出现尿失禁症状。因此,对于绝经期患者来说,MHT可能有利于改善尿失禁症状。雌激素可通过多种机制改善SUI,在最近的一项动物实验中发现,适量的雌激素可通过重构细胞外基质缓解SUI的症状[28];亦有研究表明,单纯雌激素或者EPT可以通过增加尿道周围血管数量来减轻SUI[29]。本研究发现,MHT组患者在治疗后SUI症状明显好转,并且相比于对照组,治疗后的尿失禁量、ICI-Q-SF评分、KMI评分均有差异,提示激素治疗可以改善SUI患者的症状。
相比于常规超声,经会阴三维超声有更好的成像模式,在评估盆底解剖结构时具有更高的时间和空间分辨率[30],也能近距离、多切面分析盆腔内部各脏器状态,因此,经会阴三维超声已逐渐成为子宫脱垂的临床常规诊断方法[31],并且盆底超声技术可作为早期SUI的可靠诊断依据[32]。一项包含226名绝经后女性关于PFM三维超声特征的研究发现,使用MHT的绝经后女性具有更大的肛提肌厚度及PFM强度[33]。本研究旨在通过盆底三维超声评估MHT治疗联合Kegel运动是否会引起盆底结构的明显变化,共纳入65例患者,对照组和MHT组患者治疗前后自身盆底结构对比,LHA、PUVA、BDT、URA均较治疗前减小,说明两组患者盆底结构在治疗后均得到改善,但是治疗前后无统计学差异;同样,在对照组和MHT组的组间比较中,治疗前两组LHA、PUVA、BDT、URA无差异,但是两组治疗后LHA面积有差异,可以看出,MHT治疗联合Kegel运动可以通过减小LHA、PUVA、BDT、URA,从而改善SUI患者的症状;两组PUVA、BDT、URA减小程度并没有存在统计学意义,但是两组LHA减小程度存在统计学差异,提示MHT治疗可能更大程度上影响LHA的变化。
肛提肌是盆底重要的肌肉之一,在刺激之下,肛提肌裂孔缩小,进而对抗腹压,在维持盆底器官位置方面具有重要作用,同时在尿失禁发生机制中起重要作用[34],当肛提肌受损时则不能为盆腔器官提供足够的支持力,引起器官脱垂,三维超声可以观察肛提肌裂孔形态,为PFD提供辅助诊断依据。DIETZ等[35]研究发现,肛提肌越完整,尿道闭合压力越高,并且与盆底功能相关疾病存在明显关系。徐娆等[36]研究发现在SUI患者中,肛提肌裂孔面积高于正常人,并且肛提肌的前后径及面积是预测PFD的有效方法[37]。LHA大小是影响后盆腔功能障碍的重要因素之一,最大Valsalva动作后肛提肌裂孔面积若>25 cm2,则提示有肛提肌损伤的可能;其面积大小也反映了肛提肌的收缩功能。本研究发现,MHT治疗后,患者SUI症状明显减轻,并且LHA也有相应程度的减小,患者功能上的变化也可以通过盆底结构的改变来体现,但是结构的变化相对于功能改变是相对滞后的,未来通过长时间的激素治疗,盆底结构的变化可能会比较明显。因此可以通过三维超声观察盆底精细结构,从而评估MHT联合Kegel运动治疗SUI患者的疗效。本研究也对EPT亚组和替勃龙亚组进行了分析对比,两亚组之间对于改善LHA并无显着差异;然而,在两亚组自身前后对比中,EPT亚组LHA的变化有差异,表明雌孕激素连续序贯治疗对改善LHA可能有一定效果。
本研究具有一定的局限性:(1)本研究所有患者已生育,由于未生育女性数据相对较少,所以未进行比较;(2)本研究样本量相对较小,会对结果产生一定的偏倚,并且未对患者BMI、年龄、孕产次进行分层,后续将继续纳入更多的样本进行深入研究。
综上所述,MHT联合Kegel运动能够改善SUI患者的盆底结构,并且明显缓解轻中度SUI患者的临床症状。临床可以通过盆底三维超声评估其治疗效果,有助于更好地个体化用药。
作者贡献:高帅英提出研究思路,设计研究方案,处理数据,绘制图表,撰写文章初稿;杨慕坤负责调研研究的可行性,研究对象的选取、数据采集;孙明利负责论文修订;白文佩负责最终版本修订,对论文负责。
本文无利益冲突。



