郑建铭 张永信
(复旦大学附属华山医院感染病科 上海 200040)
全球及我国的多中心临床试验结果均显示,替比夫定(telbivudine, LDT)的抗病毒活性和耐药发生率均优于拉米夫定[1-3]。我们在临床中观察到,LDT在治疗慢性乙型肝炎(chronic hepatitis B, CHB)时易引起患者的血肌酸激酶(creatine kinase, CK)水平升高。为此,我们通过回顾性研究和文献分析,探讨CK水平升高时的处理方法,以期为临床安全用药提供参考。
1 资料与方法
1.1 研究对象
通过查阅病例,选取2009年9月-2011年8月在我院门诊就诊的乙型肝炎e抗原(hepatitis B e antigen,HBeAg)阳性CHB患者24例,其中男19例、女5例,平均年龄为32岁(19~57岁)。诊断标准参照《慢性乙型肝炎防治指南(2010年版)》[4],但排除合并丙型肝炎病毒、丁型肝炎病毒、人类获得性免疫缺陷病毒等病毒感染和自身免疫性肝炎或其他活动性肝病患者;排除有严重活动性疾病(心、脑、肾病和糖尿病、神经精神疾病等)患者;排除酗酒、吸毒、怀孕和药物滥用患者。使用过核苷(酸)类似物或12个月内使用过干扰素等免疫调节剂、细胞毒药物或免疫抑制剂者不纳入研究;已纳入研究的患者除因病毒学突破加用阿德福韦酯(adefovir dipivoxil, ADV)外,如合并使用其它药物的也不纳入统计。
1.2 治疗方法
患者口服LDT 600 mg、1次/d治疗,且未因CK水平升高而停用药物。如果出现病毒学突破,则按《慢性乙型肝炎防治指南(2010年版)》要求检查依从性并复查乙型肝炎病毒(hepatitis B virus, HBV)DNA水平,确认存在病毒学突破后可加用ADV 10 mg、1次/d治疗。对患者每3个月随访1次,复查HBV DNA和CK水平以及肝、肾功能。
1.3 CK水平升高的定义
目前尚无统一的药物相关CK水平升高分级标准,但有些临床试验将LDT相关CK水平升高分为4个级别:1级为(3~5)×正常值上限(upper limit of normal, ULN),2级为(5~7)×ULN,3级为(7~10)×ULN,4级为≥10×ULN[1]。在本研究中,我们将CK水平升高>2×ULN定义为CK水平升高。但因CK水平受多种因素影响,故在对结果分析时仍将按上述临床试验的CK水平升高分级标准进行汇总和分析。对CK水平升高患者,要求其休息、避免剧烈运动,1~2周内予于复查;如此时已无明显升高,则延长随访CK水平的时间。
1.4 统计学处理
使用Stata统计软件7.0版本进行分析。检验结果以(均数±标准差)(±s)表示,组间比较用配对t检验,P<0.05表示差异有统计学意义。
2 结果
24例患者使用LDT 600 mg/d治疗前以及治疗3、6、9和12个月后的血清谷丙转氨酶(alanine aminotransferase, ALT)、血肌酐(serum creatinine, SCr)、CK、乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、HBeAg和HBV DNA水平的化验结果如表1所示。
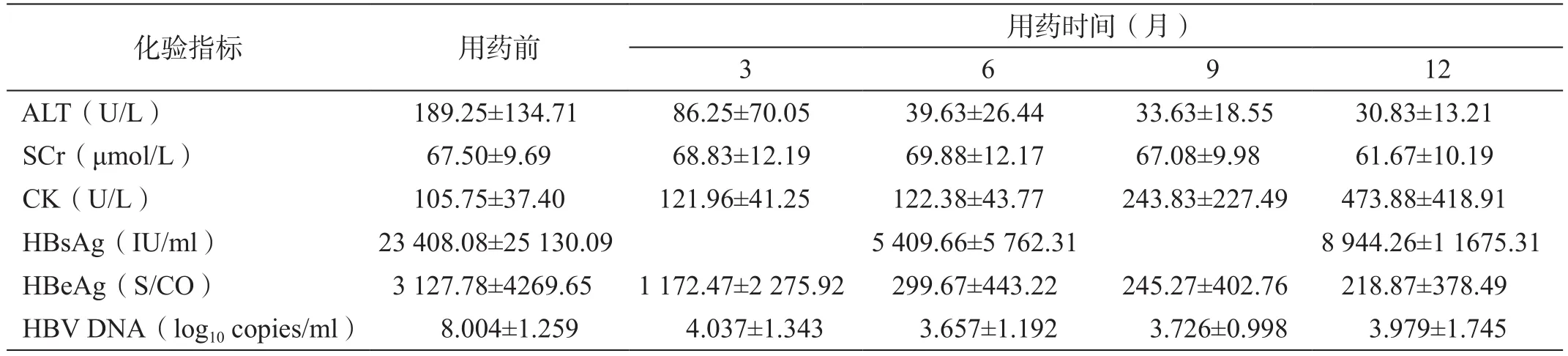
表1 24例HBeAg阳性CHB患者使用LDT治疗前后的化验指标随访结果(x ±s)
LDT治疗后血清ALT水平逐渐下降,在治疗3、6、9和12个月后的值均较治疗前有统计学差异(P分别=0.005 2、<0.000 1、<0.000 1和<0.000 1)。ALT水平在治疗6、9和12个月后均较治疗3个月时有统计学差异(P分别=0.008 7、=0.003 5和=0.002 6);在治疗9和12个月后均较治疗6个月时有统计学差异(P分别=0.049 4和=0.049 4);但在治疗12个月后较治疗9个月时无统计学差异(P=0.264 7)。治疗3、6、9和12个月后的ALT水平复常率分别为41.67%、75%、79.17%和91.67%。SCr水平均在正常范围,最小值为43 μmol/L、最大值为 90 μmol/L。
LDT治疗后CK水平逐渐升高,但在治疗3和6个月后的值均较治疗前无统计学差异(P分别=0.077 3和=0.108 5);在治疗9和12个月后均较治疗前有统计学差异(P分别=0.005 3和=0.000 3)。CK水平在治疗9个月后较治疗6个月时有统计学差异(P=0.006 9);在治疗12个月后较治疗9个月时有统计学差异(P=0.021 9)。治疗前以及治疗3、6、9和12个月后的CK水平异常率分别为8.33%、12.50%、16.67%、45.83%和79.17%。CK水平最高值为2 007 U/L,其中2例患者的CK水平最高值出现在治疗9个月后,但在治疗12个月后较前有所下降;17例患者的CK水平最高值出现在治疗12个月后,占70.83%。CK水平升高达到3~4级的共有2例,治疗9和12个月后各有1例,均占4.17%;CK水平升高>5×ULN的有3例,多有劳累或剧烈运动的病史,有乏力感、无肌痛,肌力在4~5级,休息后复查CK水平有所下降。在不同随访时间,患者CK水平升高分级情况如表2所示。
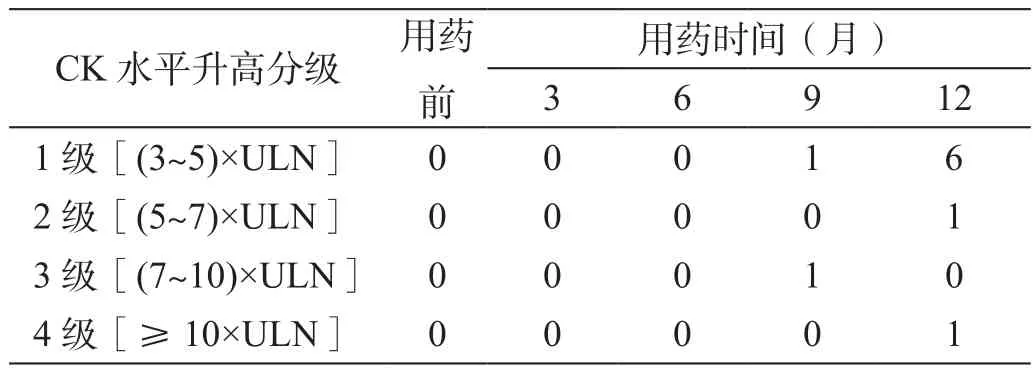
表2 在不同随访时间CK升高水平分级的例数(n)
LDT治疗后血清HBsAg水平较治疗前下降,在治疗6和12个月后均较治疗前有统计学差异(P分别=0.002 4和=0.004 0)。但HBsAg水平在治疗12个月后较治疗6个月时无统计学差异(P=0.128 8)。治疗6和12个月后的HBsAg转阴率均为4.17%。
LDT治疗后血清HBeAg水平逐渐下降,在治疗3、6、9和12个月后均较治疗前有统计学差异(P分别=0.003 5、=0.001 9、=0.002 1和=0.003 3)。HBeAg水平在治疗9和12个月后均较治疗3个月时有统计学差异(P分别=0.029 4和=0.0313),但在治疗9和12个月后均较治疗6个月时无统计学差异,在治疗12个月后较治疗9个月时也无统计学差异。治疗3、6、9和12个月后的HBeAg转阴率分别为0、8.33%、12.5%和16.67%。
LDT治疗后血清HBV DNA水平逐渐下降,在治疗3、6、9和12个月后均较治疗前有统计学差异(P分别<0.000 1、<0.000 1、<0.000 1和<0.000 1)。HBV DNA水平在治疗6、9和12个月后均较治疗3个月时有统计学差异(P分别=0.001 2、=0.001 5和=0.039 6);但在治疗9和12个月后均较治疗6个月时无统计学差异,治疗12个月后较治疗9个月时也无统计学差异。治疗3、6、9和12个月后的HBV DNA转阴率(定义为<1 000 copies/ml)分别为25%、58.33%、75%和66.67%。有12.5%的患者在治疗12个月后出现病毒学突破,经复查确认后加用ADV治疗。
3 讨论
CK水平受多种因素的影响,故在药物的临床研究中其轻度升高(1~2级,即<7×ULN)的原因常不明确且无临床意义。在LDT的临床研究中,CK水平升高至3~4级才被定义为应予关注的临床不良事件[1]。我们的研究发现,虽然LDT治疗1年使得79.17%患者的CK水平升高,但升高至3~4级程度的患者比例只有4.17%,与谢蓉等[5]报道的LDT治疗56周有3.7%的患者出现3~4级的CK水平升高结果相似。LDT治疗致CK水平升高是常见现象,但没有患者因CK水平升高而停用药物。本研究中CK水平升高至>5×ULN者有3例,多有劳累或剧烈运动的病史,有乏力感、无肌痛,肌力在4~5级左右,休息后复查CK水平有所下降。这一现象提示,在LDT治疗期间,劳累或剧烈运动会导致CK水平显着升高。
本研究未发现CK水平升高会影响SCr水平,也未发现有刘春玉等[6]报道的LDT治疗引起横纹肌溶解症的少见严重不良反应。
不过,由于本研究纳入的样本数较少、1年的随访时间又较短,故对患者CK水平长期维持在升高状态下的远期不良后果还不清楚。高蕾等[7]报道,使用LDT治疗平均(10.9±5.2)个月后测得CK水平升高,但换用ADV或恩替卡韦继续治疗平均(3.9±3.1)个月后,CK水平可降至正常水平。换言之,如在使用LDT治疗期间出现肌炎或肌病等并发症时,换用ADV或恩替卡韦可能是合理的治疗选择。还有研究报道,在LDT治疗引起CK水平重度升高时,改用拉米夫定联合ADV治疗24周后CK水平会降至正常[8]。LDT治疗期间应加强对CK水平的监测,一旦确定肌病和LDT有关即应立即停药,必要时可用辅酶Q10治疗[9-10]。
总之,LDT治疗引起CK水平升高较常见,但发生严重不良事件的较少见,远期不良后果也有待进一步研究的揭示。LDT治疗的安全性尚好,需密切随访及监测患者的临床症状、CK水平、肾功能和肌红蛋白水平等。
[1]Liaw YF, Gane E, Leung N,et al. 2-year GLOBE trial results:telbivudine is superior to lamivudine in patients with chronic hepatitis B [J]. Gastroenterology, 2009, 136(2): 486-495.
[2]Lai CL, Gane E, Liaw YF,et al. Telbivudine versus lamivudine in patients with chronic hepatitis B [J]. N Engl J Med, 2007, 357(25): 2576-2588.
[3]Hou J, Yin YK, Xu D,et al. Telbivudine versus lamivudine in Chinese patients with chronic hepatitis B: results at 1 year of a randomized, double-blind trial [J]. Hepatology, 2008, 47(2):447-454.
[4]中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 中华肝脏病杂志,2011, 19(1): 13-24.
[5]谢蓉, 林丹, 李楠. 替比夫定所致肌酸激酶升高及肌病的临床观察[J]. 中西医结合肝病杂志, 2011, 21(2): 86-87.
[6]刘春玉, 谢志毅, 秦龙. 替比夫定少见不良反应:横纹肌溶解症[J]. 药物不良反应杂志, 2009, 11(3): 201-203.
[7]高蕾, 孙诚, 汪文洋, 等. 替比夫定治疗时血肌酸激酶升高现象的分析和处理[J]. 中国生化药物杂志, 2011, 32(2):147-149.
[8]周岳进. 核苷(酸)类似物治疗慢性乙型肝炎致血清肌酸激酶升高的临床观察与处理[J]. 实用肝脏病杂志, 2009,12(6): 418-419.
[9]蔡晧东. 替比夫定相关性肌酸激酶升高与肌病及其安全应用[J]. 药物不良反应杂志, 2009, 11(4): 253-256.
[10]Rosenfeldt FL, Mijch A, McCrystal G,et al. Skeletal myopathy associated with nucleoside reverse transcriptase inhibitor therapy: potential bene fi t of coenzyme Q10therapy[J]. Int J STD AIDS, 2005, 16(12): 827-829.



