摘 要 目的:分析GSP在药品批发企业不合格药品管理中的作用。方法:从不合格药品的界定入手,结合GSP及自身管理实践,阐述如何规范不合格药品管理,并论述规范不合格药品管理与企业经营效率和经济效益的关系。结果:GSP不仅能规范不合格药品的管理,还能提升企业经营效率和经济效益。结论:合理应用GSP及其内嵌的质量管理理论及方法,不仅使企业经营风险降低,还能实现企业在新《药品管理法》监管下的社会责任与担当。
关键词 药品经营质量管理规范 药品批发企业 不合格药品 药品管理法
中图分类号:R954 文献标志码:C 文章编号:1006-1533(2020)19-0065-05
The role of GSP in the management of unqualified medicine in pharmaceutical wholesale enterprises
ZHOU Biwen*
(Sinopharm Group Co., Ltd., Shanghai 200051, China)
ABSTRACT Objective: To Analyze the role of GSP in the management of unqualified drugs in pharmaceutical wholesale enterprises. Methods: Starting with the definition of unqualified drugs and combining with GSP and own management practice, this article expounds how to regulate the management of unqualified drugs and discusses the relationship between the standardization of the management of unqualified drugs and the business efficiency and economic benefits of enterprises. Results: GSP can not only standardize the management of unqualified drugs, but also improve the business efficiency and economic benefits of enterprises. Conclusion: The rational application of GSP and its embedded quality management theories and methods will not only reduce the business risks of enterprises but also realize the social responsibility of enterprises under the supervision of the new Drug Administration Law.
KEY WORDS GSP; pharmaceutical wholesale enterprises; unqualified drugs; drug administration law
新的《药品管理法》已于2019年12月1日起施行,其取消了经营质量管理认证的规定,但将符合《药品经营质量管理规范》(GSP)作为药品经营企业开办的基本条件,故对执行GSP的要求并没有放松。与此同时,为保证药品质量安全,新的《药品管理法》对经营假、劣药等违法行为设置了最严厉的处罚。不合格药品关系到药品的质量,笔者从不合格药品的界定入手,分析其产生环节、情形及法规风险,结合GSP条款及自身管理实践,阐述如何规范不合格药品管理,并论述规范不合格药品管理与企业经营效率和经济效益的关系,以论证GSP在药品批发企业不合格药品管理中的作用。
1 不合格药品的界定
不合格药品是指药品的包装不合格或外观质量不合格或内在质量不合格[1]。
2 不合格药品产生的环节、情形及法规风险分析
依据GSP可知,药品批发企业经营活动先后经历采购→收货与验收→储存与养护→销售→出库复核→运输→售后服务这7个环节,这些环节均可能产生不合格药品。依据不合格药品的界定,对各环节不合格药品的常见情形进行分析,并对照新的《药品管理法》中的假、劣药情形对其经营风险进行预判(表1)。
由表1可知,在新的《药品管理法》实施后,药品批发企业产生的不合格药品如因管理不当流入消费市场,则可能因销售假、劣药而面临“双罚”,即对涉事企业及个人同步追究刑法责任、行政责任和民事责任[2]。
3 GSP对药品批发企业不合格药品管理的要求
GSP中关于不合格药品管理的相关条款及内容见表2。
由表2可知,GSP分别从人员职责、文件、场所、现场管理、计算机系统及售后管理等环节提出了具体要求,充分体现了全面质量管理5要素——人、机、料、法、环[3]对不合格药品管理的影响。
4 GSP在规范药品批发企业不合格药品管理中的应用
以全面质量管理5要素为指引,对上述GSP条款进行分解,阐述如何规范不合格药品管理(表3)。
5 GSP在推动药品批发企业规范不合格药品管理中的应用
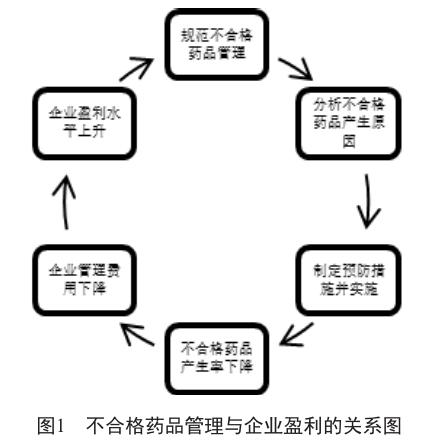
依据条款08706,GSP要求企业对不合格药品应当查明并分析原因,及时采取预防措施,其目的是降低不合格药品的发生率,保证药品经营质量。而不合格药品发生率的下降,能使企业承担的管理费用降低,从而间接地增加企业利润。因此,规范不合格药品管理和提升企业利润之间是一种循环且相互促进的关系(图1)。而这种关系可成为推动药品批发企业积极、主动规范不合格药品管理的内在动力。
药品收货与验收属于仓储入库作业环节。入库作业是仓储作业管理的第一步,直接关系到后续在库、出库作业能否顺畅与方便[4]。因此,该环节产生的不合格品,如果未及时发现,或者发现后不加以杜绝,将直接影响入库效率,增加企业的物质损耗和劳动消耗,同时影响商品周转和流通的效率[5]。
笔者运用全面质量管理5要素对该环节常见的不合格药品情形——被污染的药品进行原因分析并拟定整改措施,并对改进效果进行预期评估(表4)。
为保证改进效果达到预期目标,可运用全面质量管理的工作方法——PDCA循环,即先拟定可量化的改进指标及目标值,并制定相应的整改措施(P),落实整改措施并跟踪执行情况(D),依据改进指标对整改效果进行评价(C),如未达到预期改进目标,则可以进一步分析原因并制定新的整改措施(A→P),直至实现预期改进目标[6]。

6 结语
药品质量安全是新《药品管理法》监管的底线。药品经营企业如能充分理解GSP对不合格药品提出的管理要求,并将其内嵌的质量管理理论及方法融入到自身管理实践之中,不仅能使自身的经营风险降低,还能提升企业的经营效率和经济效益,实现新《药品管理法》监管下的社会责任与担当。
参考文献
[1] 宋秀君. 药品批发企业不合格药品管理的实践[J]. 世界最新医学信息文摘, 2016, 16(39): 151; 154.
[2] 徐非. 科学把握新《药品管理法》的辩证思维[J]. 中国食品药品监管, 2019(9): 4-15.
[3] 石盛林, 黄宝凤. 质量管理理论方法与实践[M]. 南京: 东南大学出版社, 2014: 36.
[4] 涂淑丽. 仓储运营管理[M]. 南昌: 江西人民出版社, 2016: 123.
[5] 周兴建. 现代物流管理概论[M]. 北京: 中国纺织出版社, 2016: 120.
[6] 周碧雯. 药品批发企业实施GSP的意义[J]. 上海医药, 2020, 41(9): 53-56.



