孙源远 王欣 周辉 刘弘忍
(上海上药第一生化药业有限公司 上海 200240)
随着动物源性组织、细胞、体液制备的生物制品逐渐增多,应用范围越来越广,生物组织提取制品中潜在的动物源性病毒感染问题愈发受到关注[1-2]。2005年国家药品评审中心发布《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术评审一般原则》,规定对生物组织提取制品生产工艺进行病毒去除/灭活验证及有效工艺步骤的评价[3-4]。目前由动物组织提取的生化药制品,大多采用有机试剂提取、酸碱提纯、盐析梯度沉淀等方法对生物组织中的有效成分进行提取,但其生产工艺中缺乏病毒去除/灭活的步骤,这一方面不符合现行药品法规的规定,另一方面也对后续的药品质量埋下隐患。因此,本研究针对动物组织提取中较为常见的工艺步骤,增加病毒去除/灭活验证,完善工艺质量体系。
1 材料和方法
1.1 样品
三批次垂体前叶粉(批号为161029、161112和170101,泰兴市金叶农副产品有限公司):三批次垂体前叶沉淀前滤清液(批号为520171102、520171103和520171104)、三批次硫酸鱼精蛋白粗制中间体(批号490190401-1、490190402-1和490190403-1)、三批次硫酸鱼精蛋白精制中间体(批号490190401-2、490190402-2和490190403-2)均来自上海上药第一生化药业有限公司。
1.2 指示病毒
考虑指示病毒的基因组、有无包膜和理化抗性等因素,同时结合促皮质素和硫酸鱼精蛋白的病毒灭活验证工艺,选择了六种具有代表性的指示病毒(表1)。

表1 指示病毒及其理化性质
1.3 方法
促皮质素病毒去除/灭活工艺验证都选择加热步骤和丙酮沉淀步骤;硫酸鱼精蛋白病毒去除/灭活工艺验证选择酸醇处理步骤和加热步骤。
病毒滴度测定参照消毒技术规范(2002版)“2.1.1.10病毒灭活试验”[5]以及《动物病毒学》(第二版)“(四)病毒感染力的滴定”[6]的标准,应用微量滴定法测定。
1.3.1 促皮质素病毒去除/灭活工艺验证
促皮质素是垂体前叶粉经过盐酸丙酮法提取再经丙酮沉淀得到,因此选择了工艺中盐酸加热步骤和丙酮沉淀步骤作为病毒去除/灭活步骤。
1)加热步骤 取垂体前叶粉加入7倍量(W/V)丙酮,3倍量(W/V)1 mol/L HCl溶液,搅拌溶解15 min后,将其置于(51±1)℃恒温水浴锅中,待样品温度升至50 ℃时,按25∶1(样品-病毒,V∶V)比例分别加入指示病毒EMCV、PPV或ReoV-3,混匀后开始计时,继续于(51±1)℃恒温水浴锅中保温灭活,分别在0、5、15、30和60 min时从中取样测定各取样时间点的病毒滴度。最终病毒灭活效果以样品与起始滴度对照的病毒滴度差值计算。
2)丙酮沉淀步骤 按9∶1(垂体前叶中间体滤清液-病毒,V∶V)比例分别加入指示病毒BVDV,PRV或VSV,混匀。取其中一份,加入7倍量纯水,剩余五份分别按1∶7(样品-冷丙酮,V∶V)比例加入冷丙酮,搅拌混匀后继续于(51±1)℃恒温液浴循环两用槽中静置沉淀,开始计时,分别在计时至0、5、15、30和60 min时取出一份,3 000 r/min离心(Eppendorf Centrifuge 5810R)1 min后,用移液器分离上清和沉淀,沉淀用纯水复溶至原体积,分别从上清和沉淀复溶液中取样测定病毒滴度。最终病毒灭活效果以样品与起始滴度对照的病毒滴度差值计算。
3)盲传三代 将各指示病毒三批次加热保温30 min取样的样品50倍稀释度的测定细胞孔(测定为阴性的细胞孔)分别进行盲传三代。
1.3.2 硫酸鱼精蛋白病毒去除/灭活工艺验证
硫酸鱼精蛋白是由鱼白粗品经过酸醇提取,高温、酸碱去除核酸最终得到,因此选取了酸醇处理和加热步骤作为病毒去除/灭活步骤。
1)酸醇处理步骤 取粗制中间体,按每公斤粗品加入1.2 L酸醇溶液(量取98%硫酸147 mL加入纯化水至2 L待用,再量取95%乙醇240 mL,加入上述硫酸溶液,再加纯化水至总体积2.4 L,配制成含6%硫酸的酸醇溶液)计算加入酸醇溶液,将其置于(16±1)℃恒温液浴循环两用槽中,按15∶1(粗制中间体-病毒,W∶V)比例加入指示病毒PRV和VSV,搅拌混匀后开始计时,分别在计时至0、0.5、1和2 h时从中取样测定各取样时间点的病毒滴度。最终病毒灭活效果以样品与起始滴度对照的病毒滴度差值计算。
2)加热步骤 取精制中间体,加入2.5倍重量(W∶V)的纯水,将其置于(86±1)℃恒温水浴锅中加热至85 ℃后,用玻棒搅拌10 min使中间体全部溶解,再按14∶1(样品-病毒,W∶V)比例加入指示病毒PPV和ReoV-3,混匀后开始计时,分别在计时至0、10、20和30 min时从中取样用培养基稀释200倍后测定各取样时间点的病毒滴度。
3)盲传三代 将各指示病毒三批次加热保温30 min时取样的样品加入50倍稀释度的测定细胞孔(测定为阴性的细胞孔)分别进行盲传三代。
2 结果
2.1 促皮质素病毒去除/灭活工艺验证
2.1.1 加热法病毒灭活
三批次样品中EMCV、PPV和ReoV-3滴度均降至检测限1.7 logs(经细胞毒试验,将培养基稀释50倍,此时细胞生长良好,所以检测限为1.7 logs)以下,滴度平均下降值≥4 logs(表2),表明该升温过程对这些病毒具有灭活作用。

表2 加热时间对促皮质素中病毒灭活的影响
2.1.2 丙酮沉淀步骤病毒灭活
三批次上清和沉淀中BVDV、PRV和VSV滴度均降至检测限1.7 logs以下(表3)。

表3 丙酮处理时间对促皮质素中病毒灭活的影响
将三批次丙酮沉淀30 min时从上清和沉淀复溶液中分别取样的样品加入50倍稀释度的细胞孔(测定为阴性的细胞孔)分别进行盲传三代,指示细胞(MDBK细胞、ST细胞和Vero细胞)均正常生长,即盲传三代无病变,表明BVDV、PRV和VSV均被完全灭活。这些结果表明,该工艺对脂包膜指示病毒(BVDV、PRV和VSV)均具有快速灭活作用。
2.2 硫酸鱼精蛋白病毒去除/灭活工艺验证
2.2.1 酸醇处理步骤病毒灭活
三批次粗制中间体中加入酸醇溶液后再加入指示病毒,搅拌混匀后立即取样,三批次样品中PRV滴度均降至检测限1.50 logs(经细胞毒试验,将培养基稀释100倍,此时细胞生长良好,所以检测限为1.50 logs)以下,滴度平均下降值≥4.52 logs;取样后剩余染毒样品于(16±1)℃水浴搅拌保温,经搅拌保温灭活0.5 h,三批次样品中VSV滴度均降至检测限1.50 logs以下,滴度平均下降值≥ 4.30 logs(表4)。

表4 酸醇处理时间对硫酸鱼精蛋白中病毒滴度的影响
将三批次酸醇处理1 h时取样的样品加入100倍稀释度的细胞孔(测定为阴性的细胞孔)分别进行盲传三代,指示细胞(ST细胞/Vero细胞)均正常生长,即盲传三代无病变,表明指示病毒PRV和VSV均被完全灭活。这些结果表明,酸醇处理对脂包膜指示病毒PRV和VSV均具有快速灭活作用。
2.2.2 加热步骤病毒灭活
三批次精制中间体中加入纯水后升温至85 ℃,搅拌溶解后再加入指示病毒,混匀后立即取样,三批次样品中PPV和ReoV-3滴度均降至检测限1.80 logs(经细胞毒试验,将培养基稀释200倍,此时细胞生长良好,所以检测限为1.80 logs)以下,其中PPV滴度平均下降值≥4.08 logs,ReoV-3滴度平均下降值≥4.23 logs(表5)。
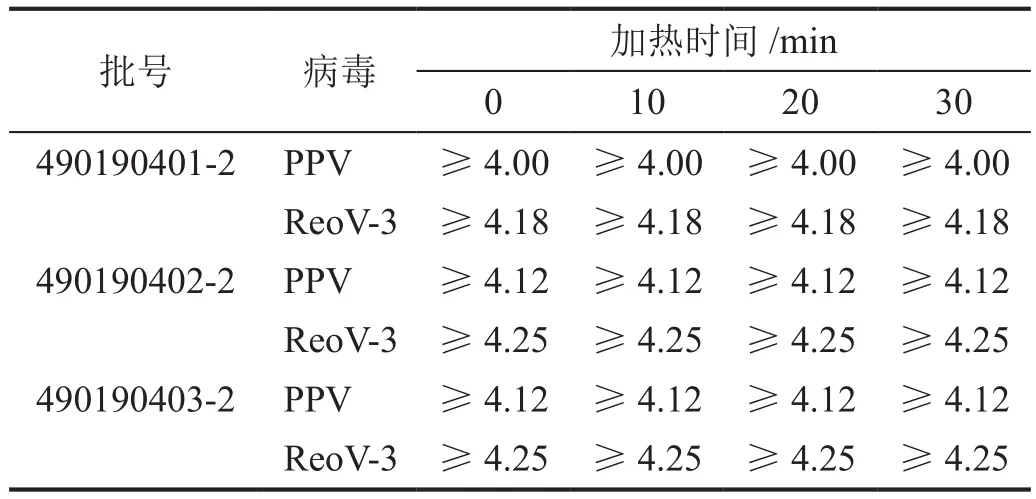
表5 加热时间对硫酸鱼精蛋白中病毒滴度的影响
将三批次加热20 min时取样的样品加入200倍稀释度的细胞孔(测定为阴性的细胞孔)分别进行盲传三代,指示细胞(ST细胞/LLC-MK2细胞)均正常生长,即盲传三代无病变,表明指示病毒PPV和ReoV-3均被完全灭活。这些结果表明,加热步骤对非脂包膜指示病毒PPV和ReoV-3也具有快速灭活作用。
3 讨论
本文三种动物源性生物组织提取制品经病毒去除/灭活工艺,病毒滴度下降值可达到4 logs,为有效的病毒去除/灭活工艺,达到了《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术评审一般原则》的安全标准。说明丙酮处理和加热法是在生产工艺中有效的病毒去除/灭活的方法。
病毒去除/灭活方法验证还须基于原始工艺步骤,其重要的原则是尽可能不改变原始工艺,因此本研究的几种方法并不是适用于全部的动物组织提取制品,除了本研究验证的去病毒方法,通常动物组织提取中还有S/D法[7-8]、巴氏消毒法[9]、色谱柱及纳米膜过滤法[10]等有效去除/灭活病毒的方法,可以针对不同工艺体系进行去病毒验证,以保证药品生产的质量。
鉴于动物组织提取制品的特殊性(其来源多为动物内脏或组织),所以除了针对其工艺进行去病毒工艺步骤的选择和验证,同时也要积极地改进工艺步骤,采用层析,超滤等本身具有病毒去除/灭活特性的步骤来达到药品质量的安全性;另一方面,药品生产企业也同时要把好粗品来源的关口,积极主动地进行原料商的审查,从粗品来源保证药品的质量。
致谢:感谢王小良,吴娟对本研究中病毒测定的贡献。



