李瀚纯 王鑫 瞿旭东 王舒
摘 要 近20年来,合成生物学在生物回路构建、生物元件标准化,以及各种基因组/代谢工程工具和方法的开发方面不断取得突破。合成生物学的快速发展正在改变生物技术行业的产业布局。目前,合成生物技术已广泛应用于天然产物合成、医学、能源、工业等多个领域。医药的需求也推动了合成生物学的发展,包括将体外催化技术应用于手性医药化学品的绿色制造,将异源途径整合到细胞中以有效生产药物等。合成生物学凭藉更经济、环境友好等突出特点,将颠覆一部分传统医药的制造方式。本文概要介绍合成生物学在手性医药化学品的绿色制造和植物天然产物的生物制造方面的应用进展。
关键词 合成生物学 医药化学品 天然产物 萜类化合物 芳香族化合物
中图分类号:Q819; O629.71 文献标志码:A 文章编号:1006-1533(2024)07-0024-08
引用本文 李瀚纯, 王鑫, 瞿旭东, 等. 合成生物学在医药领域的应用进展[J]. 上海医药, 2024, 45(7): 24-31; 55.
基金项目:国家重点研发计划项目(2022YFC 2303104)
Applications of synthetic biology in the pharmaceutical field
LI Hanchun, WANG Xin, QU Xudong, WANG Shu
(Abiochem Biotechnology Co., Ltd., Shanghai 200241, China)
ABSTRACT In the past two decades, synthetic biology has made breakthroughs in the construction of biocircuits, the standardization of biological elements and the development of various genomic/metabolic engineering tools and approaches. Its rapid development is changing the industrial layout of biotechnology industry. At present, synthetic biotechnology has been widely used in many fields such as natural product synthesis, medicine, energy and industry. Pharmaceutical demands have also driven its development, including the application of in vitro catalytic technology in the green manufacturing of chiral pharmaceutical chemicals and the integration of heterologous pathways into designer cells to efficiently produce medicines and so on. Synthetic biology, with its more economical and environmentally friendly features, will subvert some traditional pharmaceutical manufacturing methods. This article reviews the applications of synthetic biology in the green manufacturing of chiral pharmaceutical chemicals and the biological manufacturing of natural plant products.
KEY WORDS synthetic biology; pharmaceutical chemicals; natural products; terpenoids; aromatic compounds
合成生物学是采用工程科学研究理念,对生物体进行定向设计、理性改造甚至创造新型生物体的一门学科。合成生物学起源于20世纪初,基因组工程、生物基因组和染色体合成、通过多基因操控构建细胞工厂,这3条科技发展主线推动了合成生物学理论的发展和合成生物技术的实践。近年来,合成生物学快速发展,直接原因是:①基因测序、基因合成、基因编辑等生物学技术的进步[1];②上游技术成本降低使得合成生物技术在中游平台层和下游产品层公司快速普及,带来产业生态活力。
合成生物学融汇了生物学、基因组学、工程学和信息学等学科的知识和技术,具有重大的科学与技术价值。合成生物学采用“自下而上”的策略,将传统生命科学的研究范式从“认识生命”跨越到“设计生命”,是引领“第三次生物科学革命”的颠覆性技术。随着一系列关键的底层技术的发展,合成生物学工程化应用的步伐正在加快[2]。
合成生物制造以合成生物学为工具,是一种绿色生产方式,是解决全球气候变暖问题和实现碳中和目标的解决方案之一[3]。我国已将发展合成生物制造、加快合成生物技术发展和产业生态建设的重要性上升至国家战略高度。世界经济合作与发展组织指出,与石油化工路线相比,合成生物制造在降低工业过程消耗、减少“三废”排放和污染方面极具优势,可以大幅降低生产成本,实现产业升级[4-5]。未来,合成生物制造有可能彻底革新食品、农业、医药、能源、材料等行业的传统生产模式。医药生产的两大难点手性小分子药物和植物天然产物的生产也有望借助合成生物技术获得突破和产业升级。
1 手性医药化学品的绿色制造
医药化学品的开发及其制造水平是衡量一个国家科技发展水平的重要标准之一。手性医药化学品是医药化学品的重要组成部分,在2022年全球销售额排位前200名的小分子药物中,60%以上是手性小分子药物(https:// sites.arizona.edu/njardarson-lab/top200-posters/)。目前,手性医药化学品往往采用化学合成方式制造,存在诸如底物合成困难、催化剂昂贵且易中毒失活、产品ee值低等问题。生物催化是利用生物体系(如微生物或酶)作为催化剂来进行化学反应的技术,具有条件温和、环境友好、高效、高选择性的特点,非常适用于手性医药化学品的制造。
近几十年来,生物催化已广泛应用于各种化学合成过程中。例如,工业上大规模采用的腈水合酶法制备丙烯酰胺,就是生物催化法替代化学催化法的典型案例。近年来,生物催化在复杂药物分子合成上的应用也越来越多,并逐步成为大型制药和精细化学品公司相关化学工艺路线开发的关键技术。
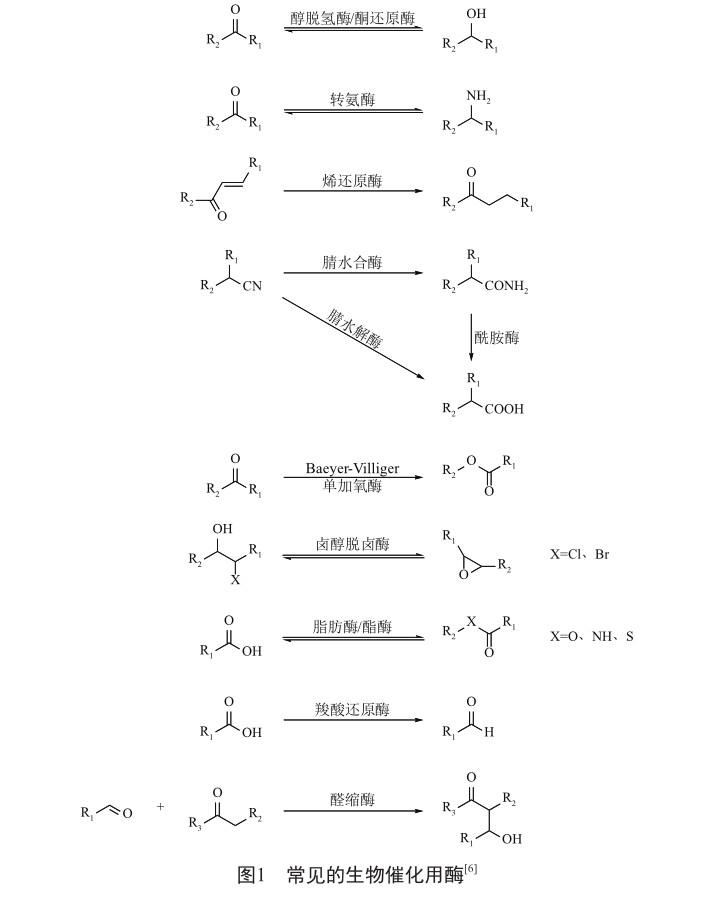
生物催化中常用的酶主要有氧化还原酶(羰基还原酶、亚胺还原酶、烯还原酶、Baeyer-Villiger单加氧酶、单胺氧化酶)、转移酶(转氨酶)、裂解酶(腈水解酶、卤醇脱卤酶、酰基转移酶)等(图1)。
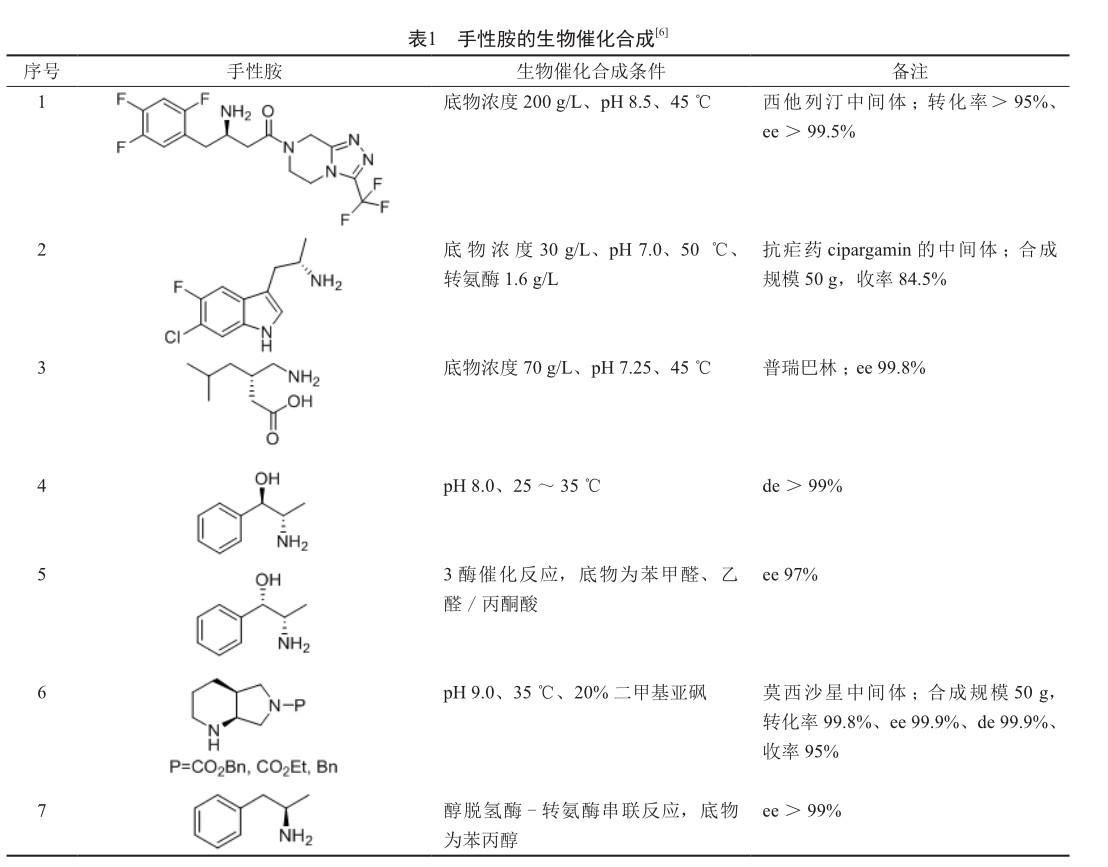
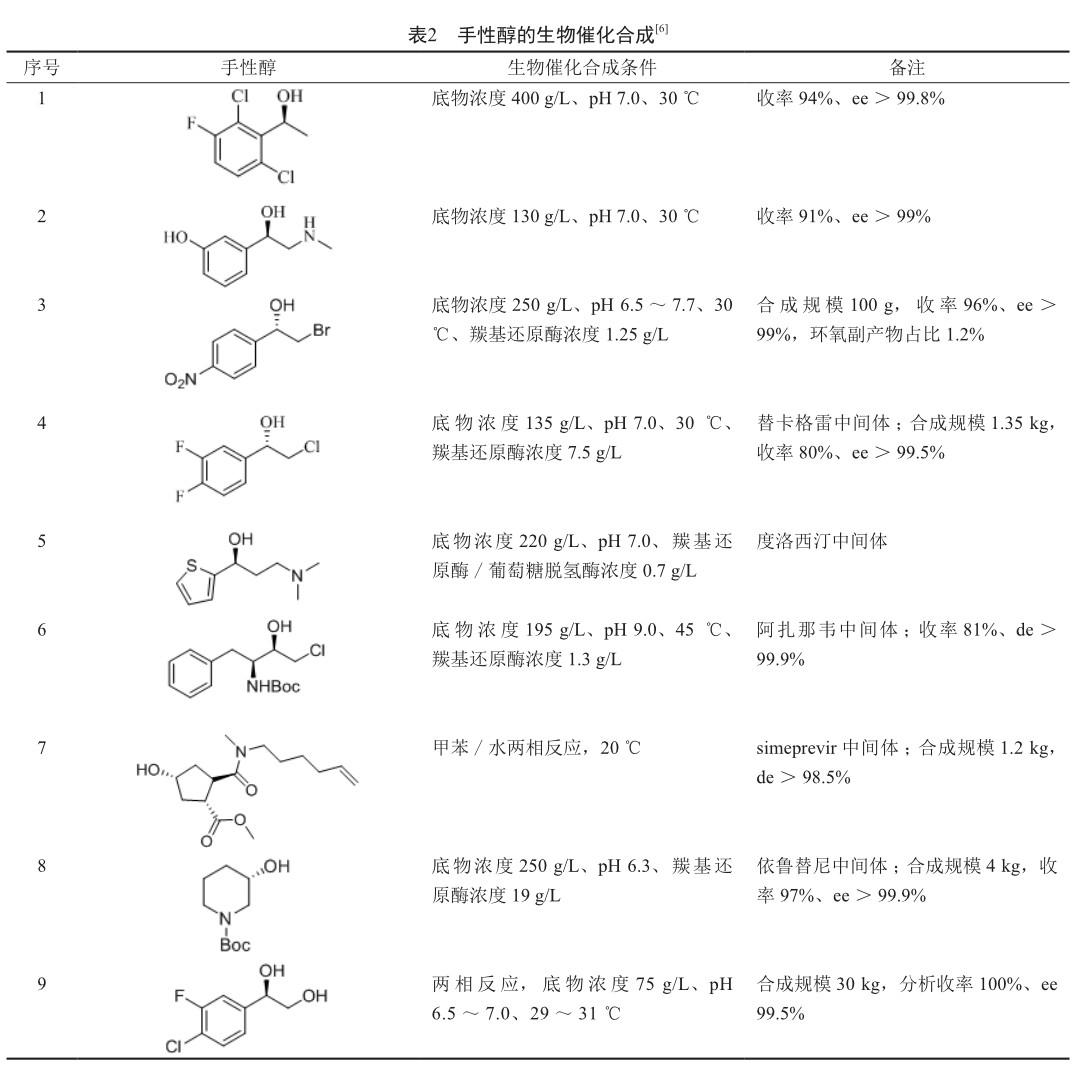
手性胺类、手性醇类、手性氨基酸类是重要的医药中间体。在全球销售额排位前200名的小分子药物中,有40个药物的分子具有手性胺结构(不包括手性氨基酸),52个药物的分子具有手性醇结构,38个药物的分子具有手性氨基酸结构(不包括10个多肽药物)[7]。因此,手性胺类、手性醇类、手性氨基酸类医药中间体的生物合成是生物催化的主要研究方向之一(表1~3)。
2 植物天然产物的微生物重组合成
植物天然产物是指植物次生代谢所产生的能够帮助植物抵御外界侵扰或者充当信号物质参与环境响应的一类具有生物活性的小分子化合物。
在医药领域,植物天然产物是药物及其先导化合物的重要来源,在近40年获批上市的药物中,天然产物及其衍生物占1/4。植物天然产物主要依赖传统的植物提取方式进行生产,难以满足社会发展的需求。此外,某些药用植物天然资源濒危,人工种植困难或生长周期长,且活性成分含量低,提取过程繁琐、收率低。同时,多数天然产物结构复杂,化学合成路径长,反应过程复杂、产率低、能耗高、污染重、成本高,很难实现环境友好的规模化生产[1, 8]。
基于合成生物学的原理,将药用植物基因组装、编辑到微生物细胞中,开创通过微生物发酵制造天然产物的新方法,可以突破植物资源限制,具有环境友好、生产速度快、易于大规模生产等多种优势,是未来合成生物制造产业发展的重要方向之一[9]。
通过多年的努力,研究人员已构建了青蒿素、人参皂苷、番茄红素、β-胡萝卜素、甜菊糖、红景天苷、天麻素、灯盏花素、丹参新酮等一批植物天然产物的生物制造路线[5, 10-11]。
2.1 萜类化合物
萜类化合物广泛存在于自然界,是五碳化合物异戊二烯的衍生物,是最大一类植物次级代谢产物。迄今已发现超过8万种的萜类化合物,约占已鉴定天然产物的60%[12-13]。青蒿素、人参皂苷和类胡萝卜素均属于萜类化合物(表4)。
抗疟药青蒿素是在我国传统中草药青蒿中发现的一种倍半萜类化合物,目前主要从黄花蒿中提取(含量非常低,仅0.01%~1%),或者提取其中含量较高的青蒿酸,然后再通过化学方法合成。但这些生产方法的产能很低,难以满足医疗需求。由于青蒿素分子中含有多个手性中心,其化学全合成是非常困难和低效的。
微生物重组合成青蒿素前体可以大幅降低青蒿素的合成成本,是一条非常有潜力的合成路径,也是生物合成天然产物的典型案例。2013年,Paddon等[21]报告在酵母中打通了青蒿酸的生物合成路径,青蒿酸产量达25 g/L。该研究工作被认为是通过合成生物学方式生产天然产物的里程碑[22]。2020年,Paddon等[14]又描述了进一步用易错聚合酶链式反应方法对来自黄花蒿的细胞色素P450氧合酶CYP71AV1的基因进行饱和突变,获得的8位点组合突变体可使青蒿酸的发酵产量大幅提高至45g/L的专利技术。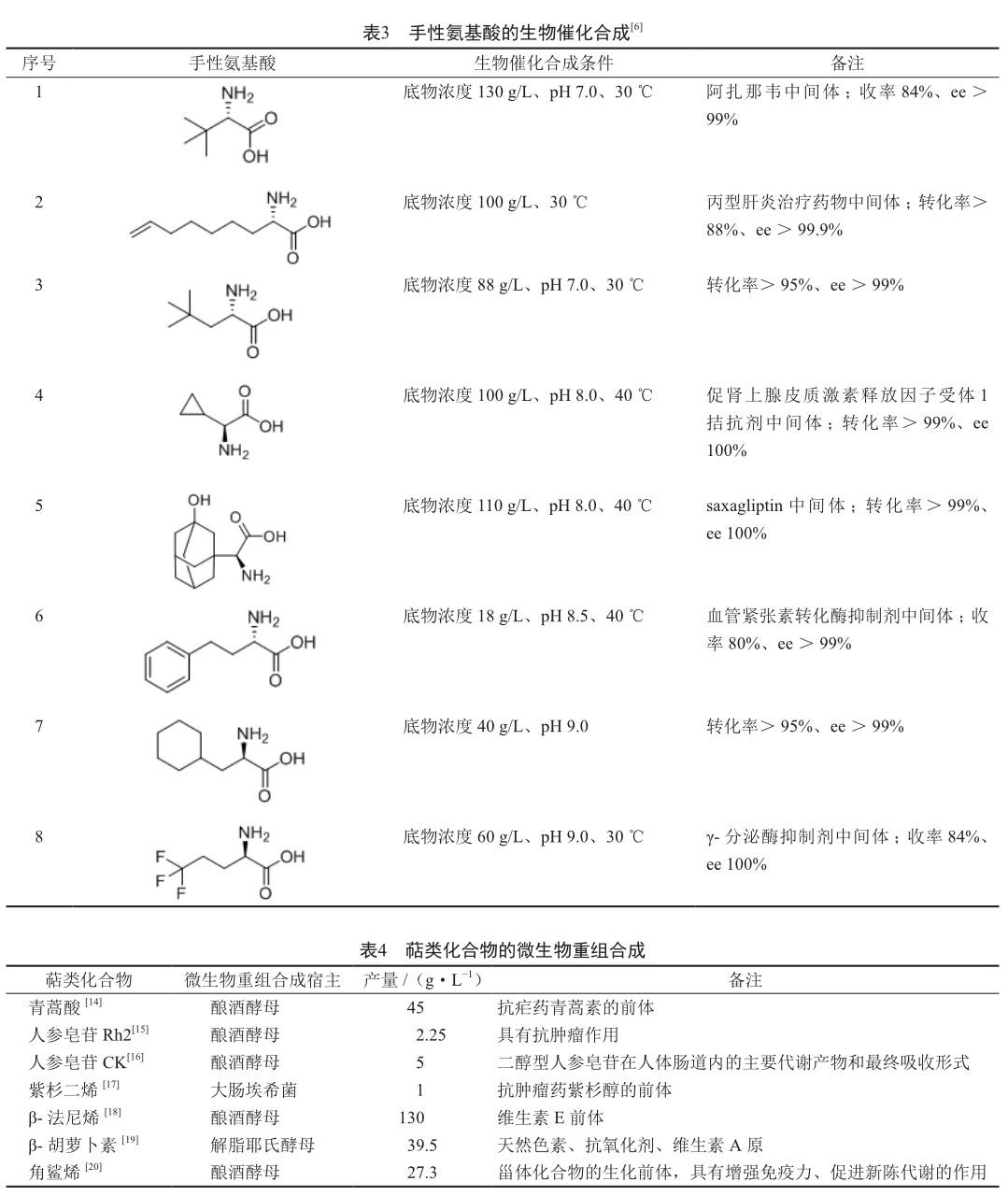
人参皂苷是在植物中发现的三萜皂苷,具有抗氧化、抗炎、舒张血管、抗过敏、抗糖尿病等作用。人参皂苷市场需求大,但受限于人参资源稀少和其在人参中的含量过低[23],供应量远远不能满足人们的需求。
中国科学院天津工业生物技术研究所的张学礼研究团队和中国科学院分子植物科学卓越创新中心的赵国屏研究团队均在人参皂苷的生物合成方面取得了卓越成果。张学礼研究团队通过优化甲羟戊酸途径,优化基因模块组合,调控达玛烯二醇Ⅱ(人参皂苷生物合成途径中的重要中间体)合酶基因和麦角甾醇合成途径中的ERG7基因的表达,以及优化发酵工艺等策略,创建出达玛烯二醇Ⅱ的产量能达到15 g/L的高效酵母细胞工厂[24],并解析了达玛烷型皂苷的生物合成途径[25]。该研究团队还通过重建新的反应区室,大幅提高了原人参二醇的合成效率,并在此基础上引入人参皂苷CK的高效合成模块,获得了在5 L发酵罐中能生产出5 g/L人参皂苷CK的工程菌[16]。
赵国屏研究团队通过解析稀有人参皂苷成分的合成途径,鉴定合成途径的关键元件,系统强化甲羟戊酸途径,以及调控关键基因的表达等手段,解决了前体原人参二醇合成效率低、元件与底盘细胞的适配性问题,构建了利用单糖发酵从头高效合成原人参二醇的酿酒酵母细胞工厂,10 L发酵罐的产量达到11 g/L[15]。基于此底盘,该研究团队又对原人参二醇向人参皂苷Rh2转化中的一步糖基化反应进行了系统优化,实现了人参皂苷Rh2的高效合成,10 L发酵罐的产量达到2.25 g/L[15]。目前,赵国屏研究团队已成功地将15种人参皂苷单体化合物的发酵产量提高至产业化水平,包括人参皂苷CK、Rg3、Rh1、Rh2、F1、Rg2和三七皂苷R1、R2等稀有人参皂苷成分,可以实现人参皂苷各种单体成分的高产率、高纯度、低成本生产。
类胡萝卜素是一类由类异戊二烯单元聚合形成的天然色素,是典型的四萜化合物,天然存在于细菌、真菌、藻类和植物中。目前已实现工业化生产且应用广泛的类胡萝卜素有β-胡萝卜素、番茄红素和虾青素等[26],尤以β-胡萝卜素的应用最为广泛。
β-胡萝卜素是维生素A的前体,具有着色、抗氧化和营养等作用,广泛用于食品和保健品行业。β-胡萝卜素虽广泛存在于真菌、藻类和植物中,但从这些自然资源中提取生产β-胡萝卜素的效率极低。因此,目前化学合成仍是大规模生产β-胡萝卜素的主要方法之一。不过,化学合成法也面临着一些挑战,如工艺复杂、“三废”问题等。近年来,微生物发酵法因其生物安全性、环境友好性和可持续性而成为β-胡萝卜素生产的一种有前途的替代方法。合成生物学技术的不断发展也极大地推动了β-胡萝卜素在大肠埃希菌、酿酒酵母、解脂耶氏酵母等常用底盘中的高效合成(每升数克级)研究[27],但尚未达到可工业化生产水平。
美国麻省理工学院的Gregory Stephanopoulos研究团队在类胡萝卜素生物合成方面进行了系统的研究,首次发现番茄红素环化酶的底物抑制效应问题。他们通过蛋白质工程和代谢流调控手段解决了类胡萝卜素微生物合成中存在的酶调控问题,有效地解除了底物抑制效应,最终β-胡萝卜素的产量达到39.5 g/L[19]。
2.2 芳香族天然产物
芳香族天然产物是一类具有苯环结构的有机化合物,包括对羟基肉桂酸及其衍生物、黄酮类、芪类、香豆素类和芳香族生物碱等。芳香族天然产物种类繁多、数量庞大,已知的有数万种[28]。按分子骨架结构分,芳香族天然产物中应用最广泛的是C6-C1型(水杨酸类)、C6-C2型(香草乙酮类)、C6-C3型(咖啡酸类)、C6-C2-C6型(二苯乙烯类)和C6-C3-C6型(黄酮类)这5型化合物(图2)。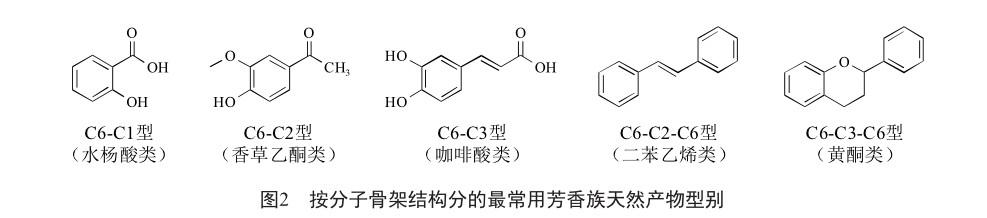
芳香族天然产物广泛存在于植物中,其关系到植物的生长调节和对病虫侵袭的防御作用[29]。芳香族天然产物在植物中的含量很低,经常受限于资源问题而不能通过提取进行规模化生产。近年来,研究人员运用合成生物学技术在生物合成芳香族天然产物方面取得了诸多突破[30],生物合成芳香族天然产物已成为天然产物研究领域的热点之一。
C6-C1型化合物原儿茶酸,即3,4-二羟基苯甲酸,是一种水溶性酚酸类化合物,存在于许多食用和药用植物中,具有抗菌、抗炎、抗氧化、抗高血糖、抗肿瘤和神经保护作用。
Kogure等[31]在谷氨酸棒杆菌中构建了两条原儿茶酸合成路径——3-脱氢莽草酸途径和4-羟基苯甲酸途径,从葡萄糖出发发酵生产原儿茶酸,产量达82.7 g/L,自葡萄糖计的得率为32.8%(mol/mol)。
在此之前,中国科学院天津工业生物技术研究所的王钦宏研究团队发现,原儿茶酸的细胞毒性较强,若以葡萄糖为碳源进行从头合成,原儿茶酸的产量只能达到33.3 g/L[32]。因此,该研究团队此后继续努力,采用分步合成的方式解决细胞毒性问题,首先构建可高效合成3-脱氢莽草酸的细胞工厂,补料发酵浓度超过90 g/L,然后再利用表达3-脱氢莽草酸脱水酶的大肠埃希菌进行全细胞催化,最终得到产量达85 g/L以上的原儿茶酸,基本检测不到3-脱氢莽草酸残留[33]。
C6-C2型化合物羟基酪醇主要存在于橄榄植物中,作为一种食品抗氧化剂,已广泛应用于食用油、饮料、肉制品和乳制品生产行业。羟基酪醇还有许多重要的药理活性,包括抗肿瘤、抗炎、软骨保护和抗骨质疏松作用。羟基酪醇主要从橄榄植物的叶子和果实中提取,但存在生产周期长、回收率低和原材料供应随季节变化等问题。因此,若能构建微生物细胞工厂合成羟基酪醇,则不仅环保、成本低,而且可以获得一定的经济利益。
江南大学的陈坚研究团队周景文课题组利用大肠埃希菌合成羟基酪醇[34]。首先,在TyrR失活的大肠埃希菌中构建羟基酪醇的从头合成途径。通过过表达突变体aroGfbr和去反馈抑制环己二烯基脱氢酶减轻aroG表达受到的抑制。同时,敲除磷酸转移酶系统、苯丙氨酸合成途径,增强还原型黄素二核苷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸的再生,进一步增加羟基酪醇的积累。然后,又研究了不同来源HpaBC和HpaB的不同突变体对羟基酪醇从头合成的影响。最后,结合转化甘油策略,在5 L发酵罐中使羟基酪醇的产量达到9.87 g/L。
C6-C3型化合物是一类广泛存在于中草药中的天然产物,其中咖啡酸具有抑菌、抗炎、抗病毒、抗氧化等药理活性,临床上主要用于外科手术时预防出血或止血,还可用于缓解白细胞减少症、血小板减少症等。此外,咖啡酸也是很多其他重要的酚酸类化合物的合成前体,如绿原酸、迷迭香酸和咖啡酸苯乙酯等。
江南大学的陈坚研究团队周景文课题组针对现有咖啡酸生物合成报告中存在的中间体积累、辅因子不足和产物不耐受等问题,采用系统工程策略重构了咖啡酸在大肠埃希菌中的生物合成途径[35]。首先,通过筛选脱氨酶和4-羟基苯乙酸-3-单加氧酶,实现从酪氨酸脱氨、羟化合成咖啡酸的过程。然后,分别尝试优化基因连接方式和质粒拷贝数、敲除咖啡酸合成前体酪氨酸竞争途径基因、过表达苯丙素类转运体基因、增加内源性核黄素合成、过表达糖ABC转运蛋白透性酶基因等手段,使咖啡酸的摇瓶产量增至0.78 g/L。最后,经过优化发酵条件,在5 L发酵罐中将咖啡酸的产量提高到7.9 g/L。
C6-C2-C6型化合物多是芪类化合物,其中白藜芦醇为三羟基芪类化合物,是一种天然抗毒素,广泛分布于葡萄、浆果、花生和其他植物中。临床研究表明,白藜芦醇可以改善糖尿病、心血管疾病和神经系统疾病症状,还具有抗肿瘤、抗氧化作用,常被用作食品、化妆品的功能性添加剂。目前,白藜芦醇主要来自植物提取,但提取工艺复杂,产量受到限制,难以满足市场需求。因此,利用微生物细胞工厂合成白藜芦醇成为一种有吸引力和可持续的替代方案。迄今为止,研究人员已在多种不同的底盘微生物(大肠埃希菌、谷氨酸棒杆菌、乳酸乳球菌等)中构建了白藜芦醇生物合成途径[36]。
针对目前存在的前体供应不足、异源途径酶合成效率低下等问题,江南大学的陈坚研究团队周景文课题组利用解脂耶氏酵母合成白藜芦醇[37]。首先,筛选异源的白藜芦醇合成途径基因,以获得最佳的白藜芦醇生产菌株。接下来,通过增加前体供应、融合表达4CL和STS基因以提高催化效率和碳代谢重排,将碳通量引向莽草酸合成途径。然后,通过整合异源关键途径基因、增加丙二酰辅酶A的前体供应,使24孔板中发酵96 h的白藜芦醇产量增至0.82 g/L。最后,经过对5 L发酵罐生产工艺的优化,利用全合成培养基和发酵条件调控,使发酵过程中菌株一直处于酵母形态,发酵144 h后的白藜芦醇产量达到22.5 g/L,自葡萄糖计的收率为65.5 mg/g,产率0.16 g/(L·h)。
3 展望
我国“十四五”规划和2035年远景目标纲要中已明确将合成生物学列为科技前沿领域之一。在国家发展生物经济战略方针的指导下,许多地方政府将合成生物学列为其发展规划的重点关注领域,并根据自身区域产业和经济特点,支持合成生物技术企业落地和产业链布局。在技术突破、资本关注、政策引导等多因素影响下,合成生物产业正在从技术驱动的初创期迈入产品成型的成长期,合成生物学支撑的生物制造产业正在成为快速发展的战略性新兴产业。随着生物制造进入快速产业化阶段,其商业化产品数量大幅增加,产业链建设速度加快。在科技创新驱动发展战略政策的引领下,依托合成生物制造技术,实现稀缺医药化学品的生产向绿色低碳、无毒无害、可持续发展的新模式迈进,将满足人们对营养、健康、美丽生活品质的更高需求,最终实现提升生命质量、延长生命长度的美好愿景。
参考文献
[1] 李寅. 合成生物制造2022 [J]. 生物工程学报, 2023, 39(3): 807-841.
[2] 赵国屏. 合成生物学:从“造物致用”到产业转化[J]. 生物工程学报, 2022, 38(11): 4001-4011.
[3] Church GM, Elowitz MB, Smolke CD, et al. Realizing the potential of synthetic biology [J]. Nat Rev Mol Cell Biol, 2014, 15(4): 289-294.
[4] 曾艳, 赵心刚, 周桔. 合成生物学工业应用的现状和展望[J]. 中国科学院院刊, 2018, 33(11): 1211-1217.
[5] 张媛媛, 曾艳, 王钦宏. 合成生物制造进展[J]. 合成生物学, 2021, 2(2): 145-160.
[6] Hughes DL. Biocatalysis in drug development—highlights of the recent patent literature [J]. Org Process Res Dev, 2018, 22(9): 1063-1080.
[7] 陈曦, 吴凤礼, 樊飞宇, 等. 手性医药化学品的绿色生物合成[J]. 生物工程学报, 2022, 38(11): 4240-4262.
[8] 毕慧萍, 刘晓楠, 李清艳, 等. 植物天然产物微生物重组合成研究进展[J]. 生物工程学报, 2022, 38(11): 4263-4282.
[9] Zhu X, Liu X, Liu T, et al. Synthetic biology of plant natural products: from pathway elucidation to engineered biosynthesis in plant cells [J]. Plant Commun, 2021, 2(5): 100229.
[10] 戴住波, 王勇, 周志华, 等. 植物天然产物合成生物学研究[J]. 中国科学院院刊, 2018, 33(11): 1228-1238.
[11] 孙文涛, 李春. 微生物合成植物天然产物的细胞工厂设计与构建[J]. 化工进展, 2021, 40(3): 1202-1214.
[12] Chang MC, Eachus RA, Trieu W, et al. Engineering Escherichia coli for production of functionalized terpenoids using plant P450s [J]. Nat Chem Biol, 2007, 3(5): 274-277.
[13] Yan X, Liu X, Zhao C, et al. Applications of synthetic biology in medical and pharmaceutical fields [J]. Signal Transduct Target Ther, 2023, 8(1): 199.
[14] Paddon CJ, Jiang H, Kung SH. Amorpha-4,11-diene 12-mononzygenase variants and uses thereof: WO, 2021150960A1 [P]. 2020-01-23.
[15] Wang P, Wei W, Ye W, et al. Synthesizing ginsenoside Rh2 in Saccharomyces cerevisiae cell factory at high-efficiency [J]. Cell Discov, 2019, 5: 5.
[16] Shi Y, Wang D, Li R, et al. Engineering yeast subcellular compartments for increased production of the lipophilic natural products ginsenosides [J]. Metab Eng, 2021, 67: 104-111.
[17] Ajikumar PK, Xiao W, Tyo KE, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli [J]. Science, 2010, 330(6000): 70-74.
[18] Meadows AL, Hawkins KM, Tsegaye Y, et al. Rewriting yeast central carbon metabolism for industrial isoprenoid production [J]. Nature, 2016, 537(7622): 694-697.
[19] Ma Y, Liu N, Greisen P, et al. Removal of lycopene substrate inhibition enables high carotenoid productivity in Yarrowia lipolytica [J]. Nat Commun, 2022, 13(1): 572.
[20] Zhang Y, Wang W, Wei W, et al. Regulation of ethanol assimilation for efficient accumulation of squalene in Saccharomyces cerevisiae [J]. J Agric Food Chem, 2023, 71(16): 6389-6397.
[21] Paddon CJ, Westfall PJ, Pitera D, et al. High-level semisynthetic production of the potent antimalarial artemisinin [J]. Nature, 2013, 496(7446): 528-532.
[22] 王冬, 戴住波, 张学礼. 酵母人工合成细胞生产植物源天然产物[J]. 微生物学报, 2016, 56(3): 516-529.
[23] Sivakumar G, Yu KW, Paek KY. Production of biomass and ginsenosides from adventitious roots of Panax ginseng in bioreactor cultures [J]. Eng Life Sci, 2005, 5(4): 333-342.
[24] 王冬, 刘怡, 许骄阳, 等. 创建酿酒酵母细胞工厂高效生产人参皂苷前体达玛烯二醇Ⅱ[J]. 药学学报, 2018, 53(8): 1233-1241.
[25] Wang D, Wang J, Shi Y, et al. Elucidation of the complete biosynthetic pathway of the main triterpene glycosylation products of Panax notoginseng using a synthetic biology platform [J]. Metab Eng, 2020, 61: 131-140.
[26] Takaichi S. Carotenoids in algae: distributions, biosyntheses and functions [J]. Mar Drugs, 2011, 9(6): 1101-1118.
[27] 王颖, 曲俊泽, 梁楠, 等. 合成类胡萝卜素细胞工厂的快速构建和定向进化[J]. 化工进展, 2021, 40(3): 1187-1201.
[28] Cao M, Gao M, Suástegui M, et al. Building microbial factories for the production of aromatic amino acid pathway derivatives: from commodity chemicals to plant-sourced natural products [J]. Metab Eng, 2020, 58: 94-132.
[29] 刘良叙, 李朝风, 王嘉伟, 等. 芳香类天然产物的合成生物学研究进展[J]. 生物工程学报, 2021, 37(6): 2010-2025.
[30] Yang D, Park SY, Park YS, et al. Metabolic engineering of Escherichia coli for natural product biosynthesis [J]. Trends Biotechnol, 2020, 38(7): 745-765.
[31] Kogure T, Suda M, Hiraga K, et al. Protocatechuate overproduction by Corynebacterium glutamicum via simultaneous engineering of native and heterologous biosynthetic pathways [J]. Metab Eng, 2021, 65: 232-242.
[32] 王钦宏, 陈五九, 江小龙, 等. 一株生产原儿茶酸的大肠杆菌基因工程菌及其构建方法与应用: 中国, 109943512B[P]. 2017-12-21.
[33] 吴凤礼, 王晓霜, 宋富强, 等. 芳香族化合物微生物代谢工程研究进展[J]. 生物工程学报, 2021, 37(5): 1771-1793.
[34] Wang H, Wang L, Chen J, et al. Promoting FADH2 regeneration of hydroxylation for high-level production of hydroxytyrosol from glycerol in Escherichia coli [J]. J Agric Food Chem, 2023, 71(44): 16681-16690.
[35] Wang L, Li N, Yu S, et al. Enhancing caffeic acid production in Escherichia coli by engineering the biosynthesis pathway and transporter [J]. Bioresour Technol, 2023, 368: 128320.
[36] Thapa SB, Pandey RP, Park YI, et al. Biotechnological advances in resveratrol production and its chemical diversity[J]. Molecules, 2019, 24(14): 2571.
[37] Liu M, Wang C, Ren X, et al. Remodelling metabolism for high-level resveratrol production in Yarrowia lipolytica [J]. Bioresour Technol, 2022, 365: 128178.



